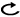6

| プラチナ製剤 | シスプラチンとカルボプラチンの総称 | |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 一般状態 |
| QOL | quality of life | 生活の質 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害剤 |
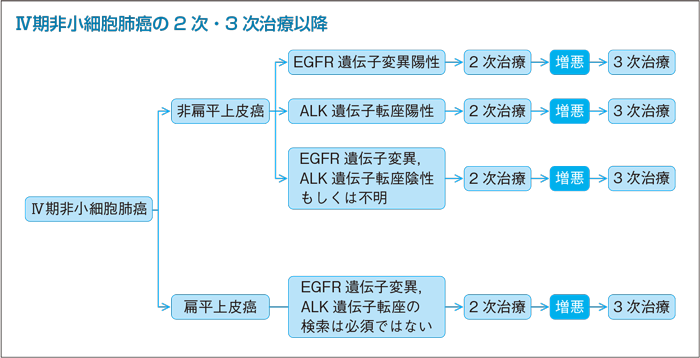
1次治療EGFR-TKI未使用例の2次治療:PS 0-2
- 推 奨
- EGFR-TKI単剤の投与を行うよう勧められる。(グレードA)
2次治療以降のゲフィチニブ単剤の有効性を検討した3つのランダム化比較第Ⅲ相試験が報告されており,PS 0-3の2次治療以降の再発非小細胞肺癌患者を対象にしたゲフィチニブ単剤とプラセボのランダム化比較第Ⅲ相試験であるISEL試験では,主要評価項目であるMSTにおいて,両群間に統計学的有意差を認めなかった。サブグループ解析では,腺癌では有意差を認めないが,非喫煙者とアジア人種においてゲフィチニブ単剤の延命効果を認めた1)。本邦で行われたPS 0-2の2次治療以降の再発非小細胞肺癌を対象にしたゲフィチニブ単剤とドセタキセル単剤のランダム化比較第Ⅲ相試験であるV15-32試験において,主要評価項目であるMSTにおいてドセタキセル単剤に対する非劣性が証明できなかった。サブグループ解析においてもOSとPFSにおける性別,組織型,喫煙歴などの主要項目で有意差を認めなかった2)。欧米とアジアの24カ国で行われたPS 0-2のプラチナ製剤無効2次治療以降の再発非小細胞肺癌を対象にしたゲフィチニブ単剤とドセタキセル単剤のランダム化比較第Ⅲ相試験であるINTEREST試験において,主要評価項目であるOSでドセタキセル単剤に対する非劣性が証明された。バイオマーカーによるサブグループ解析では,EGFR 遺伝子変異の有無によりPFSで差を認めるも,OSでは差を認めなかった3)。
一方,EGFR遺伝子変異のある症例における解析において,2007年に発表された,本邦における5つのゲフィチニブ単剤の第Ⅱ相試験のEGFR遺伝子変異のある症例101例を対象にした解析結果において,EGFR遺伝子変異のある症例の奏効率が80.8%であり,タイプ別にはExon19 deletionが80.3%,L858Rが81.8%であると報告された4)。2009年に発表された日本における7つのゲフィチニブ単剤の第Ⅱ相試験のEGFR遺伝子変異のある症例148例の解析では,奏効率が 76.8%,PFSが9.7カ月,OSが24.3カ月と報告された5)。
一方で,EGFR-TKIであるゲフィチニブ による間質性肺障害(ILD)のリスクが報告され,そのリスクファクターおよび発症後の予後不良因子について検討され報告されている6)7)。
ゲフィチニブ単剤は,第Ⅲ相試験にて標準的2次治療薬であるドセタキセル単剤と非劣性が証明された報告があり,EGFR遺伝子解析においてもレトロスペクティブあるいはサブグループ解析ではあるが,変異例の有効性が高いことが示されている。また,標準的ファーストライン化学療法と交差耐性がないと考えられているため,ファーストラインの治療成績を考慮し,ゲフィチニブ単剤を使用することは妥当であると考えられる。しかし,ILDの発症リスクや予後を含め慎重に症例を選択する必要がある。
①2次治療以降のエルロチニブ単剤の有効性を検討したランダム化比較第Ⅲ相試験と本邦での第Ⅱ相試験が報告されている。
- ⅰ)PS 0-3の2次治療以降の再発非小細胞肺癌患者731人をエルロチニブ単剤群とプラセボ群に2:1に割り付けた。
ランダム化第Ⅲ相比較試験BR.21試験では,RRがそれぞれ8.9% と1%(P<0.001),PFSがそれぞれ2.2カ月と1.8カ月(P<0.001),
主要評価項目であるOSが6.7カ月と4.7カ月(P<0.001)でいずれもエルロチニブ単剤群が有意に優れていた。また,臨床因子のサブグループ解析で非喫煙者の延命効果が際立っていたが,男性・扁平上皮癌・喫煙者を含むすべてのサブグループでほぼ一定の延命効果が得られた8)。 - ⅱ)PS 0-3の2次治療以降の再発非小細胞肺癌患者60人の日本人を対象とした第Ⅱ相試験では,RRが28.3%,病勢コントロール率が50.0%,PFSが77日,MSTが14.72カ月と報告された9)。
②EGFR遺伝子変異ある症例における解析
1次治療(113人)もしくは2次治療以降(104人)のEGFR遺伝子変異のある症例217例(ex19:135例/L858R:82例)を対象にエルロチニブ単剤を投与した前方視的試験では,RRが70.6%,PFSが14カ月,OSが27カ月であったと報告された10)。
一方で,EGFR-TKIであるゲフィチニブによるILDのリスクが報告され,そのリスクファクターおよび発症後の予後不良因子について検討され報告されている6)7)。
エルロチニブ単剤は,第Ⅲ相試験にて有効性が証明され,EGFR遺伝子解析においても変異症例の有効性が高いことが示されているため,エルロチニブ単剤を使用することは妥当であると考えられる。しかし,ILDの発症リスクや予後を含め慎重に症例を選択する必要がある。
1次治療EGFR-TKI未使用例の2次治療:PS 3-4
- 推 奨
- ゲフィチニブ単剤の投与を行うことを考慮してもよい。(グレードC1)
PS 3-4に関しては細胞障害性抗癌剤治療の適応がなく,これまで症状緩和を施行してきた。また,2次治療におけるゲフィチニブ単剤の有効性を示したINTEREST試験もPS 0-2を対象としている。しかし,1次治療ではあるが日本人を対象にEGFR遺伝子変異のあるPS 3-4が大多数を占める予後不良群にゲフィチニブ単剤投与を行った第Ⅱ相試験において,79%の患者にPSの改善を認め,RR66% OS17.8カ月,PFS6.5カ月と報告されている11)。
一方で,EGFR-TKIであるゲフィチニブ による間質性肺障害(ILD)のリスクが報告され,そのリスクファクターおよび発症後の予後不良因子について検討され報告され,PS不良は,EGFR-TKIによるILD発症の危険因子として知られている6)7)。
標準的ファーストライン化学療法と交差耐性がないと考えられているため,ファーストラインの治療成績も踏まえ,EGFR遺伝子変異のある非小細胞肺癌1次治療EGFR-TKI未使用のPS 3-4の2次治療においてゲフィチニブ単剤の投与を考慮する。しかし,ILDの発症リスクを含め慎重に症例を選択する必要がある。
1次治療EGFR-TKI使用の2次治療:PS 0-1
- 推 奨
- 進行期非小細胞肺癌の初回治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
標準的1次化学療法とEGFR-TKIは,交差耐性がないと考えられているため,1次化学療法の治療成績を考慮する。
1次治療EGFR-TKI使用の2次治療:PS 2
- 推 奨
- 進行期非小細胞肺癌の初回治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
標準的1次化学療法とEGFR-TKIは,交差耐性がないと考えられているため,1次化学療法成績を考慮する。
3次治療:PS 0-2
- 推 奨
- 非扁平上皮癌EGFR遺伝子変異とALK遺伝子転座陰性もしくは不明の2次治療を行うよう勧められる。(グレードB)
EGFR遺伝子変異とALK遺伝子転座陰性か不明非小細胞肺癌の標準的2次治療化学療法とEGFR-TKIは,交差耐性がないと考えられているため,EGFR 遺伝子変異とALK遺伝子転座陰性か不明の非小細胞肺癌の標準的2次治療化学療法の治療成績を考慮する。
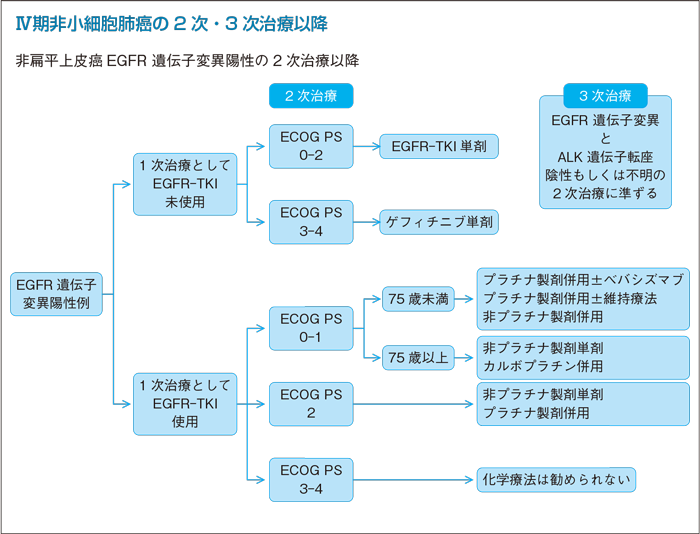
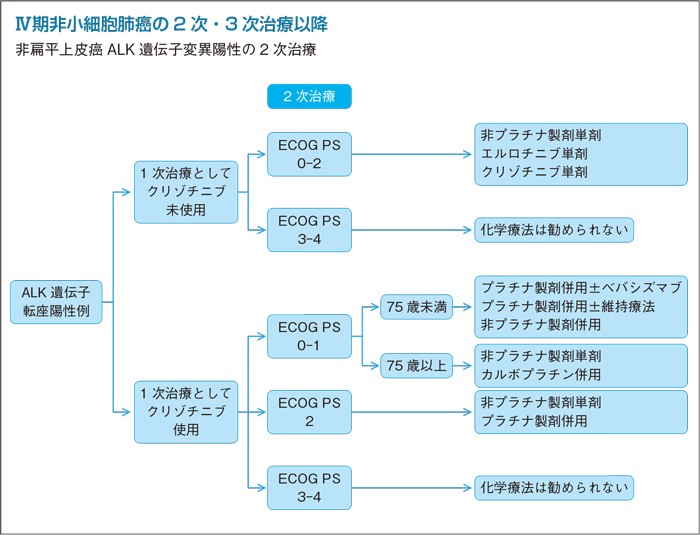
1次治療クリゾチニブ未使用例の2次治療:PS 0-2
- 推 奨
- a.クリゾチニブ単剤の投与を行うよう勧められる。(グレードA)
- b.ドセタキセル単剤の投与を行うよう勧められる。(グレードB)
- c.ペメトレキセド単剤の投与を行うよう勧められる。(グレードB)
- d.エルロチニブ単剤の投与を行うことを考慮してもよい。(グレードC1)
- e.2剤併用療法は有効性の証明がなく臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。(グレードC2)
- a.ALK遺伝子転座陽性に対するクリゾチニブはPS 0-2が大部分を占める第Ⅰ/Ⅱ相試験にてORR 61%,PFS 10カ月と良好な結果を示した12)13)。またレトロスペクティブ解析の結果から,ALK遺伝子転座陽性例ではクリゾチニブ投与の有無によってOSが大きく異なることが示唆されている14)。プラチナ製剤治療歴のあるALK遺伝子転座陽性例347例を対象として2次治療移行としてクリゾチニブと標準化学療法(ペメトレキセドまたはドセタキセル)を比較する第Ⅲ相が報告され,主評価項目であるPFSはクリゾチニブ群が7.7カ月,標準化学療法群が3.0カ月(HR 0.49,95%CI:0.37-0.64,P<0.001)とクリゾチニブ群で有意に良好であった15)。
- b.プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたドセタキセル単剤の第Ⅲ相試験が2つ報告されている。1つはドセタキセル(100mg/m2 or 75mg/m2) vs ビノレルビンorイホスファミドの比較試験でMSTでは有意差を認めないもののドセタキセル75mg/m2群でコントロール群と比較してRR,26週PFS率,1年生存率の有意な改善を認めた16)。また,ドセタキセル(100mg/m2 or 75mg/m2)とBSCとの比較ではMST,1年生存率は,ドセタキセル75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でドセタキセル単剤群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた17)。いずれの試験においても,ドセタキセル75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはドセタキセル75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でRR18.2%,MST7.8カ月と上記2つの第Ⅲ相試験のドセタキセル75mg/m2と同等の効果を有する結果を報告した18)。
これらの結果よりプラチナ製剤を含む併用化学療法を使用した患者にはドセタキセル単剤の投与を行うよう勧められる。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- c.2004年に再発非小細胞肺癌の2次治療におけるペメトレキセド500mg/m2(3週毎)とドセタキセル75mg/m2(3週毎)のランダム化比較第Ⅲ相試験が報告された。治療効果は,RR,MSTがPME群で9.1%,8.3カ月,ドセタキセル単剤群で8.8%,7.9カ月であり主要評価項目であるMSTにて同等の効果が報告された。毒性に関しては,Grade 3/4好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がドセタキセル単剤群に有意に高かった19)。
同試験を組織学的にレトロスペクティブに解析した結果,OSは,非扁平上皮癌でそれぞれ9.3カ月と8.0カ月でありHRは0.78[95%CI:0.61-1.00;P=0.047]であるのに対し,扁平上皮癌でそれぞれ6.2カ月と7.4カ月でありHRは1.56[95%CI:1.08-2.26;P=0.018]であり扁平上皮癌で有意差をもってドセタキセル単剤群で良好であった。また,PFSにおいても,非扁平上皮癌でそれぞれ3.1カ月と3.0カ月でHRは0.82[95%CI:0.66-1.02;P=0.076]と有意差を認めないものの,扁平上皮癌でそれぞれ2.3カ月と2.7カ月でHRは1.40[95%CI:1.01-1.96;P=0.046]であり有意差をもってドセタキセル単剤群が良好であったと報告された20)。
一方本邦では,既治療非小細胞肺癌を対象にペメトレキセド500mg/m2(3週毎)と1,000mg/m2(3週毎)のランダム化比較第Ⅱ相試験が行われ,用量による有意な効果と毒性の差を認めなかった21)。さらに,既治療非小細胞肺癌を対象にペメトレキセド500mg/m2(3週毎)と900mg/m2(3週毎)のランダム化比較第Ⅲ相試験が行われ,RR,MST,PFSは,500mg/m2群で7.1%,6.7カ月,2.6カ月,900mg/m2群で4.3%,6.9カ月,2.8カ月と統計学的に有意差を認めず,Grade3/4の毒性は両群とも5%未満で900mg/m2群にて毒性の頻度が高い傾向にあったと報告された22)。
これらの結果より,再発非小細胞肺癌(非扁平上皮癌)患者にペメトレキセド単剤の投与を行うよう勧められる。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- d.PS0-3の2次治療以降の再発非小細胞肺癌患者731人をエルロチニブ単剤群とプラセボ群に2:1に割り付けたランダム化第Ⅲ相比較試験BR.21試験では,RRがそれぞれ8.9%と1%(P<0.001),PFSがそれぞれ2.2カ月と1.8カ月(P<0.001),主要評価項目であるOSが6.7カ月と4.7カ月(P<0.001)でいずれもエルロチニブ単剤群が有意に優れていた。また,臨床因子のサブグループ解析で非喫煙者の延命効果が際立っていたが,男性・扁平上皮癌・喫煙者を含むすべてのサブグループでほぼ一定の延命効果が得られた8)。
PS0-3の2次治療以降の再発非小細胞肺癌患者60人の日本人を対象とした第Ⅱ相試験では,RRが28.3%,病勢コントロール率が50.0%,PFSが77日,MSTが14.72カ月と報告された。Logistic regression analysisを用いたRRの多変量解析では,非喫煙者と喫煙者で(OR:0.06[95%CI:0.02-0.28:P<0.001])有意差をもって非喫煙者にRRが良好であった。また,Cox proportional hazards regression analysisを用いたOSの多変量解析では非喫煙者と喫煙者(HR:2.20[95%CI:1.06-4.56:P=0.035])とPS(0か1以上)(HR:2.59[95%CI:1.25-5.37:P=0.011])で非喫煙者とPS0で有意差をもってOSが良好であると報告された9)。
また,プラチナ製剤治療歴のあるEGFR遺伝子変異野生型症例を対象とし,2次治療としてドセタキセルとエルロチニブを比較する第Ⅲ相試験が報告され,OSはドセタキセル群が8.2カ月に対して,エルロチニブ群が5.4カ月(HR:0.73, 95%CI:0.53-1.00;P=0.05)とドセタキセル群が有意に良好であった23)。また,主評価項目をPFSとして日本国内においてプラチナ製剤治療歴のあるEGFR遺伝子変異野生型症例を対象とし,2次治療としドセタキセルとエルロチニブを比較する第Ⅲ相試験が報告され(DELTA試験)が報告され,サブセット解析ではあるがエルロチニブ群のPFSが1.3カ月に対してドセタキセル群で2.9カ月(HR 1.452,95%CI:1.090-1.939,P=0.01)とドセタキセル群が良好であった24)。この結果より,EGFR遺伝子変異野生型の2次治療において少なくともドセタキセルの前にエルロチニブを使用する科学的根拠は乏しい。
一方で,EGFR-TKIであるゲフィチニブ による間質性肺障害(ILD)のリスクが報告され,そのリスクファクターおよび発症後の予後不良因子について検討され報告されている6)7)。
これらの結果よりEGFR遺伝子変異陰性もしくは不明のPS0-2の2次治療にエルロチニブ単剤の投与を行うことは妥当である。しかし,ILDの発症リスクや予後を含め慎重に症例を選択する必要がある。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- e.ドセタキセル単剤をコントロール群としたランダム化比較試験は4本報告されている。Wachtersらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,16%と10%,7.3カ月と6.2カ月(P=0.49),18週と15週(P=0.42)で有意差を認めず,併用療法で有効性の改善を認めなかった25)。Pectasidesらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,TTPにおいて,4.8カ月と5.6カ月(P=0.065)で併用群に有意差をもって良好であるものの,RR,MSTはそれぞれ,14%と20%(P=0.36),6.4カ月と6.5カ月(P=0.49)で有意差を認めず,Grade3/4の血小板減少,Grade3/4の下痢はそれぞれ,6%と17%(P=0.04),2%と12%(P=0.05)で有意差をもって併用群に多かった26)。Segawaらのドセタキセル単剤とドセタキセル+TS-1併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,20.7%と16.1%(P=0.81),22.9カ月と8.7カ月,3.7カ月と3.4カ月(P=0.27)で有意差を認めず,併用療法で有効性の改善を認めなかった27)。本邦におけるTakedaらのドセタキセル単剤とドセタキセル+ゲムシタビン併用のランダム化第Ⅲ相試験では,ILDの発症が単剤群では3.1%であったのに対し,併用群では20.0%と高頻度に発症し,4.6%がILDにより死亡したため早期に試験が終了となった28)。
Smitらのペメトレキセド単剤とペメトレキセド+カルボプラチン併用のランダム化比較第Ⅱ相試験では,RR,OSはそれぞれ6%と17%,7.6カ月と8カ月で有意差を認めないものの,主要評価項目であるPFSは,2.8カ月と4.2カ月(P=0.05)で併用群に有意差をもって良好であった。安全性に関しては,Grade3/4血小板減少と好中球減少が有意差をもって併用群に多いと報告されたが,毒性は認容可能と考えられた29)。
また,2次治療の併用療法のメタアナリシスは1本報告されてる。Di Maioらのメタアナリシスでは日本で未承認の薬剤も含まれるも,OSは単剤と併用でそれぞれ34.7週と37.3週(P=0.32)で有意差を認めず,PFSは11.7週と14.0週(P=0.0009)で併用療法に有意差をもって良好であった。有害事象は,Grade3/4の血液毒性がそれぞれ25%と41%(P=<0.001)でGrade3/4の非血液毒性が22%と28%(P=0.034)で有意差をもって併用療法に増加していた。つまり,併用療法は有意にRRとPFSを伸ばすがOSの改善がなく,毒性を有意に増すとの結果になった30)。
これらの結果より,2剤併用療法は有効性の証明がなく臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。
1次治療クリゾチニブ使用例の2次治療:PS 0-1
- 推 奨
- 進行期非小細胞肺癌の初回治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
現時点で報告されている耐性機序は化学療法と異なり,交差耐性の報告もないため,ファーストラインの治療成績を考慮する。
1次治療クリゾチニブ使用例の2次治療:PS 2
- 推 奨
- 進行期非小細胞肺癌の初回治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
現時点で報告されている耐性機序は化学療法と異なり,交差耐性の報告もないため,ファーストラインの治療成績を考慮する。
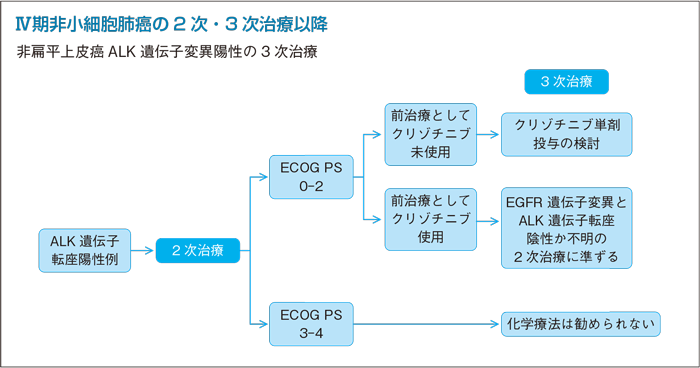
前治療クリゾチニブ未使用例の3次治療:PS 0-2
- 推 奨
- クリゾチニブ単剤の投与を行うよう勧められる。(グレードA)
ALK遺伝子転座陽性に対するクリゾチニブはPS 0-2が大部分を占める第Ⅰ/Ⅱ相試験にてORR 61%,PFS 10カ月と良好な結果を示した21)22)。またレトロスペクティブ解析の結果から,ALK遺伝子転座陽性例ではクリゾチニブ投与の有無によってOSが大きく異なることが示唆されている23)。プラチナ製剤治療歴のあるALK遺伝子転座陽性例347例を対象として2次治療移行としてクリゾチニブと標準化学療法(ペメトレキセドまたはドセタキセル)を比較する第Ⅲ相が報告され,主評価項目であるPFSはクリゾチニブ群が7.7カ月,標準化学療法群が3.0カ月(HR 0.49,95%CI:0.37-0.64,P<0.001)とクリゾチニブ群で有意に良好であった24)。
前治療クリゾチニブ使用例の3次治療:PS 0-2
- 推 奨
- 非扁平上皮癌EGFR遺伝子変異とALK遺伝子転座陰性もしくは不明の2次治療を行うよう勧められる。(グレードB)
EGFR遺伝子変異とALK遺伝子転座陰性もしくは不明の非小細胞肺癌の標準的2次治療化学療法とクリゾチニブは,交差耐性がないと考えられているため, EGFR 遺伝子変異とALK遺伝子転座陰性もしくは不明の非小細胞肺癌の標準的2次治療化学療法の治療成績を考慮する。
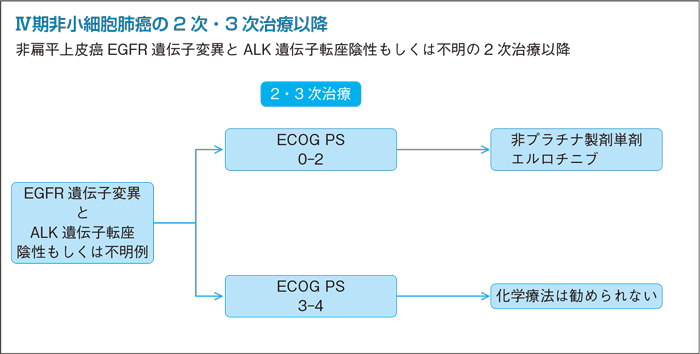
もしくは不明の2次治療以降:PS 0-2
- 推 奨
- a.ドセタキセル単剤の投与を行うよう勧められる。(グレードA)
- b.ペメトレキセド単剤の投与を行うよう勧められる。(グレードA)
- c.エルロチニブ単剤の投与を行うことを考慮してもよい。(グレードC1)
- d.2剤併用療法は有効性の証明が無く臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。(グレードC2)
- a.プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたドセタキセル単剤の第Ⅲ相試験が2つ報告されている。1つはドセタキセル(100mg/m2 or 75mg/m2)vsビノレルビンorイホスファミドの比較試験でMSTでは有意差を認めないもドセタキセル75mg/m2群でコントロール群と比較してRR,26週PFS率,1年生存率の有意な改善を認めた16)。また,ドセタキセル(100mg/m2 or 75mg/m2)とBSCの比較ではMST,1年生存率は,ドセタキセル75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でドセタキセル群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた17)。いずれの試験においても,ドセタキセル75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはドセタキセル75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でRR18.2%,MST7.8カ月と上記2つの第Ⅲ相試験のドセタキセル75mg/m2と同等の効果を有する結果を報告した18)。
これらの結果よりプラチナ製剤を含む併用化学療法を使用した患者にはドセタキセル単剤の投与を行うよう勧められる。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- b.2004年に再発非小細胞肺癌の2次治療におけるペメトレキセド500mg/m2(3週毎)とドセタキセル75mg/m2(3週毎)のランダム化比較第Ⅲ相試験が報告された。治療効果は,RR,MSTがPME群で9.1%,8.3カ月,ドセタキセル単剤群で8.8%,7.9カ月であり主要評価項目であるMSTにて同等の効果が報告された。毒性に関しては,Grade3/4好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がドセタキセル単剤群に有意に高かった19)。
同試験を組織学的にレトロスペクティブに解析した結果,OSは,非扁平上皮癌でそれぞれ9.3カ月と8.0カ月でありHRは0.78[95%CI : 0.61-1.00, P=0.047]であるのに対し,扁平上皮癌でそれぞれ6.2カ月と7.4カ月でありHRは1.56[95%CI : 1.08-2.26, P=0.018]であり,扁平上皮癌で有意差をもってドセタキセル単剤群で良好であった。また,PFSにおいても,非扁平上皮癌でそれぞれ3.1カ月と3.0カ月でHRは0.82[95%CI : 0.66-1.02, P=0.076]と有意差を認めないものの,扁平上皮癌でそれぞれ2.3カ月と2.7カ月でHRは1.40[95%CI : 1.01-1.96, P=0.046]であり有意差をもってドセタキセル単剤群が良好であったと報告された20)。
一方本邦では,既治療非小細胞肺癌を対象にペメトレキセド500mg/m2(3週毎)と1,000mg/m2(3週毎)のランダム化比較第Ⅱ相試験が行われ,用量による有意な効果と毒性の差を認めなかった21)。さらに,既治療非小細胞肺癌を対象にペメトレキセド500mg/m2(3週毎)と900mg/m2(3週毎)のランダム化比較第Ⅲ相試験が行われ,RR,MST,PFSは,500mg/m2群で7.1%,6.7カ月,2.6カ月,900mg/m2群で4.3%,6.9カ月,2.8カ月と統計学的に有意差を認めず,Grade3/4の毒性は両群とも5%未満で900mg/m2群にて毒性の頻度が高い傾向にあったと報告された22)。
これらの結果より,再発非小細胞肺癌(非扁平上皮癌)患者にペメトレキセド単剤の投与を行うよう勧められる。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- c.PS 0-3の2次治療以降の再発非小細胞肺癌患者731人をエルロチニブ単剤群とプラセボ群に2:1に割り付けたランダム化第Ⅲ相比較試験BR.21試験では,RRがそれぞれ8.9%と1%(P<0.001),PFSがそれぞれ2.2カ月と1.8カ月(P<0.001),主要評価項目であるOSが6.7カ月と4.7カ月(P<0.001)でいずれもエルロチニブ単剤群が有意に優れていた。また,臨床因子のサブグループ解析で非喫煙者の延命効果が際立っていたが,男性・扁平上皮癌・喫煙者を含むすべてのサブグループでほぼ一定の延命効果が得られた8)。
PS0-3の2次治療以降の再発非小細胞肺癌患者60人の日本人を対象とした第Ⅱ相試験では,RRが28.3%,病勢コントロール率が50.0%,PFSが77日,MSTが14.72カ月と報告された。Logistic regression analysisを用いたRRの多変量解析では,非喫煙者と喫煙者で(OR:0.06[95%CI : 0.02-0.28, P<0.001])有意差をもって非喫煙者にRRが良好であった。また,Cox proportional hazards regression analysisを用いたOSの多変量解析では非喫煙者と喫煙者(HR:2.20[95%CI : 1.06-4.56, P=0.035])とPS(0か1以上)(HR:2.59[95%CI : 1.25-5.37, P=0.011])で非喫煙者とPS 0で有意差をもってOSが良好であると報告された9)。
また,プラチナ製剤治療歴のあるEGFR遺伝子変異野生型症例を対象とし,2次治療としてドセタキセルとエルロチニブを比較する第Ⅲ相試験が報告され,OSはドセタキセル群が8.2カ月に対して,エルロチニブ群が5.4カ月(HR:0.73, 95%CI : 0.53-1.00, P=0.05)とドセタキセル群が有意に良好であった23)。また,主評価項目をPFSとして日本国内においてプラチナ製剤治療歴のあるEGFR遺伝子変異野生型症例を対象とし,2次治療としドセタキセルとエルロチニブを比較する第Ⅲ相試験(DELTA試験)が報告され,サブセット解析ではあるがエルロチニブ群のPFSが1.3カ月に対してドセタキセル群で2.9カ月(HR 1.452, 95%CI : 1.090-1.939, P=0.01)とドセタキセル群が良好であった24)。この結果より,EGFR遺伝子変異野生型の2次治療において少なくともドセタキセルの前にエルロチニブを使用する科学的根拠は乏しい。
一方で,EGFR-TKIであるゲフィチニブ による間質性肺障害(ILD)のリスクが報告され,そのリスクファクターおよび発症後の予後不良因子について検討され報告されている6)7)。
これらの結果よりEGFR mutation陰性もしくは不明のPS 0-2の2次治療にエルロチニブ単剤の投与を行うことは妥当である。しかし,ILDの発症リスクや予後を含め慎重に症例を選択する必要がある。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- d.ドセタキセル単剤をコントロール群としたランダム化比較試験は3本報告されている。Wachtersらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,16%と10%,7.3カ月と6.2カ月(P=0.49),18週と15週(P=0.42)で有意差を認めず,併用療法で有効性の改善を認めなかった25)。Pectasidesらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,TTPにおいて,4.8カ月と5.6カ月(P=0.065)で併用群に有意差をもって良好であるものの,RR,MSTはそれぞれ,14%と20%(P=0.36),6.4カ月と6.5カ月(P=0.49)で有意差を認めず,Grade3/4の血小板減少,Grade3/4の下痢はそれぞれ,6%と17%(P=0.04),2%と12%(P=0.05)で有意差をもって併用群に多かった26)。Segawaらのドセタキセル単剤とドセタキセル+TS-1併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,20.7%と16.1%(P=0.81),22.9カ月と8.7カ月,3.7カ月と3.4カ月(P=0.27)で有意差を認めず,併用療法で有効性の改善を認めなかった27)。本邦におけるTakedaらのドセタキセル単剤とドセタキセル+ゲムシタビン併用のランダム化第Ⅲ相試験では,ILDの発症が単剤群では3.1%であったのに対し,併用群では20.0%と高頻度に発症し,4.6%がILDにより死亡したため早期に試験が終了となった28)。
Smitらのペメトレキセド単剤とペメトレキセド+カルボプラチン併用のランダム化比較第Ⅱ相試験では,RR,OSはそれぞれ6%と17%,7.6カ月と8カ月で有意差を認めないものの,主要評価項目であるPFSは,2.8カ月と4.2カ月(P=0.05)で併用群に有意差をもって良好であった。安全性に関しては,Grade3/4血小板減少と好中球減少が有意差をもって併用群に多いと報告されたが,毒性は認容可能と考えられた29)。
また,2次治療の併用療法のメタアナリシスは1本報告されている。Di Maioらのメタアナリシスでは日本で未承認の薬剤も含まれるも,OSは単剤と併用でそれぞれ34.7週と37.3週(P=0.32)で有意差を認めず,PFSは11.7週と14.0週(P=0.0009)で併用療法に有意差をもって良好であった。有害事象は,Grade3/4の血液毒性がそれぞれ25%と41%(P=<0.001)でGrade3/4の非血液毒性が22%と28%(P=0.034)で有意差をもって併用療法に増加していた。つまり,併用療法は有意にRRとPFSを伸ばすがOSの改善がなく,毒性を有意に増すとの結果になった30)。
これらの結果より,2剤併用療法は有効性の証明がなく臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。
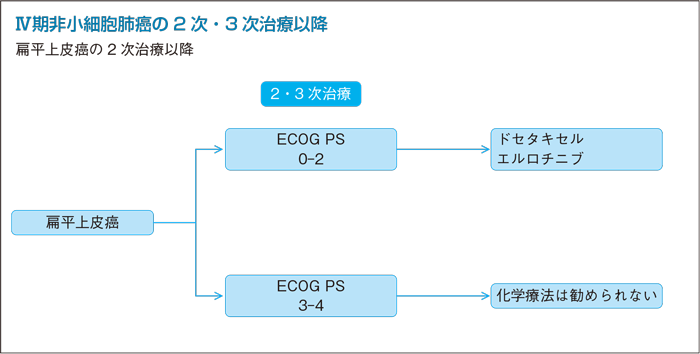
- 推 奨
- a.ドセタキセル単剤の投与を行うよう勧められる。(グレードA)
- b.エルロチニブ単剤の投与を行うことを考慮してもよい。(グレードC1)
- c.2剤併用療法は有効性の証明がなく臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。(グレードC2)
- a.プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたドセタキセル単剤の第Ⅲ相試験が2つ報告されている。1つはドセタキセル(100mg/m2 or 75mg/m2) vs ビノレルビン or イホスファミドの比較試験でMSTでは有意差を認めないもののドセタキセル75mg/m2群でコントロール群と比較してRR,26週PFS率,1年生存率の有意な改善を認めた16)。また,ドセタキセル(100mg/m2 or 75mg/m2)とBSCとの比較ではMST,1年生存率は,ドセタキセル75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でドセタキセル単剤群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた17)。いずれの試験においても,ドセタキセル75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはドセタキセル75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でRR18.2%,MST7.8カ月と上記2つの第Ⅲ相試験のドセタキセル75mg/m2と同等の効果を有する結果を報告した18)。
これらの結果よりプラチナ製剤を含む併用化学療法を使用した患者にはドセタキセル単剤の投与を行うよう勧められる。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- b.PS 0-3の2次治療以降の再発非小細胞肺癌患者731人をエルロチニブ単剤群とプラセボ群に2:1に割り付けたランダム化第Ⅲ相比較試験BR.21試験では,RRがそれぞれ8.9%と1%(P<0.001),PFSがそれぞれ2.2カ月と1.8カ月(P<0.001),主要評価項目であるOSが6.7カ月と4.7カ月(P<0.001)でいずれもエルロチニブ単剤群が有意に優れていた。また,臨床因子のサブグループ解析で非喫煙者の延命効果が際立っていたが,男性・扁平上皮癌・喫煙者を含むすべてのサブグループでほぼ一定の延命効果が得られた8)。
PS 0-3の2次治療以降の再発非小細胞肺癌患者60人の日本人を対象とした第Ⅱ相試験では,RRが28.3%,病勢コントロール率が50.0%,PFSが77日,MSTが14.72カ月と報告された。Logistic regression analysisを用いたRRの多変量解析では,非喫煙者と喫煙者で(OR:0.06[95%CI:0.02-0.28, P<0.001])有意差をもって非喫煙者にRRが良好であった。また,Cox proportional hazards regression analysisを用いたOSの多変量解析では非喫煙者と喫煙者(HR:2.20[95%CI : 1.06-4.56, P=0.035])とPS(0か1以上)(HR:2.59[95%CI : 1.25-5.37, P=0.011])で非喫煙者とPS 0で有意差をもってOSが良好であると報告された9)。
一方で,EGFR-TKIであるゲフィチニブによる間質性肺障害(ILD)のリスクが報告され,そのリスクファクターとして55歳以上,WHO PS不良(≧2),喫煙歴あり,非小細胞肺癌診断からの期間が短い(<6カ月),CT画像上の正常肺占有率が低い(<50%),既存の間質性肺炎,心血管系の合併症を有することが挙げられた。また,発症後の予後不良因子として55歳以上,喫煙歴あり,既存の間質性肺炎,CT画像上の正常肺占有率が低い(≦50%),胸膜癒着領域が広い(≧50%)ことが報告されている6)7)。
これらの結果より扁平上皮癌のPS 0-2の2次治療にエルロチニブ単剤の投与を行うことは妥当である。しかし,扁平上皮癌では上記リスクファクターを多く含むことが考えられ投与に関しては,ILDの発症リスクや予後を含め慎重に症例を選択する必要がある。
また,2次治療の臨床試験はプラチナ製剤使用症例が対象となっているため,プラチナ製剤未使用症例に対する2次治療での単剤療法のエビデンスは乏しい。
- c.ドセタキセル単剤をコントロール群としたランダム化比較試験は3本報告されている。Wachtersらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,16%と10%,7.3カ月と6.2カ月(P=0.49),18週と15週(P=0.42)で有意差を認めず,併用療法で有効性の改善を認めなかった25)。Pectasidesらのドセタキセル単剤とドセタキセル+イリノテカン併用のランダム化比較第Ⅱ相試験では,TTPにおいて,4.8カ月と5.6カ月(P=0.065)で併用群に有意差をもって良好であるものの,RR,MSTはそれぞれ,14%と20%(P=0.36),6.4カ月と6.5カ月(P=0.49)で有意差を認めず,Grade3/4の血小板減少,Grade3/4の下痢はそれぞれ,6%と17%(P=0.04),2%と12%(P=0.05)で有意差をもって併用群に多かった26)。Segawaらのドセタキセル単剤とドセタキセル+TS-1併用のランダム化比較第Ⅱ相試験では,RR,MST,PFSはそれぞれ,20.7%と16.1%(P=0.81),22.9カ月と8.7カ月,3.7カ月と3.4カ月(P=0.27)で有意差を認めず,併用療法で有効性の改善を認めなかった27)。本邦におけるTakedaらのドセタキセル単剤とドセタキセル+ゲムシタビン併用のランダム化第Ⅲ相試験では,ILDの発症が単剤群では3.1%であったのに対し,併用群では20.0%と高頻度に発症し,4.6%がILDにより死亡したため早期に試験が終了となった28)。
Smitらのペメトレキセド単剤とペメトレキセド+カルボプラチン併用のランダム化比較第Ⅱ相試験では,RR,OSはそれぞれ6%と17%,7.6カ月と8カ月で有意差を認めないものの,主要評価項目であるPFSは,2.8カ月と4.2カ月(P=0.05)で併用群に有意差をもって良好であった。安全性に関しては,Grade3/4血小板減少と好中球減少が有意差をもって併用群に多いと報告されたが,毒性は認容可能と考えられた29)。
また,2次治療の併用療法のメタアナリシスは1本報告されている。Di Maioらのメタアナリシスでは日本で未承認の薬剤も含まれるも,OSは単剤と併用でそれぞれ34.7週と37.3週(P=0.32)で有意差を認めず,PFSは11.7週と14.0週(P=0.0009)で併用療法に有意差をもって良好であった。有害事象は,Grade3/4の血液毒性がそれぞれ25%と41%(P=<0.001)でGrade3/4の非血液毒性が22%と28%(P=0.034)で有意差をもって併用療法に増加していた。つまり,併用療法は有意にRRとPFSを伸ばすがOSの改善がなく,毒性を有意に増すとの結果になった30)。
これらの結果より,2剤併用療法は有効性の証明がなく臨床試験以外では行うよう勧めるだけの科学的根拠が明確でない。
- 1)Thatcher N, Chang A, Parikh P, et al. Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). Lancet. 2005; 366(9496): 1527-37. (II)
- 2)Maruyama R, Nishiwaki Y, Tamura T, et al. Phase III study, V-15-32, of gefitinib versus docetaxel in previously treated Japanese patients with non-small-cell lung cancer. J Clin Oncol. 2008; 26(26): 4244-52. (II)
- 3)Kim ES, Hirsh V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet. 2008; 372(9652): 1809-18. (II)
- 4)Costa DB, Kobayashi S, Tenen DG, et al. Pooled analysis of the prospective trials of gefitinib monotherapy for EGFR-mutant non-small cell lung cancers. Lung Cancer. 2007; 58(1): 95-103. (III)
- 5)Morita S, Okamoto I, Kobayashi K, et al. Combined survival analysis of prospective clinical trials of gefitinib for non-small cell lung cancer with EGFR mutations. Clin Cancer Res. 2009; 15(13): 4493-8. (I)
- 6)Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer: a cohort and nested case-control study. Am J Respir Crit Care Med. 2008; 177(12): 1348-57. (IV)
- 7)Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006; 24(16): 2549-56.(IV)
- 8)Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med. 2005; 353(2): 123-32. (II)
- 9)Kubota K, Nishiwaki Y, Tamura T, et al. Efficacy and safety of erlotinib monotherapy for Japanese patients with advanced non-small cell lung cancer: a phase II study. J Thorac Oncol. 2008; 3(12): 1439-45. (III)
- 10)Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67. (IV)
- 11)Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400. (III)
- 12)Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med. 2010; 363(18): 1693-703. (III)
- 13)Camidge DR, Bang YJ, Kwak EL, et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancet Oncol. 2012; 13(10): 1011-9. (III)
- 14)Shaw AT, Yeap BY, Solomon BJ, et al. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol. 2011; 12(11): 1004-12. (IV)
- 15)Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013; 368(25): 2385-94. (II)
- 16)Fossella FV, DeVore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol. 2000; 18(12): 2354-62. (II)
- 17)Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol. 2000; 18(10): 2095-103. (II)
- 18)Mukohara T, Takeda K, Miyazaki M, et al. Japanese experience with second-line chemotherapy with low-dose (60mg/M2) docetaxel in patients with advanced non-small-cell lung cancer. Cancer Chemother Pharmacol. 2001; 48(5): 356-60. (IV)
- 19)Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol. 2004; 22(9): 1589-97. (II)
- 20)Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase III studies. Oncologist. 2009; 14(3): 253-63. (II)
- 21)Ohe Y, Ichinose Y, Nakagawa K, et al. Efficacy and safety of two doses of pemetrexed supplemented with folic acid and vitamin B12 in previously treated patients with non-small cell lung cancer. Clin Cancer Res. 2008; 14(13): 4206-12. (II)
- 22)Cullen MH, Zatloukal P, Sörenson S, et al. A randomized phase III trial comparing standard and high-dose pemetrexed as second-line treatment in patients with locally advanced or metastatic non-small-cell lung cancer. Ann Oncol. 2008; 19(5): 939-45. (IV)
- 23)Garassino MC. TAILOR: A phase III trial comparing erlotinib with docetaxel as the second-line treatment of NSCLC patients with wild-type (wt) EGFR. 2012 ASCO Annual Meeting Abstract(LBA7501). (II)
- 24)Okano Y. Randomized phase III trial of erlotinib(E) versus docetaxel(D) as second- or third-line therapy in patients with advanced non-small cell lung cancer (NSCLC) who have wild-type or mutant epidermal growth factor receptor (EGFR): Docetaxel and Erlotinib Lung Cancer Trial (DELTA). 2013 ASCO Annual Meeting Oral Abstract Session (#8006). (II)
- 25)Wachters FM, Groen HJ, Biesma B, et al. A randomised phase II trial of docetaxel vs docetaxel and irinotecan in patients with stage IIIb-IV non-small-cell lung cancer who failed first-line treatment. Br J Cancer. 2005 Jan 17;92(1):15-20. (II)
- 26)Pectasides D, Pectasides M, Farmakis D, et al. Comparison of docetaxel and docetaxel-irinotecan combination as second-line chemotherapy in advanced non-small-cell lung cancer: a randomized phase II trial. Ann Oncol. 2005; 16(2): 294-9. (II)
- 27)Segawa Y, Kiura K, Hotta K, et al. A randomized phase II study of a combination of docetaxel and S-1 versus docetaxel monotherapy in patients with non-small cell lung cancer previously treated with platinum-based chemotherapy: results of Okayama Lung Cancer Study Group (OLCSG) Trial 0503. J Thorac Oncol. 2010; 5(9): 1430-4. (II)
- 28)Takeda K, Negoro S, Tamura T, et al. Phase III trial of docetaxel plus gemcitabine versus docetaxel in second-line treatment for non-small-cell lung cancer: results of a Japan Clinical Oncology Group trial (JCOG0104). Ann Oncol. 2009; 20(5):835-41. (II)
- 29)Smit EF, Burgers SA, Biesma B, et al. Randomized phase II and pharmacogenetic study of pemetrexed compared with pemetrexed plus carboplatin in pretreated patients with advanced non-small-cell lung cancer. J Clin Oncol. 2009; 27(12): 2038-45. (II)
- 30)Di Maio M, Chiodini P, Georgoulias V, et al. Meta-analysis of single-agent chemotherapy compared with combination chemotherapy as second-line treatment of advanced non-small-cell lung cancer. J Clin Oncol. 2009; 27(11): 1836-43. (I)
| ドセタキセル | 60mg/m2, on day1 | q3w |
| ペメトレキセド | 500mg/m2, on day1 | q3w |
| ペメトレキセドの投与に際しては下記ビタミンの補充を行う ①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,本剤の投与を中止又は終了する場合には,本剤最終投与日から22日目まで可能な限り葉酸を投与する。 ②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,本剤投与期間中及び投与中止後22日目まで9週ごと(3コースごと)に1回投与する。 |
||
| ゲフィチニブ(250mg)1錠 | 1日1回 | 経口投与 |
| エルロチニブ(150mg)1錠 | 1日1回 | 経口投与 |
| クリゾチニブ(250mg)1回1cap | 1日2回 | 経口投与 |