Ⅳ.転移など各病態に対する治療
1
骨転移
文献検索と採択
- 文献検索期間
-
- 2009年9月1日から2021年11月30日
- 文献検索方法
-
- キーワード:bone neoplasms, secondary
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2022年版改訂は,下記の検索式で2021年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式(検索日:2021年12月27日)
-
#1 "Lung Neoplasms/therapy"[Mesh] #2 "Bone Neoplasms/secondary"[Mesh] #3 #1 AND #2 #4 (((Lung[TI] OR Pulmonary[TI]) AND (Cancer*[TI] OR Carcinoma*[TI] OR Adenocarcinoma*[TI] OR neoplasm*[TI] OR tumo*[TI])) OR "squamous cell carcinoma*"[TI]) AND (Bone[TI] OR Bones[TI] OR Skull*[TI] OR Skelet*[TI]) AND (metasta*[TIAB] OR secondar*[TIAB]) #5 #3 OR #4 #6 #5 AND 2020/12:2021/11[DP] #7 #6 AND (JAPANESE[LA] OR ENGLISH[LA])
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で日本における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
本文中に用いた略語および用語の解説
| BP製剤 | ビスフォスフォネート製剤 | |
|---|---|---|
| CR | complete remission | 完全寛解 |
| HR | hazard ratio | ハザード比 |
| MSTS | Musculoskeletal Tumor Society | 骨・軟部腫瘍学会(スコア) |
| PR | partial response | 部分奏効 |
| PS | performance status | 全身状態 |
| QOL | quality of life | 生活の質 |
| SBRT | stereotactic body radiation therapy | 体幹部定位放射線治療 |
| SF-36 | Short Form-36 | 健康関連QOL測定尺度の1つ |
| SRE | skeletal related event | 骨関連事象 |
| TESS | Toronto Extremity Salvage Score | トロント四肢サルベージスコア |
樹形図
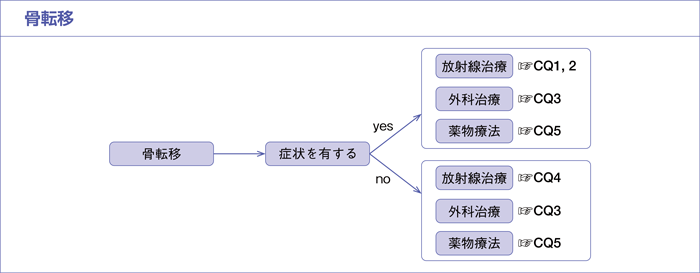
CQ1.
症状を有する骨転移に対して,放射線治療が勧められるか?
- 推 奨
- 放射線治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
肺癌の骨転移は約30~50%に生じるとされる。本邦における230例の非小細胞肺癌での後方視的な解析1)では,30.4%に骨転移が認められている。そのうちの65.7%は初回ステージング時で認められ,50%は骨関連事象(SRE)をその経過で認めた。また,非小細胞肺癌(197人)と小細胞肺癌(77例)を含む計274例の多施設共同前方視的研究2)では,登録時にⅣ期非小細胞肺癌で47.6%,進展型小細胞肺癌で40.4%に骨転移を認め,各々16%,8.5%,経過中には全体の9.5%にSREを認めた。一方,小細胞肺癌92例を対象とした海外からの後方視的解析3)によると,経過中,63%に骨転移を認め,SREはその35%に認められた。
未治療の骨転移合併肺癌では,可能なら全身治療としての薬物療法を導入すべきであるが,症状を有する,または病的骨折の危険性が高い,または脊椎転移が脊髄圧迫を生じている場合は放射線治療が優先されることがある。
16のランダム化比較試験のメタアナリシス4)によると,放射線治療による痛みの改善は50~80%と高率に得られ,有害事象の頻度も少なかった(病的骨折2.8~3.2%,脊髄圧迫1.9~2.8%)。
以上より,放射線治療によって高い局所制御率と臨床的有効性がメタアナリシスにて確認されている。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
CQ2.
症状を有する骨転移に対する適切な照射法は何か?
- 推 奨
-
- a.
- 分割照射を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- 単回照射を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:97%〕
従来,骨転移に対する放射線治療としては総線量20~30Gyの分割照射が行われてきた。8Gy単回照射については,総線量20~30Gyの分割照射との比較を行った前向き試験がいくつかあり,これら16のランダム化比較試験に関するメタアナリシスが報告されている4)。これによると痛みの改善は単回照射群58% vs分割照射群59%と同等であった(HR 0.99,95%CI:0.95-1.03)。有害事象も病的骨折3.2% vs 2.8%(P=0.75),脊髄圧迫2.8% vs 1.9%(P=0.13)と有意差を認めなかったが,再照射率は20% vs 8%と単回照射群で有意に高かった(HR 2.5,95%CI:1.76-3.56)。このメタアナリシスに含まれる試験で照射後の長期フォローアップを行った研究5)でも,有害事象は両群で有意差を認めず,再照射率は単回照射群で有意に高かった(27% vs 9%,P=0.002)。
以上より,骨転移に対する標準的な照射方法としては,20Gy/5回,30Gy/10回などの分割照射が勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。一方,期待生存期間3カ月以内,連日の治療が困難,原腫瘍が増悪しているなど,症例によっては8Gy単回照射が選択肢と考えられる。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
なお,体幹部定位放射線治療(SBRT)の報告も増加している。SBRT(12または16Gy単回)と通常分割照射(30Gy/10回)を比較した単施設ランダム化第Ⅱ相試験6),SBRT(24Gy/2回)と通常分割照射(20Gy/5回)を比較した多施設ランダム化第Ⅱ/Ⅲ相試験7)では,疼痛緩和効果がSBRTで有意に高く,有害事象発生割合に有意差はなかった。本邦においても,SBRT(35Gy/5回)の2施設第Ⅱ相試験が報告されており8),全疼痛緩和率(CR+PR)が75%と良好な結果を示している。一方,SBRT(16または18Gy単回)と通常分割照射(8Gy単回)の疼痛緩和効果に有意差が認められなかった報告も複数存在するが9)10)検出力不足や論文化されていないという問題点を有している。SBRTを用いた高線量照射に対するこれらの試験は疼痛緩和効果を主要評価項目としたものであるが,長期的な局所制御や有害事象についても,今後の検討課題と考えられる。
※本邦では2020年4月から転移性脊椎腫瘍(直径5cm以下)と5個以内のオリゴ転移に対するSBRTが保険適用となった。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|
|---|---|---|---|---|---|
| a | 100% (35/35) |
0% | 0% | 0% | 0% |
| b | 3% (1/35) |
97% (34/35) |
0% | 0% | 0% |
CQ3.
病的骨折の危険性の高い骨転移,または脊椎転移が脊髄圧迫を生じている骨転移に対して,外科治療が勧められるか?
- 推 奨
- 外科治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:100%〕
病変が2.5cm以上,もしくは荷重骨で皮質の50%以上に破壊がみられる場合は病的骨折のリスクが高いとされている。病的骨折の危険性の高い骨転移に対し外科治療の意義や術式に関するランダム化比較試験はない。切迫骨折または病的骨折の状態にある四肢長管骨を対象とした前向き観察研究11)では,術後6週と3カ月の両評価点において重篤な合併症なく,疼痛や機能面(MSTS1987, MSTS1993, TESS)での有意な改善が認められた。しかし,健康関連QOL(SF-36)においては有意な改善が得られなかった。多くの後方視的報告においても,疼痛や機能の維持・改善は示されているものの,QOLに関しては予後や全身状態による影響も大きく,明らかな益は示されていない12)。
脊髄圧迫を呈する転移性骨腫瘍に対して除圧術+放射線治療と放射線治療単独のランダム化比較試験において13),治療後の歩行可能者割合は84% vs 57%(オッズ比6.2,95%CI:2.0-19.8,P=0.001)と手術群で良好で,歩行を維持できた期間も前者で長かった(122日間vs 13日間,P=0.003)ことから,試験は早期中止となった。しかし,この試験は100例の集積に10年を要するなど,患者選択にバイアスがかかっている可能性や放射線治療単独群における歩行維持期間が短すぎることなど,いくつかの問題が指摘されている。そこで,この試験の患者と予後因子を合わせたペアマッチ解析が検討されたが14),治療後の歩行可能者割合は69% vs 68%と有意差を認めず,単変量解析でも治療内容は予後に影響しなかった。
以上より,病的骨折のリスクが高い骨転移では,外科治療を行うことで術後早期より疼痛緩和や機能面での改善が期待できる。しかし,その適応や術式には病勢や予後,全身状態など総合的な判断を要し,多職種からなる集学的な検討が望ましい。脊椎転移が脊髄圧迫を生じている骨転移に対する外科治療は少数の比較試験で有効性が示唆されているものの,相反する報告も存在している。エビデンスの強さはC,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (35/35) |
0% | 0% | 0% |
CQ4.
病的骨折の危険性が高い骨転移,または脊椎転移が脊髄圧迫を生じている骨転移に対して,放射線治療が勧められるか?
- 推 奨
- 放射線治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
従来,病変が2.5cm以上,もしくは荷重骨で皮質の50%以上に破壊がみられる場合は病的骨折のリスクが高いとされ,固定と放射線治療の適応がある15)。脊髄圧迫については,単群第Ⅱ相試験(解析対象209例のうち17%が肺癌)において,放射線治療後に82%で除痛が得られ,76%で歩行機能が回復または維持されていたこと,画像上圧迫を認めるものの症状が顕在化していない時期の放射線治療によって,全例にその後の歩行能力が保持されていたことが報告されている16)。小細胞肺癌の転移性脊髄圧迫についても放射線治療が施行された120例の後方視的解析17)において,60%で歩行機能が回復または維持されていた。また,分離手術後に体幹部定位放射線治療(SBRT)24Gy/2回を行った本邦の単施設第Ⅱ相試験では,12カ月局所増悪率は13%と低く,通常歩行が困難であった症例の72%で歩行機能が改善したと報告されている18)。CQ2と同様,SBRTの長期的な局所制御や有害事象については今後の検討課題と考えられる。
以上より,病的骨折の危険性が高い,または脊椎転移による脊髄圧迫が切迫していると判断される場合には,明らかな神経症状がなくても放射線治療を行うよう勧められる。単群試験やこれまでのコンセンサスによる部分が多いため,エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
CQ5.
骨転移を有する症例に対して,骨関連事象の抑制(発現率を軽減し,発現までの時期を延長させる)に骨修飾薬(ゾレドロン酸またはデノスマブ)は勧められるか?
- 推 奨
- 骨修飾薬(ゾレドロン酸またはデノスマブ)による治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
乳癌および前立腺癌以外の肺癌を中心とした固形癌の骨転移患者(非小細胞肺癌50%,小細胞肺癌8%)を対象に,ビスフォスフォネート(BP)製剤であるゾレドロン酸とプラセボを,骨関連事象(SRE)の発症率および発症までの期間で比較した第Ⅲ相試験が行われた19)。21カ月までのSRE発現割合は,ゾレドロン酸4mg投与群が38.9%,プラセボ投与群が48.0%とゾレドロン酸投与群が有意に低く,発症時期を2カ月以上延長させた(236日vs 155日)。疼痛スコアや鎮痛剤の使用およびPSの変化に関しても,有意ではないものの改善傾向であった。
乳癌,前立腺癌を除く,進行癌(非小細胞肺癌40%)と多発性骨髄腫患者を対象に,デノスマブとゾレドロン酸を,SRE発症までの期間で比較した第Ⅲ相試験が行われた。初回SRE発症までの期間は,デノスマブ群20.6カ月,ゾレドロン酸群16.3カ月で,非劣性が証明されたが,優越性は証明されなかった。一方で,疼痛スコアの増悪や骨病変に対する放射線治療のリスクは,デノスマブ群が有意に少なかった20)21)。
以上より,骨転移を有する症例では,SREの発現率の軽減とSRE発現までの期間を延長させることが複数の研究で示されているため,ゾレドロン酸またはデノスマブの投与は勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
BP製剤とデノスマブの重要な有害事象に顎骨壊死が報告されている。顎骨壊死のリスク因子は,直近の歯科的処置やBP製剤の36カ月以上の長期投与が挙げられている22)。また,肺癌を含むゾレドロン酸投与症例3,491例を対象とした前向き観察研究において,3年間の顎骨壊死累積発生率は2.8%であり,肺癌は乳癌と比較してリスクが高い傾向があった23)。そのため,日常診療におけるBP製剤の長期使用では,顎骨壊死は十分に注意すべき有害事象である。デノスマブとゾレドロン酸の比較試験の統合解析では,両薬剤で,顎骨壊死の頻度に有意差を認めず24),デノスマブもBP製剤と同様な対応が必要である(参考資料:http://jsbmr.umin.jp/guide/pdf/bronjpositionpaper2012.pdf)。
BP製剤の腎機能障害は,BP製剤を使用した症例の4%に報告されている25)。一方,デノスマブは,海外第Ⅲ相試験20)において,クレアチニンクリアランス値が30mL/min未満の重度腎疾患患者および透析の必要な末期腎不全患者は対象から除外されており,慎重投与となっている。
デノスマブで注意すべき有害事象は,低カルシウム(Ca)血症である。低Ca血症の頻度がBP製剤と比較して有意に多いという報告(ゾレドロン酸投与群5.8%,デノスマブ投与群10.8%)があり,予防のためにCa製剤,ビタミンD製剤の内服,定期的な血清Caの測定が推奨されている20)。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (42/42) |
0% | 0% | 0% | 0% |
- 1)
- Tsuya A, Kurata T, Tamura K, et al. Skeletal metastases in non-small cell lung cancer:a retrospective study. Lung Cancer. 2007;57(2):229-32.
- 2)
- Katakami N, Kunikane H, Takeda K, et al. Prospective study on the incidence of bone metastasis(BM)and skeletal-related events(SREs)in patients(pts)with stage IIIB and IV lung cancer-CSP-HOR 13. J Thorac Oncol. 2014;9(2):231-8.
- 3)
- Conen K, Hagmann R, Hess V, et al. Incidence and predictors of bone metastases(BM)and skeletal-related events(SREs)in small cell lung cancer(SCLC):a Swiss patient cohort. J Cancer. 2016;7(14):2110-6.
- 4)
- Chow E, Harris K, Fan G, et al. Palliative radiotherapy trials for bone metastases:a systematic review. J Clin Oncol. 2007;25(11):1423-36.
- 5)
- Sande TA, Ruenes R, Lund JA, et al. Long-term follow-up of cancer patients receiving radiotherapy for bone metastases:results from a randomised multicentre trial. Radiother Oncol. 2009;91(2):261-6.
- 6)
- Nguyen QN, Chun SG, Chow E, et al. Single-fraction stereotactic vs conventional multifraction radiotherapy for pain relief in patients with predominantly nonspine bone metastases:a randomized phase 2 trial. JAMA Oncol. 2019;5(6):872-8.
- 7)
- Sahgal A, Myrehaug SD, Siva S, et al. Stereotactic body radiotherapy versus conventional external beam radiotherapy in patients with painful spinal metastases:an open-label, multicentre, randomised, controlled, phase 2/3 trial. Lancet Oncol. 2021;22(7):1023-33.
- 8)
- Ito K, Nakajima Y, Onoe T, et al. Phase 2 clinical trial of stereotactic body radiation therapy for painful nonspine bone metastases. Pract Radiat Oncol. 2021;11(2):e139-45.
- 9)
- Pielkenrood BJ, van der Velden JM, van der Linden YM, et al. Pain response after stereotactic body radiation therapy versus conventional radiation therapy in patients with bone metastases-a phase 2 randomized controlled trial within a prospective cohort. Int J Radiat Oncol Biol Phys. 2021;110(2):358-67.
- 10)
- Ryu S, Deshmukh S, Timmerman RD, et al. Radiosurgery compared to external beam radiotherapy for localized spine metastasis:phase III results of NRG Oncology/RTOG 0631. Int J Radiat Oncol Biol Phys. 2019;105(1), suppl:s2-3.
- 11)
- Talbot M, Turcotte RE, Isler M, et al. Function and health status in surgically treated bone metastases. Clin Orthop Relat Res. 2005;438:215-20.
- 12)
- Errani C, Mavrogenis AF, Cevolani L, et al. Treatment for long bone metastases based on a systematic literature review. Eur J Orthop Surg Traumatol. 2017;27(2):205-11.
- 13)
- Patchell RA, Tibbs PA, Regine WF, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer:a randomised trial. Lancet. 2005;366(9486):643-8.
- 14)
- Rades D, Huttenlocher S, Dunst J, et al. Matched pair analysis comparing surgery followed by radiotherapy and radiotherapy alone for metastatic spinal cord compression. J Clin Oncol. 2010;28(22):3597-604.
- 15)
- Harrington KD. New trends in the management of lower extremity metastases. Clin Orthop Relat Res. 1982;(169):53-61.
- 16)
- Maranzano E, Latini P. Effectiveness of radiation therapy without surgery in metastatic spinal cord compression:final results from a prospective trial. Int J Radiat Oncol Biol Phys. 1995;32(4):959-67.
- 17)
- Rades D, Motisi L, Veninga T, et al. Predictors of outcomes and a scoring system for estimating survival in patients treated with radiotherapy for metastatic spinal cord compression from small-cell lung cancer. Clin Lung Cancer. 2019;20(4):322-9.
- 18)
- Ito K, Sugita S, Nakajima Y, et al. Phase 2 clinical trial of separation surgery followed by stereotactic body radiation therapy for metastatic epidural spinal cord compression. Int J Radiat Oncol Biol Phys. 2022;112(1):106-13. Epub 2021 Oct 26.
- 19)
- Rosen LS, Gordon D, Tchekmedyian NS, et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors:a randomized, Phase III, double-blind, placebo-controlled trial. Cancer. 2004;100(12):2613-21.
- 20)
- Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer(excluding breast and prostate cancer)or multiple myeloma. J Clin Oncol. 2011;29(9):1125-32.
- 21)
- Vadhan-Raj S, von Moos R, Fallowfield LJ, et al. Clinical benefit in patients with metastatic bone disease:results of a phase 3 study of denosumab versus zoledronic acid. Ann Oncol. 2012;23(12):3045-51.
- 22)
- Migliorati CA, Siegel MA, Elting LS. Bisphosphonate-associated osteonecrosis:a long-term complication of bisphosphonate treatment. Lancet Oncol. 2006;7(6):508-14.
- 23)
- Van Poznak CH, Unger JM, Darke AK, et al. Association of osteonecrosis of the jaw with zoledronic acid treatment for bone metastases in patients with cancer. JAMA Oncol. 2021;7(2):246-54.
- 24)
- Saad F, Brown JE, Van Poznak C, et al. Incidence, risk factors, and outcomes of osteonecrosis of the jaw:integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases. Ann Oncol. 2012;23(5):1341-7.
- 25)
- Bonomi M, Nortilli R, Molino A, et al. Renal toxicity and osteonecrosis of the jaw in cancer patients treated with bisphosphonates:a long-term retrospective analysis. Med Oncol. 2010;27(2):224-9.
- レジメン
- 転移性骨腫瘍に対する治療
| 緩和的放射線治療 | 30Gy/10回(2週),20Gy/5回(1週),8Gy/1回(1日)など | ||
|---|---|---|---|
| 薬物療法 | ゾレドロン酸 | 4mg | 3~4週毎投与 |
| デノスマブ | 120mg | 4週毎投与 | |
| Ca製剤 | 500mg/日 | 連日投与 | |
| 天然型ビタミンD | 400IU/日 | 連日投与 | |
| (デノスマブ使用においては,高Ca血症を認めないかぎり,低Ca血症予防のためCa製剤とビタミンD製剤の補充を推奨) | |||