Ⅱ.非小細胞肺癌(NSCLC)
4
周術期
文献検索と採択
- 文献検索期間
-
- 2004年12月1日から2022年11月30日
- 文献検索方法
-
- キーワード:術前治療・術後補助療法(lung cancer, neoadjuvant/adjuvant therapy, non small cell lung cancer)
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2023年版改訂は,下記の検索式で2022年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式
- 術前治療・術後補助療法(検索日:2023年1月12日)
-
#1 S CARCINOMA, NON-SMALL-CELL LUNG+NT/CT(L)(TH OR DT)/CT AND PERIOPERATIVE CARE+NT/CT #2 S ((NONSMALL? OR NON(W)SMALL OR LARGE? OR SQUAMOUS?)(3A)(LUNG OR PULMONARY)(3A)(NEOPLASM? OR CARCINOM? OR CANCER? OR TUMOR? OR TUMOUR?)OR ADENOCARCINOM?(3A)(LUNG? OR PULMONARY) OR NSCLC)/TI,AB #3 S #2 AND (PERIOPERAT? OR POSTOPERAT? OR INTRAOPERAT? OR PREOPERAT? OR (PERI OR POST OR INTRA OR PRE)(W)OPERAT? OR RESECTED?)/TI,AB #4 S #1 OR #3 #5 S #4 AND ENGLISH/LA AND (2021-2023)/PY AND (20211201-20221130)/UP #6 S #5 AND (META-ANALYSIS/DT OR META-ANALYSIS AS TOPIC+NT/CT OR (METAANALYSIS OR META(W)ANALYSIS)/TI,AB) #7 S #5 AND (SYSTEMATIC REVIEW/DT OR SYSTEMATIC REVIEWS AS TOPIC+NT/CT OR SYSTEMATIC(W)REVIEW?/TI,AB) #8 S #5 AND (PRACTICE GUIDELINE/DT OR PRACTICE GUIDELINES AS TOPIC+NT/CT OR CONSENSUS+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCES AS TOPIC+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCE/DT OR (GUIDELINE? OR CONSENSUS?)/TI) #9 S #5 AND (RANDOMIZED CONTROLLED TRIAL?/DT OR PRAGMATIC CLINICAL TRIAL/DT OR EQUIVALENCE TRIAL/DT OR RANDOMIZED CONTROLLED TRIALS AS TOPIC+NT/CT OR RANDOM?/TI,AB ) #10 S #5 AND (CLINICAL TRIAL/DT OR CLINICAL STUDY/DT OR CLINICAL TRIALS AS TOPIC+NT/CT OR CLINICAL(W)(TRIAL? OR STUD?) OR CASE(W)(CONTROL? OR COMPARISON?)/TI,AB) #11 S #5 AND (EPIDEMIOLOGIC STUDIES+NT/CT OR EPIDEMIOLOGIC RESEARCH DESIGN+NT/CT OR COMPARATIVE STUDY/DT OR MULTICENTER STUDY/DT OR MULTICENTER STUDIES AS TOPIC+NT/CT OR (COHORT? OR COMPARATIVE? OR FOLLOWUP OR FOLLOW(W)UP OR MULTICENTER?)(3W)STUD?/TI,AB) #12 S (#6 OR #7 OR #8 OR #9 OR #10 OR #11) #13 S #12/HUMAN OR (#12 NOT ANIMALS/CT)
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で本邦における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | |
|---|---|---|
| CDDP | シスプラチン | |
| GEM | ゲムシタビン | |
| PTX | パクリタキセル | |
| UFT | テガフール・ウラシル配合剤 | |
| VDS | ビンデシン | |
| VNR | ビノレルビン | |
| CNS | central nervous system | 中枢神経系 |
| DFS | disease free survival | 無病生存期間 |
| EFS | Event free survival | 無イベント生存期間 |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| OR | odds ratio | オッズ比 |
| OS | overall survival | 全生存期間 |
| PD-L1 | programmed cell death ligand 1 | プログラム細胞死リガンド1 |
| RFS | relapse-free survival | 無再発生存期間 |
| TC | tumor cells | 腫瘍細胞 |
| ANITA | Adjuvant Navelbine International Trial Association | |
| IALT | International Adjuvant Lung Cancer Trial Collaborative Group | |
| JCOG | Japan Clinical Oncology Group | |
- 総 論
- 周術期における治療方針
外科切除可能なⅠ-Ⅲ期非小細胞肺癌に対しては,外科切除に加えて,術前あるいは術後に化学療法または放射線療法を追加することで,治療成績のさらなる改善を目指す試みが検討されてきた。化学療法に関しては,外科治療単独に対して術前補助化学療法,術後補助化学療法を追加する意義が,それぞれ臨床試験により検証された。一方,放射線療法に関しては外科切除後の術後放射線療法の意義が検証された。また,縦隔リンパ節転移を有する切除可能なⅢA期(N2)非小細胞肺癌に対しては,術前化学放射線療法後の外科切除の有用性を問う臨床試験が行われた。
これらの周術期の治療に関する推奨,治療方針決定に関しては,病期診断に関する評価が大きく関連している。術前治療に関する臨床試験は,主に画像診断による臨床病期(clinical stage)に基づいた集団を対象としており,一方,術後治療に関する臨床試験は,外科切除検体の病理学的評価による術後病理病期(pathological stage)に基づいた集団を対象として行われた結果であることを理解することが重要である。
1)TNM分類について
本ガイドラインにおける治療推奨は肺癌取扱い規約第8版に準じている。しかし,周術期領域の臨床試験に関しては試験が実施された時期における病期分類に基づいており,第7版以前の病期分類が採用されていることに留意されたい。
(1)TNM分類6版以前と8版の比較
テガフール・ウラシル配合剤療法,シスプラチン併用化学療法の術後補助化学療法に関する第Ⅲ相試験はTNM分類第6版以前の時代に行われている。現在の第8版との最も大きな違いとしては,腫瘍径によるT分類がT1(<3cm)とT2(≧3cm)に分かれるのみであったことである。つまり第8版におけるT3(5-7cm)やT4(≧7cm)は,TNM分類6版以前はいずれもT2に分類されていたことになる。テガフール・ウラシル配合剤療法の第Ⅲ相試験において実際に第8版におけるT3(5-7cm)N0M0は一定数含まれていたことも示されており1),CQ27,28のテガフール・ウラシル配合剤療法の対象にT3(5-7cm)N0M0,ⅡB期を注釈にて追加した。また,CQ29の術後補助化学療法としてのプラチナ製剤併用療法に関してもT3N2M0,ⅢB期やT4(≧7cm)N2M0,ⅢB期も注釈にて対象に追加した。
(2)TNM分類7版と8版の比較
術後補助化学療法としてのEGFRチロシンキナーゼ阻害薬や術前,術後補助化学療法としての免疫チェックポイント阻害薬の第Ⅲ相試験が複数行われており,それらの試験ではTNM分類第7版が用いられている。これらの試験では腫瘍径4cm以上のⅠB期からⅢA期が対象となっているが,第8版と照らし合わせて病期が変わるものとして,第7版におけるT2a(4-5cm)N0M0/ⅠB期(第8版ではT2bN0M0/ⅡA期),T3(3-5cm)N2M0/ⅢA期やT4(≧7cm)N2M0/ⅢA期(いずれも第8版ではⅢB期)が挙げられる。よってCQ25,30,31には一部のⅢB期を対象として注釈にて追加した。
以下に,術前および術後化学療法(CQ25,27~31),術前化学放射線療法(CQ26),術後放射線療法(CQ32,33)について解説する。
1980年代後半から2000年代を中心に,外科切除単独に対して,それぞれ術前補助化学療法あるいは術後補助化学療法を追加する意義を検証する臨床試験が行われた2)~4)。術後補助化学療法のエビデンスが術前補助化学療法よりも早く確立したことから,術前補助化学療法の第Ⅲ相試験が早期中止され,エビデンスの質・量ともに術後補助化学療法のものと比較すると十分ではない。
臨床病期Ⅰ-ⅡA期非小細胞肺癌で外科切除可能な患者には外科切除が勧められるため,臨床病期Ⅰ-ⅡA期に対して外科切除に先行する術前プラチナ製剤併用療法は行わないよう勧められる(CQ25)。近年,術前にプラチナ製剤併用療法に免疫チェックポイント阻害薬を併用した治療の有用性も報告されており,術前療法と術後療法の最適化に関して議論が活発化している。
術後補助化学療法については,術後病理病期Ⅰ期に対するテガフール・ウラシル配合剤療法(CQ27,28),術後病理病期Ⅱ-ⅢA期に対するシスプラチン併用療法(CQ29)が,それぞれ外科治療単独に対して生存の改善を示しエビデンスが確立されている3)4)。術後補助化学療法のこれらの薬剤選択に関して,術後病理病期の評価が重要であるが,特に肺癌取扱い規約第8版ⅡA期T2b(T分類>4-5cm)N0M0に関しては,旧7版ではⅠB期の分類に相当する。第8版ⅡA期はテガフール・ウラシル配合剤療法,シスプラチン併用化学療法の術後補助化学療法の有用性を検証する臨床試験に関して,いずれにも対象となったサブセットである。
シスプラチン併用療法後の地固め療法においては,EGFR遺伝子変異陽性例に対するEGFRチロシンキナーゼ阻害薬(CQ30),PD-L1陽性に対する免疫チェックポイント阻害薬(CQ31)が,ともに全生存期間(OS)の延長を示したことから勧められる。
3)術前化学放射線療法:CQ26
臨床病期ⅢA期(N2)については,外科切除を行う意義を問う臨床試験が行われた5)~7)。なかでも同時化学放射線療法を対照として同時化学放射線療法後に外科切除を追加する意義を問う臨床試験では全体の生存率に改善が認められなかったものの,無再発生存率では外科切除を加えた群で改善を認めた5)。また肺葉切除が行われた群においては外科切除を加える意義があると報告された。また術前化学療法と術前化学放射線療法を比較した臨床試験では明らかな差を認めなかった8)9)。切除可能な臨床病期ⅢA期(N2)に対しては,術前化学放射線療法を行うことを提案する(CQ26)。
外科切除後の術後放射線療法の意義については,メタアナリシスでの検証がなされている10)11)。術後病理病期Ⅰ-Ⅱ期に対する術後放射線療法はOSを増悪することが明確に示されており,行わないよう勧められる(CQ32)。一方,術後病理病期Ⅲ期(N2)に対する術後放射線療法については,有望な可能性はあるもののエビデンスが不十分であるため,大規模な臨床試験が国内外で行われてきた。そのうち,中国および欧州で行われた2つの比較試験の結果が最近報告されたが,術後放射線療法により局所領域再発は減少することが明らかとなったものの,DFSの改善を明確に示すことはできなかった12)13)。本邦の比較試験は現在進行中であり,その結果が待たれる14)。術後放射線療法を行う際には,その毒性も考慮する必要があることから,現時点では「推奨に至る根拠が明確ではない」と判断された(CQ33)。
- 1)
- Tsuboi M, Hamada C, Kato H, et al. The effect of tegafur-uracil on survival in T categories as defined in the eighth edition of the TNM Classification:an exploratory analysis of postoperative adjuvant tegafur-uracil on survival in patients with adenocarcinoma of the lung. Chemotherapy. 2017;62(6):357-60.
- 2)
- NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data. Lancet. 2014;383(9928):1561-71.
- 3)
- NSCLC Meta-analyses Collaborative Group;Arriagada R, Auperin A, et al. Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer:two meta-analyses of individual patient data. Lancet. 2010;375(9722):1267-77.
- 4)
- Hamada C, Tanaka F, Ohta M, et al. Meta-analysis of postoperative adjuvant chemotherapy with tegafur-uracil in non-small-cell lung cancer. J Clin Oncol. 2005;23(22):4999-5006.
- 5)
- Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer:a phase III randomised controlled trial. Lancet. 2009;374(9687):379-86.
- 6)
- Eberhardt WE, Pöttgen C, Gauler TC, et al. Phase III study of surgery versus definitive concurrent chemoradiotherapy boost in patients with resectable stage IIIA(N2)and selected IIIB non-small-cell lung cancer after induction chemotherapy and concurrent chemoradiotherapy(ESPATUE). J Clin Oncol. 2015;33(35):4194-201.
- 7)
- van Meerbeeck JP, Kramer GW, Van Schil PE, et al. Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst. 2007;99(6):442-50.
- 8)
- Katakami N, Tada H, Mitsudomi T, et al. A phase 3 study of induction treatment with concurrent chemoradiotherapy versus chemotherapy before surgery in patients with pathologically confirmed N2 stage IIIA nonsmall cell lung cancer(WJTOG9903). Cancer. 2012;118(24):6126-35.
- 9)
- Pless M, Stupp R, Ris HB, et al. Induction chemoradiation in stage IIIA/N2 non-small-cell lung cancer:a phase 3 randomised trial. Lancet. 2015;386(9998):1049-56.
- 10)
- PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2005;(2):CD002142.
- 11)
- Burdett S, Rydzewska L, Tierney J, et al. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2016;10(10):CD002142.
- 12)
- Hui Z, Men Y, Hu C, et al. Effect of postoperative radiotherapy for patients with pIIIA-N2 non-small cell lung cancer after complete resection and adjuvant chemotherapy:the phase 3 PORT-C randomized clinical trial. JAMA Oncol. 2021;7(8):1178-85.
- 13)
- Le Pechoux C, Pourel N, Barlesi F, et al. Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement(Lung ART):an open-label, randomised, phase 3 trial. Lancet Oncol. 2022;23(1):104-14.
- 14)
- Shimoyama R, Nakagawa K, Ishikura S, et al. A multi-institutional randomized phase III trial comparing postoperative radiotherapy to observation after adjuvant chemotherapy in patients with pathological N2 Stage III non-small cell lung cancer:Japan Clinical Oncology Group Study JCOG1916(J-PORT study). Jpn J Clin Oncol. 2021;51(6):999-1003.
- 4-1
- 術前治療
- 推 奨
-
- a.
- 臨床病期Ⅰ-ⅡA期(第8版)に対して,術前プラチナ製剤併用療法を行わないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:51%〕
-
- b.
- 臨床病期ⅡB-ⅢA期(第8版)に対して,術前プラチナ製剤併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:77%〕
-
- c.
- 臨床病期Ⅱ-ⅢA期(第8版)*,EGFR遺伝子変異/ALK融合遺伝子陰性もしくは不明例に対して,術前にプラチナ製剤併用療法とニボルマブを併用した治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:86%〕
術前補助化学療法は,術後補助化学療法の確立した結果が同時期に示されたことにより,術前補助化学療法を検証する複数の第Ⅲ相試験が早期中止となったことから,そのエビデンスは術後補助化学療法と比較して十分ではない。しかし後に行われたメタアナリシスによって,臨床病期Ⅰ-ⅢA期に対する術前補助化学療法は外科治療単独と比べてOSを延長することが示されている(HR 0.87,95%CI:0.78-0.96,P=0.007)1)。
術前補助化学療法は臨床病期に基づき治療が行われる。周術期治療を評価したランダム化比較試験のメタアナリシスでは,外科治療単独のコホートにおいて48%で臨床病期と病理病期の不一致が認められ,そのうち38%がN因子の不一致であった2)。周術期治療における臨床病期および病理病期(特にN因子)は治療方針決定において重要な要素であることから,両者が異なっている点に留意し治療計画を立てる必要がある(CQ7)。
-
a・b.前述した術前補助化学療法のメタアナリシス1)では,臨床病期によらずその有効性が示されている。一方で,第三世代細胞傷害性抗癌薬レジメン(BQ1)で有効性が示唆された2試験では,臨床病期によって効果が異なる可能性が示されている。臨床病期ⅠB-ⅢA期(第5版)の非小細胞肺癌を対象に術前のCDDP+GEM療法を評価した第Ⅲ相試験(ChEST試験)は,途中中止となったものの270例の患者がランダム化され,主要評価項目であるPFS(HR 0.70,95%CI:0.50-0.97,P=0.003)およびOS(HR 0.63,95%CI:0.43-0.92,P=0.02)で,手術のみの群に比べて有意な延長が認められた。同試験のサブグループ解析では,臨床病期ⅠB-ⅡA期(第5版,ⅡA期は3cm未満/N1症例)においてOS-HR 1.02(95%CI:0.58-1.19,P=0.94),臨床病期ⅡB-ⅢA期(第5版,N2症例は除外)においてOS-HR 0.42(95%CI:0.25-0.71,P<0.001)と,より進行した症例において効果が高まる傾向が認められた3)。臨床病期Ⅰ-ⅢA期(第5版,N2を除く)の非小細胞肺癌を対象に術前のCBDCA+PTX療法を評価した第Ⅲ相試験では,DFS-HR 0.92(95%CI:0.81-1.04,P=0.176)と術前補助化学療法におけるDFSの有意な延長は認められなかったが,サブグループ解析において,臨床病期Ⅰ期(第5版,2cm以上)のDFS-HR 0.96(95%CI:0.83-1.11)に対して,臨床病期Ⅱ期以上(第5版,主にN1症例)にはDFS-HR 0.81(95%CI:0.64-1.02)と,同様の傾向を示した4)。なお,害のアウトカムに関して,術前補助化学療法を評価した複数の臨床試験では,化学療法の施行に伴う一定の治療関連死亡(1%程度)および手術施行率の低下が報告されていることに注意が必要である。
術後補助化学療法のエビデンスが術前補助化学療法と比較し質・量ともに優っていることや,術前の臨床病期に曖昧さを認めることから,現在では術後病理病期に基づく術後補助化学療法が選択されることが多い。ガイドライン委員会では,益と害のバランスを考慮したうえで,早期の症例では過剰な治療につながる場合や手術療法の機会を逸する可能性もあることから,外科治療(および術後補助化学療法)を優先すべきとの意見が多かった。一方で,より進行した症例では術前補助化学療法の有効性が示唆されていることから,選択肢の1つとして考慮される。
以上より,臨床病期Ⅰ-ⅡA期(第8版)に対しては,術前プラチナ製剤併用療法を行わないよう提案する。エビデンスの強さはC,また総合的評価では行わないよう弱く推奨(2で推奨)すべきと判断した。一方,臨床病期ⅡB-ⅢA期(第8版)に対しては,切除可能性を鑑み,術前プラチナ製剤併用療法を行うよう提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。なお,臨床病期ⅢA期(N2)(第8版)については,外科切除後の術後病期診断に基づく術後補助化学療法のエビデンスが確立されていること,また術前化学放射線療法後の外科切除(CQ26)の選択肢があることを踏まえて,治療選択を検討する必要がある。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|
|---|---|---|---|---|---|
| a | 0% | 0% | 8% (4/53) |
51% (27/53) |
42% (22/53) |
| b | 4% (2/53) |
77% (41/53) |
13% (7/53) |
6% (3/53) |
0% |
-
c.既知のEGFR遺伝子変異*/ALK融合遺伝子を認めない切除可能な臨床病期ⅠB-ⅢA 期(第7版)を対象として,術前にプラチナ製剤併用療法にニボルマブ療法を追加する群と,プラチナ製剤併用療法のみを行う群を比較した第Ⅲ相試験(CheckMate816試験)において,主要評価項目であるEFSはニボルマブ併用群で有意な延長が認められた(HR 0.63,97.38%CI:0.43-0.91,P=0.005,中央値:31.6カ月vs 20.8カ月)(*EGFR遺伝子変異検査は,当初登録において必須ではなかったが,陰性確認が望ましいとされた)5)。臨床病期によるサブグループ解析では,ⅠB-Ⅱ期(第7版)でHR 0.87(95%CI:0.48-1.56)(ⅠB期は登録例の5%程度),ⅢA期(第7版)でHR 0.54(95%CI:0.37-0.80)であり,EFSのリスク軽減の程度が異なっていた。PD-L1発現によるサブグループ解析では,PD-L1発現別に1%未満,1~49%,50%以上で,それぞれHR 0.85(95%CI:0.54-1.32),HR 0.58(95%CI:0.30-1.12), HR 0.24(95%CI:0.10-0.61)で,PD-L1発現がより高いほうがEFSのリスク軽減が得られた。もう1つの主要評価項目である病理学的完全奏効割合は,ニボルマブ併用群で24.0%,化学療法群で2.2%であった(OR 13.94,99%CI:3.49-55.75,P<0.001)。OSは中間解析の段階で統計学的評価が不十分であるが,ニボルマブ併用群で延長する傾向が示されている(HR 0.57,99.67%CI:0.30-1.07)。手術へ移行できなかった割合はニボルマブ併用群で15.6%,化学療法群で20.7%であった。治療関連有害事象は両群で差は認められなかった(重篤な有害事象の頻度:11.9%vs 10.2%)。(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)
これらの結果に基づき,関連小委員会の討議が行われた。根拠となった上記試験において,サブグループ解析で臨床病期Ⅱ期とⅢA期(いずれも第7版)でEFS改善の程度に差があったこと,ニボルマブを追加する群においても15.6%で手術に至らなかったこと,などの懸念が指摘された。以上より,切除可能な臨床病期Ⅱ-ⅢA期(第8版)のEGFR遺伝子変異/ALK融合遺伝子陰性または不明例に対しては,術前プラチナ製剤併用療法とニボルマブ療法を併用した治療を行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 7% (4/56) |
86% (48/56) |
7% (4/56) |
0% (0/56) |
0% (0/56) |
CQ26.
切除可能な臨床病期ⅢA期(N2)に対して,術前化学放射線療法は勧められるか?
- 推 奨
- 切除可能な臨床病期ⅢA期(N2)に対して,術前化学放射線療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:68%〕
切除可能・病理学的に確認されたN2例に対し,化学放射線療法と術前化学放射線療法後の外科切除を比較した第Ⅲ相試験(INT0139試験)では,外科切除によるOSの延長は示されなかった6)。サブグループ解析では肺葉切除された症例で外科切除追加の有用性が示唆されているが,事後解析であるため,解釈には注意が必要である。北米,欧州でも術前化学放射線療法を介入群とした複数のランダム化比較試験が報告されているが,いずれの試験も早期中止などにより検出力が十分ではなく,生存に対するベネフィットが示されなかった7)8)。本邦でも同様の対象について,術前化学療法と術前化学放射線療法を比較する第Ⅲ相試験が行われたものの,同様に症例集積が進まなかったため有効性を十分に評価できなかった9)。
これらの結果より,肺葉切除可能かつ病理学的に確認されたN2の臨床病期ⅢA期に対して術前化学放射線療法の忍容性は示されている。また有効性に関するエビデンスの質が不十分であるものの,前述のように1つの第Ⅲ相試験で切除可能性と有用性が示されている。
以上より,肺葉切除可能な臨床病期ⅢA期(N2)に対しては,術前化学放射線療法を行うことを提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 68% (25/37) |
27% (10/37) |
5% (2/37) |
0% |
- 1)
- NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer:a systematic review and meta-analysis of individual participant data. Lancet. 2014;383(9928):1561-71.
- 2)
- Navani N, Fisher DJ, Tierney JF, et al. The accuracy of clinical staging of stage I-IIIa non-small cell lung cancer:an analysis based on individual participant data. Chest. 2019;155(3):502-9.
- 3)
- Scagliotti GV, Pastorino U, Vansteenkiste JF, et al. Randomized phase III study of surgery alone or surgery plus preoperative cisplatin and gemcitabine in stages IB to IIIA non-small-cell lung cancer. J Clin Oncol. 2012;30(2):172-8.
- 4)
- Felip E, Rosell R, Maestre JA, et al. Preoperative chemotherapy plus surgery versus surgery plus adjuvant chemotherapy versus surgery alone in early-stage non-small-cell lung cancer. J Clin Oncol. 2010;28(19):3138-45.
- 5)
- Forde PM, Spicer J, Lu S, et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med. 2022;386(21):1973-85.
- 6)
- Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer:a phase III randomised controlled trial. Lancet. 2009;374(9687):379-86.
- 7)
- Thomas M, Rübe C, Hoffknecht P, et al. Effect of preoperative chemoradiation in addition to preoperative chemotherapy:a randomised trial in stage III non-small-cell lung cancer. Lancet Oncol. 2008;9(7):636-48.
- 8)
- Pless M, Stupp R, Ris HB, et al. Induction chemoradiation in stage IIIA/N2 non-small-cell lung cancer:a phase 3 randomised trial. Lancet. 2015;386(9998):1049-56.
- 9)
- Katakami N, Tada H, Mitsudomi T, et al. A phase 3 study of induction treatment with concurrent chemoradiotherapy versus chemotherapy before surgery in patients with pathologically confirmed N2 stage IIIA nonsmall cell lung cancer(WJTOG9903). Cancer. 2012;118(24):6126-35.
- 4-2
- 術後補助化学療法
樹形図
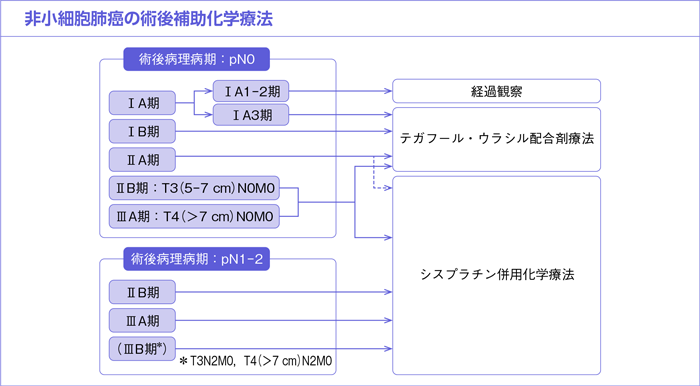
CQ27.
病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)*完全切除,腺癌症例に対して,テガフール・ウラシル配合剤療法は勧められるか?
- 推 奨
- 病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)*完全切除,腺癌症例に対して,テガフール・ウラシル配合剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:85%〕
*術後病理病期T3N0M0/ⅡB期を含む。
75歳以下のⅠ-Ⅲ期非小細胞肺癌を対象にCDDP+VDS+テガフール・ウラシル配合剤(UFT)とUFT,手術単独の3群について比較試験が行われ,5年生存率でUFT群は64%と,手術単独群の49%と比し有意に良好であった1)。その後,75歳以下のⅠ期肺腺癌症例に対するUFTの効果を検討する第Ⅲ相試験が行われ,全体では3%(85%→88%),ⅠB期(T>3cm)においては11%(74%→85%)の上乗せ効果が認められた2)。これらに,4つの臨床試験を加えて行われたメタアナリシス(2,003症例;腺癌84%,非腺癌16%)の結果,全体で5%(77%→82%)の5年生存率の改善を認め,UFTの有効性が確認された。組織型別にみると,腺癌においてHR 0.69(95%CI:0.56-0.85)に対し,扁平上皮癌においてはHR 0.82(95%CI:0.57-1.19)であった3)。TNM分類の第7版への改訂に伴い,腫瘍径が2cm以下の患者群と>2cmかつ3cm以下の患者群に分けてサブグループ解析が実施され,腫瘍径>2cmかつ3cm以下の患者群において6%(82%→88%)の5年生存率の改善,HR 0.62(95%CI:0.42-0.90)と良好な結果を示した4)。なお,肺癌取扱い規約第8版では,「病変全体径」とは高分解能CTによるすりガラス成分と充実成分を合わせた最大径を,「充実成分径」とは充実成分の最大径を表し,pT分類では浸潤性増殖を示す部分の最大径を「充実成分径」に置き換えて分類を行う。しかし,上記の臨床試験におけるpT分類は浸潤部分の最大径ではなく,非浸潤部分を含めた腫瘍径で評価されていることに留意する必要がある。これらの臨床試験の登録期間である1985~95年には,高分解能CTの普及が一様ではなく,TNM分類第8版におけるT1miのように,主に肺胞置換型増殖を示す症例の多くは臨床試験に組み入れられていないと考えられ,この群については術後補助化学療法の意義は不明である(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)の完全切除,腺癌症例に対してUFT療法を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。なお,術後病理病期Ⅰ期(腺癌)の完全切除例では手術単独でも74%が無再発であり,化学療法の安全性を十分考慮すべきである。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 85% (34/40) |
13% (5/40) |
3% (1/40) |
0% | 0% |
CQ28.
病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)*完全切除,非腺癌症例に対して,テガフール・ウラシル配合剤療法は勧められるか?
- 推 奨
- 病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)*完全切除,非腺癌症例に対してテガフール・ウラシル配合剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:100%〕
*術後病理病期T3N0M0/ⅡB期を含む。
75歳以下のⅠ-Ⅲ期非小細胞肺癌を対象にCDDP+VDS+テガフール・ウラシル配合剤(UFT)とUFT,手術単独の3群について比較試験が行われ,5年生存率でUFT群は64%と,手術単独群の49%と比し有意に良好であった1)。その後,他の臨床試験を加えて行われたメタアナリシス(2,003症例;腺癌84%,非腺癌16%)の結果,全体で5%(77%→82%)の5年生存率の改善を認め,UFTの有効性が確認された。組織型別にみると,腺癌においてHR 0.69(95%CI:0.56-0.85)に対し,扁平上皮癌においてはHR 0.82(95%CI:0.57-1.19)であった3)。TNM分類の第7版への改訂に伴い腫瘍径2cm以下の患者群と>2cmかつ3cm以下の患者群に分けてサブグループ解析が実施され,腫瘍径>2cmかつ3cm以下の患者群において6%(82%→88%)の5年生存率の改善,HR 0.62(95%CI:0.42-0.90)と良好な結果を示した4)。しかしながら,扁平上皮癌患者に限定した解析ではHR 0.93(95%CI:0.38-2.27)であった4)(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,病変全体径>2cmの術後病理病期Ⅰ-ⅡA期(第8版)の完全切除,非腺癌症例に対してUFT療法を行うよう勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。ただし,前述のように腺癌を中心としてUFTの有効性が証明されているが,非腺癌では検討症例数が少数であることなどから,そのエビデンスは十分とはいえない。また,非小細胞肺癌(非腺癌)の完全切除例で手術単独でも57.1%が無再発であり,化学療法の安全性を十分考慮すべきである。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (40/40) |
0% | 0% | 0% |
CQ29.
術後病理病期Ⅱ-ⅢA期(第8版)*完全切除例に対して,シスプラチン併用化学療法は勧められるか?
- 推 奨
- 術後病理病期Ⅱ-ⅢA期(第8版)*完全切除例に対して,シスプラチン併用化学療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:95%〕
*術後病理病期T3N2M0/ⅢB期,T4(≧7cm)N2M0/ⅢB期を含む。
これまで行われた複数の比較試験(IALT試験5),JBR.10試験6),ANITA試験7))で,CDDP併用療法を術後補助化学療法として行うことでDFSおよび5年生存率の向上が示されている。長期フォローアップの結果においても,術後5年までの生存において術後補助化学療法の有用性が再確認されたが8)9),術後5年を超えると非癌死亡が高まり,術後7年ではその差が同等となることも示された8)。これらの比較試験に,新たに2編(ALPI試験10),BLT試験11))を加えた5つの比較試験について,4,584症例の個々のデータに基づくメタアナリシスが行われた。その結果,術後生存に対するHR 0.89(95%CI:0.82-0.96)と,術後補助化学療法による有意な延命効果が示された。病期別(第5版相当)のHRでは,ⅠA期で1.40(95%CI:0.95-2.06),ⅠB期で0.93(95%CI:0.78-1.10),Ⅱ期で0.83(95%CI:0.73-0.95),Ⅲ期で0.83(95%CI:0.72-0.94)という結果であった12)。サブグループ解析として,CDDP+VNR療法に限ったメタアナリシスもなされ,HRは0.80(95%CI:0.70-0.91)で,手術単独に対するCDDP+VNR療法の病期別(第5版相当)の生存率向上は,Ⅱ期で43%が54%,Ⅲ期で25%が40%と,生存率向上効果が顕著であった13)。これまでの34の臨床試験,8,447症例を集めたメタアナリシスでも同様の結果が示された14)。これらのメタアナリシスに含まれるエビデンスはすべて国外からの報告であり,化学療法のレジメンや投与方法が本邦と異なるものが多く含まれている。なお,第8版におけるⅡA期は,第7版以前の分類ではⅠ期またはⅠB期に相当する。ⅡA(第8版)の患者群は,JBR.10試験のサブグループ解析でOSの延長を示した集団(腫瘍径4cm以上のⅠB期)に含まれていた。
本邦では,完全切除非扁平上皮非小細胞肺癌Ⅱ-ⅢA期(第7版)を対象として,CDDP+VNR療法とCDDP+PEM療法を比較した第Ⅲ相試験(JIPANG試験)が行われた。主要評価項目であるRFSは,HR 0.98(37.3カ月vs 38.9カ月,95%CI:0.81-1.20,P=0.474)とCDDP+VNR療法に対するCDDP+PEM療法の優越性は示されなかった。OSはHR 0.98(95%CI:0.71-1.35)であった。Grade 3以上の有害事象は,全体で89.4% vs 47.4%であり,発熱性好中球減少症は11.6% vs 0.3%,貧血は9.3% vs 2.8%であった。治療関連死亡は,両群で1例ずつ認められた15)(なお,PEMは2022年9月時点で術後補助化学療法として承認されていない)(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,術後病理病期Ⅱ-ⅢA期(第8版)完全切除例に対してCDDP併用化学療法を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 95% (38/40) |
5% (2/40) |
0% | 0% | 0% |
CQ30.
EGFR遺伝子変異陽性の術後病理病期Ⅱ-ⅢA期(第8版)*完全切除例に対して,EGFRチロシンキナーゼ阻害薬は勧められるか?
- 推 奨
-
- a.
- EGFR遺伝子変異陽性の術後病理病期Ⅱ-ⅢA期(第8版)*完全切除例に対して,従来の術後補助化学療法後に,オシメルチニブによる治療の追加を提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:48%〕
-
- b.
- EGFR遺伝子変異陽性の術後病理病期Ⅱ-ⅢA期(第8版)*完全切除例に対して,プラチナ製剤併用療法の代わりとして,EGFRチロシンキナーゼ阻害薬による治療を勧めるだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
*術後病理病期T3N2M0/ⅢB期,T4(≧7cm)N2M0/ⅢB期を含む。
EGFR遺伝子変異陽性症例に対する術後補助化学療法として,EGFRチロシンキナーゼ阻害薬(EGFR-TKI)の効果を検証した第Ⅲ相試験が現在まで複数行われている。現時点でOSの延長を示した試験結果は示されていない。
-
a.完全切除後のEGFR遺伝子変異(エクソン19欠失またはL858R変異)を有するⅠB-ⅢA期(第7版)非小細胞肺癌に対して,主治医判断で術後補助化学療法を施行した後にオシメルチニブ(3年間内服)とプラセボを比較したADAURA試験が行われた。組み入れられた患者(682例)の背景としてはⅠB期が32%,Ⅱ-ⅢA期が68%であり,試験参加前に術後補助化学療法として細胞傷害性抗癌薬を施行された患者が60%であった。なお,ADAURA試験に日本人のⅠB期(第7版)症例は登録されなかった。主要評価項目であるⅡ-ⅢA期(470例)におけるDFSは有意な延長が示された(未到達vs 19.6カ月,HR 0.17,99.06%CI:0.11-0.26,P<0.001)16)。脳転移を含む中枢神経系(CNS)イベントの発症率はオシメルチニブ群で9%,プラセボ群で17%であり,CNS-DFSの延長が示された(HR 0.24,95%CI:0.14-0.42)17)。OSの更新された報告では,Ⅱ-ⅢA期においてオシメルチニブ群はプラセボ群と比較しOSの有意な延長が示された(HR 0.49,95.03%CI:0.33-0.73,P<0.001,5年OS率:85%vs 73%)。Ⅱ-ⅢA期における術後補助化学療法施行の有無別の5年OS率は,術後補助化学療法施行の有無にかかわらずプラセボ群と比較しオシメルチニブ群で高い傾向が示された(術後補助化学療法施行あり:87%vs 75%,術後補助化学療法施行なし:80%vs 66%)。ただし,本試験の対照はプラセボであり,この結果をもってEGFR遺伝子変異陽性の完全切除例に対して,術後補助化学療法を省略してオシメルチニブを行ってもよいか否かは明らかにならない18)。Grade 3以上の有害事象は,オシメルチニブ群23%,プラセボ群14%であり,間質性肺疾患(Grade問わず)はオシメルチニブ群11例(3%),プラセボ群0%であった。致死的な有害事象はオシメルチニブ群で1例,プラセボ群で2例であった。また,QOL指標は両群で差は認められなかった19)(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,EGFR遺伝子変異陽性の術後病理病期Ⅱ-ⅢA期(第8版)完全切除例に対して,プラチナ製剤併用療法後にオシメルチニブ(3年間投与)による治療の追加を行うよう提案する。 エビデンスの強さはB,推奨の強さは2と判断した。過半数の委員が推奨する(推奨1)としたが,弱く推奨する(推奨2)にとどめた委員も少なからずみられた。委員から「OSが有意に延長したことは評価される」とした一方で,推奨1としなかった理由として,「3年間の術後補助療法であり,有害事象に懸念がある」「患者の希望として,無治療で副作用のない時期を大事にしたいという意見もある」などが挙げられた。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 52% (29/56) |
48% (27/56) |
0% | 0% | 0% |
-
b.術後補助化学療法としてEGFRチロシンキナーゼ阻害薬とプラチナ製剤併用療法を比較した試験結果も示されている。海外で施行されたADJUVANT(CTONG1104)試験では,完全切除後Ⅱ-ⅢA(N1-2)期のEGFR遺伝子変異(エクソン19欠失またはL858R変異)を有する非小細胞肺癌に対して,ゲフィチニブ(2年間内服)とCDDP+VNR療法(4サイクル)が比較された。主要評価項目であるDFSは,ゲフィチニブ群で有意な延長を認めた(HR 0.60,95%CI:0.42-0.87,P=0.0054,中央値:28.7カ月vs 18.0カ月)。Grade 3以上の有害事象は,ゲフィチニブ群で12%,CDDP+VNR群で47%であった20)。その後の最終解析では,OSの有意な延長は認められなかった(HR 0.92,95%CI:0.62-1.36,P=0.674,中央値:75.5カ月vs 62.8カ月)21)。またQOLに関しても,ゲフィチニブ群でプラチナ製剤併用療法と比べてQOLの維持や肺癌による症状の悪化までの期間の延長が示された22)。
さらに本邦で同様のデザインで行われたIMPACT(WJOG6410L)試験では,完全切除後Ⅱ-Ⅲ期(第7版)のEGFR遺伝子変異(エクソン19欠失またはL858R変異)を有する非小細胞肺癌に対して,ゲフィチニブ(2年間内服)とCDDP+VNR療法(4サイクル)が比較された。主要評価項目であるDFSは,ゲフィチニブ群での有意延長を認めず(HR 0.92,95%CI:0.67-1.28,P=0.63,中央値:35.9カ月vs 25.1カ月),生存曲線は初期にはゲフィチニブ群が上回るものの4年の時点で交差していた。またOSに関しても,ゲフィチニブ群での有意な延長を認めなかった(HR 1.03,95%CI:0.65-1.65,P=0.89,中央値は両群とも未到達,5年OS率:78.0% vs 74.6%)。Grade 3以上の有害事象はゲフィチニブ群で37.4%,CDDP+VNR療法群で30.4%であった23)(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,EGFR遺伝子変異陽性の術後病理病期Ⅱ-ⅢA期(第8版)完全切除例に対して,プラチナ製剤併用療法の代わりとして,EGFRチロシンキナーゼ阻害薬による治療の可否を判断するだけの根拠が現時点で明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 4% (2/49) |
53% (26/49) |
31% (15/49) |
12% (6/49) |
CQ31.
術後病理病期ⅡB-ⅢA期(第8版)*完全切除例に対して,アテゾリズマブ単剤療法は勧められるか?
- 推 奨
-
- a.
- 術後病理病期ⅡB-ⅢA期(第8版)*完全切除例,腫瘍細胞におけるPD-L1発現50%以上例に対して,シスプラチン併用化学療法後にアテゾリズマブ単剤療法の追加を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:46%〕
-
- b.
- 術後病理病期ⅡB-ⅢA期(第8版)*完全切除例,腫瘍細胞におけるPD-L1発現1%以上50%未満例に対して,シスプラチン併用化学療法後にアテゾリズマブ単剤療法の追加を行うよう勧めるだけの根拠が明確でない。
〔推奨に至る根拠が明確ではない〕
*術後病理病期T3N2M0/ⅢB期,T4(≧7 cm)N2M0/ⅢB期を含む。
完全切除されたⅠB-ⅢA期(第7版)非小細胞肺癌に対して,術後補助化学療法としてシスプラチン併用化学療法後に,アテゾリズマブ(1年間投与)と支持療法(best supportive care;BSC)を比較した第Ⅲ相試験(IMpower010試験)が行われ,中間解析の結果が報告されている24)。主要評価項目はDFSであり,ヒエラルキー解析により腫瘍細胞(TC)におけるPD-L1発現(SP263抗体)1%以上のⅡ-ⅢA期(476例),PD-L1発現を問わないⅡ-ⅢA期(882例),ⅠB-ⅢA期(ITT集団 1,005例)で階層的に解析された。
PD-L1 TC 1%以上のⅡ-ⅢA期におけるDFSは,アテゾリズマブ単剤療法群で有意な延長が認められた(HR 0.66,95%CI:0.50-0.88,P=0.0039,中央値:未到達vs 35.3カ月)。なお,PD-L1 TC 50%以上におけるDFSはHR 0.43(95%CI:0.27-0.68)であったのに対し,PD-L1 TC 1~49%におけるDFSはHR 0.87(95%CI:0.60-1.26)と,PD-L1発現別で効果が異なる傾向が示された。PD-L1発現を問わないⅡ-ⅢA期におけるDFSでも有意な延長が認められた(HR 0.79,95%CI:0.64-0.96,P=0.020,中央値:42.3カ月vs 35.3カ月)が,PD-L1 TC 1%未満におけるDFSはプラセボ群と比較し同等の傾向であった(HR 0.97,95%CI:0.72-1.31)。ⅠB-ⅢA期(ITT集団)のDFSは,現時点で両群間に統計学的有意差は認められていない(HR 0.81,95%CI:0.67-0.99,中央値:未到達vs 37.2カ月)。OSの更新された報告によると,PD-L1 TC 1%以上のⅡ-ⅢA期ではHR 0.71(95%CI:0.49-1.03)で,PD-L1発現を問わないⅡ-ⅢA期ではHR 0.95(95%CI:0.74-1.24)であった。さらに,PD-L1 TC 50%以上ではHR 0.43(95%CI:0.24-0.78)で,PD-L1 TC 1~49%ではHR 0.95(95%CI:0.59-1.54)であり,DFSと同じくPD-L1発現が高い症例でOSベネフィットが得られる傾向にあった25)。これらのPD-L1発現別のサブグループ解析は,一部で事前に規定されていないものであったが,当委員会において評価に値すると判断した。
毒性について,PD-L1発現を問わないⅡ-ⅢA期(882例)において,Grade 3以上の有害事象はアテゾリズマブ群で22%,プラセボ群で12%であり,治療関連死亡はアテゾリズマブ群で8例(2%),プラセボ群で3例(1%)に認められた。免疫関連有害事象は,アテゾリズマブ群で52%,プラセボ群で9%に認められ,アテゾリズマブ群の12%の症例でステロイドの全身投与が必要であった。アテゾリズマブ群で頻度が高かった有害事象としては,甲状腺機能低下症,肝酵素上昇,瘙痒症,皮疹であった24)。なお,日本人集団の毒性頻度は全体集団と概ね同様であった26)(TNM分類8版と以前の版との読み替えについては「周術期.総論」を参照)。
以上より,術後病理病期ⅡB-ⅢA期と一部のⅢB期(T3N2M0)(第8版)の完全切除例,PD-L1 TC 50%以上例に対して,シスプラチン併用化学療法後にアテゾリズマブ単剤療法(1年間投与)の追加を行うよう提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。また,PD-L1 TC 1~49%に対しては,益と害のバランス評価の面で,シスプラチン併用化学療法後にアテゾリズマブ単剤療法(1年間投与)の追加の可否を判断するだけの根拠が現時点で明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|
|---|---|---|---|---|---|
| a | 54% (30/56) |
46% (26/56) |
0% | 0% | 0% |
| b | 0% | 34% (19/56) |
41% (23/56) |
25% (14/56) |
0% |
- 1)
- Wada H, Hitomi S, Teramatsu T. Adjuvant chemotherapy after complete resection in non-small-cell lung cancer. West Japan Study Group for Lung Cancer Surgery. J Clin Oncol. 1996;14(4):1048-54.
- 2)
- Kato H, Ichinose Y, Ohta M, et al. A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung. N Engl J Med. 2004;350(17):1713-21.
- 3)
- Hamada C, Tanaka F, Ohta M, et al. Meta-analysis of postoperative adjuvant chemotherapy with tegafur-uracil in non-small-cell lung cancer. J Clin Oncol. 2005;23(22):4999-5006.
- 4)
- Hamada C, Tsuboi M, Ohta M, et al. Effect of postoperative adjuvant chemotherapy with tegafur-uracil on survival in patients with stage IA non-small cell lung cancer:an exploratory analysis from a meta-analysis of six randomized controlled trials. J Thorac Oncol. 2009;4(12):1511-6.
- 5)
- Arriagada R, Bergman B, Dunant A, et al. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med. 2004;350(4):351-60.
- 6)
- Winton T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med. 2005;352(25):2589-97.
- 7)
- Douillard JY, Rosell R, De Lena, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer(Adjuvant Navelbine International Trialist Association[ANITA]):a randomised controlled trial. Lancet Oncol. 2006;7(9):719-27.
- 8)
- Arriagada R, Dunant A, Pignon JP, et al. Long-term results of the international adjuvant lung cancer trial evaluating adjuvant Cisplatin-based chemotherapy in resected lung cancer. J Clin Oncol. 2010;28(1):35-42.
- 9)
- Butts CA, Ding K, Seymour L, et al. Randomized phase III trial of vinorelbine plus cisplatin compared with observation in completely resected stage IB and II non-small-cell lung cancer:updated survival analysis of JBR-10. J Clin Oncol. 2010;28(1):29-34.
- 10)
- Scagliotti GV, Fossati R, Torri V, et al. Randomized study of adjuvant chemotherapy for completely resected stage I, II, or IIIA non-small-cell Lung cancer. J Natl Cancer Inst. 2003;95(19):1453-61.
- 11)
- Waller D, Peake MD, Stephens RJ, et al. Chemotherapy for patients with non-small cell lung cancer:the surgical setting of the Big Lung Trial. Eur J Cardiothorac Surg. 2004;26(1):173-82.
- 12)
- Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation:a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):3552-9.
- 13)
- Douillard JY, Tribodet H, Aubert D, et al. Adjuvant cisplatin and vinorelbine for completely resected non-small cell lung cancer:subgroup analysis of the Lung Adjuvant Cisplatin Evaluation. J Thorac Oncol. 2010;5(2):220-8.
- 14)
- Arriagada R, Auperin A, Burdett S, et al. Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer:two meta-analyses of individual patient data. Lancet. 2010;375(9722):1267-77.
- 15)
- Kenmotsu H, Yamamoto N, Yamanaka T, et al. Randomized phase III study of pemetrexed plus cisplatin versus vinorelbine plus cisplatin for completely resected stage II to IIIA nonsquamous non-small-cell lung cancer. J Clin Oncol. 2020;38(19):2187-96.
- 16)
- Wu YL, Tsuboi M, He J, et al. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-23.
- 17)
- Herbst RS, Wu YL, John T, et al. Adjuvant osimertinib for resected EGFR-mutated stage IB-IIIA non-small-cell lung cancer:updated results from the phase III randomized ADAURA trial. J Clin Oncol. 2023;41(10):1830-40.
- 18)
- Tsuboi M, Herbst RS, John T, et al. Overall survival with osimertinib in resected EGFR-mutated NSCLC. N Engl J Med. 2023;389(2):137-47. Epub 2023 Jun 4.
- 19)
- Majem M, Goldman JW, John T, et al. Health-related quality of life outcomes in patients with resected epidermal growth factor receptor-mutated non-small cell lung cancer who received adjuvant osimertinib in the phase III ADAURA trial. Clin Cancer Res. 2022;28(11):2286-96.
- 20)
- Zhong WZ, Wang Q, Mao WM, et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA(N1-N2)EGFR-mutant NSCLC(ADJUVANT/CTONG1104):a randomised, open-label, phase 3 study. Lancet Oncol. 2018;19(1):139-48.
- 21)
- Zhong WZ, Wang Q, Mao WM, et al. Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA(N1-N2)EGFR-mutant NSCLC:Final overall survival analysis of CTONG1104 phase III trial. J Clin Oncol. 2021;39(7):713-22.
- 22)
- Zeng J, Mao WM, Chen QX, et al. Quality of life with adjuvant gefitinib versus vinorelbine plus cisplatin in patients with completely resected stage II-IIIA(N1-N2)EGFR-mutant non-small-cell lung cancer:results from the ADJUVANT(CTONG1104)study. Lung Cancer. 2020;150:164-71.
- 23)
- Tada H, Mitsudomi T, Misumi T, et al;West Japan Oncology Group. Randomized phase III study of gefitinib versus cisplatin plus vinorelbine for patients with resected stage II-IIIa non-small-cell lung cancer with EGFR mutation(IMPACT). J Clin Oncol. 2022;40(3):231-41. Epub 2021 Nov 2.
- 24)
- Felip E, Altorki N, Zhou C, et al;IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer(IMpower010):a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021;398(10308):1344-57.
- 25)
- H. Wakelee, N. Altorki, E. Felip, et al. PL03.09 IMpower010:overall survival interim analysis of a phase III study of atezolizumab vs best supportive care in resected NSCLC. J Thorac Oncol. 2022;17(9):Suppl_S2.
- 26)
- Kenmotsu H, Sugawara S, Watanabe Y, et al. Adjuvant atezolizumab in Japanese patients with resected stage IB-IIIA non-small cell lung cancer(IMpower010). Cancer Sci. 2022;113(12):4327-38.
- 4-3
- 術後放射線療法
CQ32.
術後病理病期Ⅰ-Ⅱ期完全切除例に対して,術後放射線療法は勧められるか?
- 推 奨
- 術後病理病期Ⅰ-Ⅱ期完全切除例に対して,術後放射線療法は行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
PORT Meta-analysis Trialists Groupによるメタアナリシスは2016年に改訂版が報告され,術後放射線療法によりむしろ予後は悪化し(HR 1.18,95%CI:1.07-1.31,P=0.001),2年生存率を58%から53%に5%引き下げる結果であった1)。無再発生存率は術後放射線療法群で悪い傾向があり(HR 1.10,95%CI:0.99-1.21,P=0.07),局所無再発生存率は有意に悪かった(HR 1.12,95%CI:1.01-1.24,P=0.03)。術後病理病期について,2005年版のメタアナリシスでは術後放射線療法の予後増悪効果はⅠ-Ⅱ期において明確であった2)。2016年版では解析方法が変更されたものの,やはり早期症例で予後増悪効果が顕著である可能性が示唆されている。
以上より,メタアナリシスによって生存に対する悪影響が明確に示されていることから,術後病理病期Ⅰ-Ⅱ期完全切除例に対する術後放射線療法は行わないよう勧められる。エビデンスの強さはA,また総合的評価では行わないよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 0% | 0% | 100% (40/40) |
CQ33.
術後病理病期Ⅲ期(N2)完全切除例に対して,術後放射線療法は勧められるか?
- 推 奨
- 術後病理病期Ⅲ期(N2)完全切除例に対して,術後放射線療法を行うよう勧めるだけの根拠が明確ではない。
〔推奨に至る根拠が明確でない〕
前述のPORT Meta-analysis Trialists Groupによるメタアナリシスにおいて,術後放射線療法はⅠ-Ⅱ期N0-1においては予後を増悪することが明らかとなっているが,Ⅲ期N2では明確な予後増悪効果は示されていない1)2)。また,非小細胞肺癌完全切除例に対する術後補助化学療法の有効性を示した第Ⅲ相試験(ANITA試験)のサブグループ解析では,pN2症例に限れば術後放射線療法による予後改善の可能性が示唆されている(術後補助化学療法群:47.4カ月vs 23.8カ月,経過観察群:22.7カ月vs 12.7カ月)3)。加えて,症例集積不良のため途中中止となった試験ではあるが,Ⅲ期N2症例に対する術後化学療法と術後化学放射線療法とのランダム化比較試験の結果,化学放射線療法を完遂できたものは2/3にとどまっていたものの,DFSは後者で有意に長く(前者の後者に対するHR 1.49,95%CI:1.01-2.20,P=0.04,中央値:18カ月vs 28カ月),OS中央値も同様に後者で長い傾向が示された(後者の前者に対するHR 0.69,95%CI:0.46-1.04,P=0.07,中央値:28カ月vs 40カ月)4)。そうした中で,Ⅲ期N2症例に対する術後放射線療法の有効性を評価した2つの第Ⅲ相比較試験(PORT-C試験およびLung ART試験)の結果が報告された5)6)。PORT-C試験は術後化学療法後に経過観察する群(対照群)と術後放射線療法を行う群とを比較した試験であるが,主要評価項目であるDFSについては,ITT解析では術後放射線療法群の対照群に対する有意な改善は示されず(HR 0.84,95%CI:0.65-1.09,P=0.2),OSも有意差を認めなかった(HR 1.02,95%CI:0.68-1.52,P=0.93)。ただし,局所領域無増悪生存期間には明らかな改善が示されるとともに(HR 0.71,95%CI:0.51-0.97),per-protocol(PP)解析およびas-treated(AT)解析では,DFSも術後放射線療法群で良好であった(PP解析;HR 0.75,95%CI:0.57-1.00,AT解析;HR 0.73,95%CI:0.56-0.96)。また,術後放射線療法に関連する死亡例はなく,心肺毒性も許容される範囲であった5)。Lung ART試験においても,術後放射線療法群では縦隔再発が25%であり対照群46%と比較して少なく,主要評価項目のDFSでも中央値で術後放射線療法群30.5カ月,対照群22.8カ月と術後放射線療法群で良好な傾向はあったものの有意差はなく(HR 0.86,95%CI:0.68-1.08,P=0.16),3年OS率にも差を認めなかった(術後放射線療法群69% vs対照群67%)。加えてこの試験では,術後放射線療法群でGrade 3/4の心臓・肺の有害事象が11%と対照群5%と比べて多いなど,術後放射線療法による毒性増強という問題も指摘されている。ただし,術後放射線療法のリスクが極めて高いとされる片肺全摘除術が許容され,実際に約10%で適用されていたこと,中央判定で不完全切除と判断された症例が約30%,照射線量に関する違反が13%,照射野に関する違反が32%に上るなど6)7),手術や放射線治療の品質管理が不十分という問題点があり,試験結果の解釈には十分な注意が必要である。
これら2つの比較試験を対象に含めたメタアナリシスの結果も報告されたが,術後放射線療法が局所領域無増悪生存期間を改善することは明確であり(HR 0.64,95%CI:0.50-0.81,P=0.0003),OSの改善効果は認めないものの(HR 0.87,95%CI:0.71-1.07,P=0.18),DFSの改善は示されている(HR 0.83,95%CI:0.71-0.97,P=0.02)8)。現在本邦では,日本臨床腫瘍研究グループ(JCOG)が術後病理病期Ⅲ期(N2)完全切除例を対象に,RFSを主要評価項目として,化学療法後に術後放射線療法を加える群と経過観察する群を比較する第Ⅲ相試験(JCOG1916/J-PORT試験)を厳格な品質管理の下で行っており9),その結果が待たれるところである。
以上より,術後病理病期Ⅲ期N2完全切除症例に対する術後放射線療法は局所領域再発を減少させるうえで有効な治療手段である。しかし,DFSやOSの改善効果については有望な可能性はあるものの,これまでのエビデンスは十分なものではなく,新たに報告された2つの比較試験でも明確な優位性が示されていない。また,その毒性も十分考慮する必要があることから,総合的評価において「推奨に至る根拠が明確ではない」と判断された。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 4% (2/51) |
63% (32/51) |
31% (16/51) |
2% (1/51) |
- 1)
- Burdett S, Rydzewska L, Tierney J, et al. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2016;10(10):CD002142.
- 2)
- PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2005;(2):CD002142.
- 3)
- Douillard JY, Rosell R, De Lena M, et al. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer treated with adjuvant chemotherapy:the adjuvant Navelbine International Trialist Association(ANITA)Randomized Trial. Int J Radiat Oncol Biol Phys. 2008;72(3):695-701.
- 4)
- Shen WY, Ji J, Zuo YS, et al. Comparison of efficacy for postoperative chemotherapy and concurrent radiochemotherapy in patients with IIIA-pN2 non-small cell lung cancer:an early closed randomized controlled trial. Radiother Oncol. 2014;110(1):120-5.
- 5)
- Hui Z, Men Y, Hu C, et al. Effect of postoperative radiotherapy for patients with pIIIA-N2 non-small cell lung cancer after complete resection and adjuvant chemotherapy:the phase 3 PORT-C randomized clinical trial. JAMA Oncol. 2021;7(8):1178-85.
- 6)
- Le Pechoux C, Pourel N, Barlesi F, et al. Postoperative radiotherapy versus no postoperative radiotherapy in patients with completely resected non-small-cell lung cancer and proven mediastinal N2 involvement(Lung ART):an open-label, randomised, phase 3 trial. Lancet Oncol. 2022;23(1):104-14.
- 7)
- Moukasse Y, Pourel N, Lerouge D, et al. Quality of surgery and RT in stage IIIN2 NSCLC:insights from the Lung Adjuvant Radiotherapy trial(Lung ART). Radiother Oncol. 2020;152:S140-1.
- 8)
- Lei T, Li J, Zhong H, et al. Postoperative radiotherapy for patients with resectable stage III-N2 non-small cell lung cancer:a systematic review and meta-analysis. Front Oncol. 2021;11:680615.
- 9)
- Shimoyama R, Nakagawa K, Ishikura S, et al. A multi-institutional randomized phase III trial comparing postoperative radiotherapy to observation after adjuvant chemotherapy in patients with pathological N2 Stage III non-small cell lung cancer:Japan Clinical Oncology Group Study JCOG1916(J-PORT study). Jpn J Clin Oncol. 2021;51(6):999-1003.
- レジメン
- 非小細胞肺癌の周術期薬物療法
術後テガフール・ウラシル配合剤療法
| テガフール・ウラシル配合剤療法 | 250mg/m2/日 | 1~2年間内服 |
|---|
術後シスプラチン併用療法
| CDDP+VNR療法 | CDDP | 80mg/m2,day 1 | 3週毎,4サイクル |
|---|---|---|---|
| VNR | 25mg/m2,day 1,8 | ||
| CDDP+PEM療法 | CDDP | 75 mg/m2,day 1 | 3週毎,4サイクル |
| PEM* | 500 mg/m2,day 1 |
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。
術後オシメルチニブ単剤療法
| オシメルチニブ単剤療法 | 80 mg/日 | 3年間内服 |
|---|
術後アテゾリズマブ単剤療法
| アテゾリズマブ単剤療法 | 1200 mg/body,day 1 | 3週毎,1年間投与 |
|---|
| ニボルマブ併用 修正 #2 |
(非扁平上皮癌のみ) | 3週毎, 3サイクル |
|
|---|---|---|---|
| CDDP | 75 mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5),day 1 | ||
| PEM* | 500 mg/m2,day 1 | ||
| ニボルマブ | 360 mg/body,day 1 | ||
| (扁平上皮癌のみ) | 3週毎, 3サイクル |
||
| CDDP | 75 mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5),day 1 | ||
| GEM | 1250 mg/m2,day1,8 | ||
| ニボルマブ | 360 mg/body,day 1 | ||
| CBDCA | (AUC=6),day 1 | 3週毎, 3サイクル |
|
| PTX | 200 mg/m2,day 1 | ||
| ニボルマブ | 360 mg/body,day 1 | ||
|
・PTXを含むレジメンの場合,PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。


*術前臨床病期T3N2M0/ⅢB期,T4(≧7 cm)N2M0/ⅢB期を含む。