Ⅳ.転移など各病態に対する治療
2
脳転移
文献検索と採択
- 文献検索期間
-
- 1980年1月1日から2021年11月30日
- 文献検索方法
-
- キーワード:brain metastases, radiation therapy
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2022年版改訂は,下記の検索式で2021年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式(検索日:2021年12月27日)
-
#1 "Lung Neoplasms/therapy"[Mesh] #2 "Brain Neoplasms/secondary"[Mesh] #3 #1 AND #2 #4 (((Lung[TI] OR Pulmonary[TI]) AND (Cancer*[TI] OR Carcinoma*[TI] OR Adenocarcinoma*[TI] OR neoplasm*[TI] OR tumo*[TI])) OR "squamous cell carcinoma*"[TI]) AND (Brain*[TI] OR Intracranial*[TI]) AND (metasta*[TIAB] OR secondar*[TIAB]) #5 #3 OR #4 #6 #5 AND 2020/12:2021/11[DP] #7 #6 AND (JAPANESE[LA] OR ENGLISH[LA])
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で日本における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | |
|---|---|---|
| CDDP | シスプラチン | |
| PEM | ペメトレキセド | |
| PTX | パクリタキセル | |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
| BSC | best supportive care | 緩和治療,ベストサポーティブケア |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| GPA | graded prognostic assessment | 段階的予後評価 |
| HR | hazard ratio | ハザード比 |
| KPS | Karnofsky Performance Status | カルノフスキー指数 |
| MET | mesenchymal-epithelial transition | |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 全身状態 |
| QALY | quality adjusted life years | 質調整生存期間 |
| QOL | quality of life | 生活の質 |
| RET | rearranged during transfection | |
| ROS1 | c-ros oncogene 1 receptor tyrosine kinase | |
| RPA | recursive partitioning analysis | 再帰分割分析 |
| RR | relative risk | 相対危険度 |
| STI | stereotactic irradiation | 定位放射線照射 |
| 以下の2つに分けられる | ||
| SRS | stereotactic radiosurgery | 定位手術的照射:1回照射 |
| SRT | stereotactic radiotherapy | 定位放射線治療:分割照射 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害薬 |
樹形図
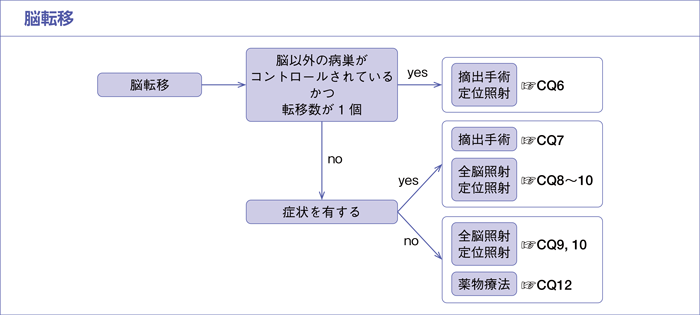
CQ6.
遠隔転移が単発の脳転移のみのⅣ期症例に対して,定位放射線照射や外科治療は勧められるか?
- 推 奨
- 脳以外の病巣がコントロールされており,かつ単発の脳転移に対して,定位放射線照射*や外科治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:85%〕
全身コントロール良好な単発性脳転移を有する症例を対象とした,SRSと手術+全脳照射の比較試験において,SRS単独群のOS中央値は約10カ月と報告されている1)。またPS良好な単発性脳転移を有する症例を対象とした手術と手術+全脳照射の比較試験において,手術単独群のOS中央値は約10カ月と報告されている(全脳照射の追加によるOSの延長はなし:CQ10)2)。これらはいずれも他癌腫を含んだデータで,肺癌患者は3~6割程度を占めていた。近年報告された,非小細胞肺癌患者を対象とした観察研究のシステマティックレビューでは,原発巣がコントロールされ,脳転移に対してSRSや手術などの局所治療を行った患者のOS中央値19.7カ月(範囲6.8-52カ月)と報告されている3)。
以上より,脳以外の病巣がコントロールされており,かつ単発の脳転移に対して,SRSや外科治療を行う妥当性はあると考えられる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 85% (33/39) |
15% (6/39) |
0% | 0% | 0% |
CQ7.
症状を有する脳転移に対して,外科治療は勧められるか?
- 推 奨
- 症状を有する単発性脳転移に対して,腫瘍摘出術を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:100%〕
肺癌は脳転移を生じる頻度が高く,これによって生じた様々な神経症状はQOLを低下させる。このため,QOL改善を目的とした手術が治療選択肢の1つとして汎用されてきた。単発性脳転移を有する固形癌患者を対象とした手術と手術+全脳照射とのランダム化比較試験において,手術単独群のOS中央値は約10カ月,頭蓋内無増悪期間中央値は約6カ月であった(全脳照射の追加によるOSの延長はなし:CQ10)2)。疾患の性質からBSCとの比較試験は存在しないが,症状を有する単発性脳転移に対する手術については治療選択肢として提案可能である。一方,定位照射の有効性が期待できる場合には手術より優先されることが考えられる。エビデンスの強さはC,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (11/11) |
0% | 0% | 0% |
CQ8.
症状を有する脳転移に対して,放射線治療は勧められるか?
- 推 奨
- 症状を有する脳転移に対して,放射線治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
肺癌は脳転移を生じる頻度が高く,これによって生じた様々な神経症状はQOLを低下させる。2つの前向き試験では放射線治療によって70~90%の患者に症状の寛解が得られたと報告されており4),CQ9に示すように全脳照射やSRSのいずれにおいても良好な頭蓋内無増悪期間およびOSが報告されている。
以上より,エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
なお,ステロイド+全脳照射とステロイド単独療法の非劣性を検討した第Ⅲ相試験において,OSとQOLの指標である質調整生存期間(QALY)の非劣性は証明されなかったものの,OS・QOLに有意差はなかった5)。本試験の患者背景はKPS 70未満の割合が約4割と多く,RPA・GPAなどの予後予測因子も不良なものが大多数を占めていた。またOS中央値は両群とも8~9週程度と非常に短く,このために全脳照射の有用性が認められなかったと考えられている。よって,予後不良と考えられる場合はステロイド単独治療も選択肢である。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (11/11) |
0% | 0% | 0% | 0% |
CQ9.
多発性脳転移に対して,放射線治療は勧められるか?
- 推 奨
-
〈非小細胞肺癌の場合〉
- a.
- 多発性脳転移に対して,全脳照射を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:84%〕
-
- b.
- 4個以下で腫瘍径3cm程度までであれば定位放射線照射*を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:97%〕
-
- c.
- 5~10個の脳転移に対して,定位放射線照射を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:63%〕
-
〈小細胞肺癌の場合〉
- d.
- 多発性脳転移に対して,全脳照射を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:75%〕
-
- e.
- 10個までの脳転移に対して,定位放射線照射を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:75%〕
*定位放射線照射(STI)は,線量分割の違いにより,1回照射の場合を定位手術的照射(SRS),分割照射の場合を定位放射線治療(SRT)と定義されている。ガンマナイフ,サイバーナイフやリニアックによる1回照射はSRSに含まれる。脳幹など重要組織が近接している場合や大きい腫瘍にはSRTで治療を行うことがある。
-
a・b.従来,多発性脳転移に対しては全脳照射が行われてきた。疾患の性質からBSCとの比較試験は存在しないが,2つの前向き試験では放射線治療によって70~90%の患者に症状の寛解が得られたと報告されている。それらの前向き試験ではそのOS中央値は3.5~7.5カ月程度であり,頭蓋内無増悪期間は中央値約6カ月程度と報告されている6)~10)。
全脳照射は一般的には30Gy/10回/2週や37.5Gy/15回/3週の照射法が使われることが多い。全脳照射後の認知機能低下について,脳転移術後照射の検討では両者に差はみられなかった11)。
4個以下,3cm程度の脳転移に対してはSRSのエビデンスも蓄積されており,前向き試験のデータではOS中央値は約8~15カ月,照射1年後の局所コントロール率は6~9割程度と報告されている12)13)。
脳腫瘍に対する放射線照射の有害事象として治療後のQOLの低下が問題となることがある。手術やSRSに全脳照射を追加することで,活動性の低下や認知機能障害が生じることを示す報告13)~15)がある一方で,評価の方法や時期の違いの影響から差がなかったとする報告もある12)。一方,全脳照射を省くことで脳内再発によって認知機能の悪化がみられることがある。
以上より,多発性脳転移に対する全脳照射,4個以下で腫瘍径3cm程度までに対するSRSは複数の前向き試験でその有効性が示唆されている。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|
|---|---|---|---|---|---|
| a | 84% (32/38) |
16% (6/38) |
0% | 0% | 0% |
| b | 97% (37/38) |
3% (1/38) |
0% | 0% | 0% |
-
c.5個以上の脳転移に対するSRSの有効性については,前向き観察研究で5~10個の脳転移と2~4個の脳転移に対する治療成績の比較によって,生存率に差がなかったとする結果が本邦から報告されており,有害事象の出現率にも差を認めなかった(9% vs 9%,P=0.89)16)。ただし,本研究の適格基準として最大径3cm未満,最大腫瘍体積10mL未満,合計体積15mLなどが挙げられており,この結果を適応できる患者は限られる可能性がある。一方で,全脳照射後の認知機能低下について複数の報告がされている14)15)。これらのことから,同対象に対して定位照射も治療選択肢として提案できる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。また個数にかかわらず定位照射を選択した場合には,しばしば後発転移が生じることから定期的な画像診断を継続することが必要である。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 63% (20/32) |
38% (12/32) |
0% | 0% |
-
d・e.小細胞肺癌のSTIについての多施設後方視的観察研究では,1個,2~4個,5~10個でそれぞれ生存期間中央値が11カ月,8.7カ月,8.0カ月と報告されており,全脳照射と比較しても中枢神経転移の無増悪期間は短くなるもののOSに差は認められなかった17)。多発脳転移に対する全脳照射のエビデンスの強さはC,ただし総合的評価では行うように推奨(1で推奨)できると判断した。また,10個までの脳転移に対するSTIのエビデンスの強さはD,ただし総合的評価では行うように提案(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|
|---|---|---|---|---|---|
| d | 75% (41/55) |
25% (14/55) |
0% | 0% | 0% |
| e | 7% (4/55) |
75% (41/55) |
13% (7/55) |
5% (3/55) |
0% |
CQ10.
手術や定位放射線照射に,全脳照射の追加は勧められるか?
- 推 奨
- 手術や定位放射線照射に,全脳照射の併用を行わないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:100%〕
症状を有する脳単発の脳転移を有する患者に対しての手術と,手術+全脳照射との併用療法を比較したランダム化比較試験は1つあり,OSに有意差は認められなかったが(43週vs 48週,RR 0.91,95%CI:0.59-1.40,P=0.39),局所再発は有意に減少した(46% vs 10%,P<0.001)2)。
4個以下の脳転移に対するSRSと,SRS+全脳照射との併用療法を比較した試験は複数あり,ランダム化比較試験のメタアナリシスで局所制御率については併用群で有意に良好であった(HR 2.61,95%CI:1.68-4.06,P<0.0001)が,OSに有意差を認めなかった(HR 0.98,95%CI:0.71-1.35,P=0.88)18)。4個以下の脳転移に対して,3cmを超える病変に対して手術が行われ,手術後残存腫瘍に対して全脳照射または再発時SRSを比較したランダム化比較試験が行われた19)。OSは両群ともに15.6カ月で,非劣性仮説に対する片側P値=0.027(HR 1.05,90%CI:0.83-1.33)であり,SRS群の全脳照射群に対する非劣性が証明された。
認知機能に関しては1つのランダム化比較試験ではSRS群とSRS+全脳照射群間でMini Mental State Examination(MMSE)の結果に有意差は認められなかったが12),もう1つのランダム化比較試験ではHopkins Verbal Learning Test-Revised(HVLT-R)を用いて評価を行ったところ,記憶学習能力が併用群で有意に低下したため早期中止となっている13)。同じく,複数の認知機能検査を用いて評価したランダム化比較試験でもSRS群と比較してSRS+全脳照射群で3カ月後の評価で有意に低下がみられた15)。
また,手術もしくはSRSを行った患者に対して全脳照射の追加を検討したランダム化比較試験において,全脳照射併用群は健康関連QOLが悪い傾向にあった14)。
以上より,脳転移に対する手術やSRSに全脳照射を追加すると,局所制御には有効であると考えられるが,一方では生存には寄与せず,認知機能低下などの有害事象も懸念されることが複数の臨床試験で示されている。このため手術やSRS後に全脳照射を追加するかしないかは,腫瘍サイズや性状,手術所見などを踏まえて総合的に判断すべきである。エビデンスの強さはA,また総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 0% | 100% (11/11) |
0% |
CQ11.
髄膜癌腫症に対する適切な治療法は何か?
- 推 奨
- 髄膜癌腫症に対して,薬物療法・放射線治療を行うよう勧めるだけの根拠が明確ではない。
〔推奨度決定不能〕
髄膜癌腫症に対する薬物療法に関して,本邦で承認された薬剤・用量に限った場合,いくつかの小規模前向き研究がある。EGFR T790M変異陽性の進行非小細胞肺癌を対象としたオシメルチニブの前向き臨床試験参加症例のうち,髄膜癌腫症を認めた22例のpost-hoc解析では,頭蓋内病変のORR 55%,PFS中央値11.0カ月であったと報告されている20)。また,T790M変異陽性の髄膜癌腫症を有する症例を対象としたオシメルチニブの小規模前向き研究では,髄膜癌腫症が確定的な症例5例のうち2例でオシメルチニブの有効性が確認され,全13症例のPFS中央値は7.2カ月であった21)。これらの結果により,髄液移行性の高い特定の薬剤において有効な可能性が示唆されるが,限られた小数例のコホートにとどまっておりエビデンスとして十分ではない。また,髄膜癌腫症に対する放射線治療(全脳照射)の有用性を検討した前向き臨床試験は存在しない。後方視的研究では,髄膜癌腫症に対する全脳照射の有用性は認められていないが22)23),なかには症状緩和が得られる症例が経験されることもある。
以上より,髄膜癌腫症に対し薬物療法・放射線治療を行うよう勧めるだけの根拠が明確ではなく,推奨度決定不能とした。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 16% (4/25) |
64% (16/25) |
20% (5/25) |
0% |
CQ12.
無症候性脳転移に対して,薬物療法は勧められるか?
- 推 奨
- 薬物療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
無症候性脳転移に対しては全身治療として薬物療法が治療の中心となるものの,放射線治療も高い局所制御を示すことからその時期を逸さないことは重要である。一方で近年,新規薬物療法の登場によって進行非小細胞肺癌の予後は延長しており,治療方針を決定する際の評価項目として,OS・脳転移制御率だけではなく神経学的予後に対する配慮もより重要となっている。
無症候性脳転移に対して薬物療法・放射線治療のどちらを先行させるかという重要なクリニカルクエスチョンが生じるが,現時点で明確なエビデンスは乏しいことから,脳転移巣のサイズ・個数・部位,医療状況などをもとに放射線腫瘍医と十分検討のうえで判断されるべきである。
放射線治療に関しては,CQ9を参照すること。
遺伝子変異を有する無症候性脳転移患者に対する分子標的治療薬の有効性は,多くが第Ⅲ相試験のサブグループ解析もしくは単群試験における少数例の報告である。TKI未治療の脳転移症例に対する各TKIの全身における有効性はORR 53-83%,PFS中央値6.6カ月-未到達と良好である24)~28)。
また,無症候性脳転移患者に対する細胞傷害性抗癌薬の有効性が複数の試験で,免疫チェックポイント阻害薬の有効性についても少数ながら臨床試験で検討されている。
それぞれの治療薬の頭蓋内奏効について,以下の表にまとめる。多くの結果は前向き試験のサブグループにおける結果であり,それぞれの数字による直接の比較はできないことに注意が必要である。詳細については各文献を参照のうえで使用を検討すること。
| 対象,試験 | 患者対象 | レジメン | CNS RR 〔%(95%CI)〕 |
CNS PFS中央値 〔カ月(95%CI)〕 |
症例数 (例) |
|||
|---|---|---|---|---|---|---|---|---|
| 未治療 | 既治療 | |||||||
| ドライバー遺伝子に対する標的療法 | EGFR | 脳転移を有する症例を対象とした第Ⅱ相試験29) | ○ | ゲフィチニブ | 87.8 | 14.5 (10.2~18.3) |
41 | |
| FLAURA試験30) | ○ | オシメルチニブ | 66修正 #6 (52~77) |
未到達 (16.5~NR) |
61 | |||
| ○ | 第一世代EGFR-TKI | 43 (31~56) |
13.9 (8.3~NR) |
67 | ||||
| AURA3試験31) | ○ | オシメルチニブ | 70 (51~85) |
11.7 (10~NR) |
30 | |||
| ○ | (細胞傷害性抗癌薬) | 31 (11~59) |
5.6 (4.2~9.7) |
16 | ||||
| 統合解析32)(上記試験を含む) | ○ | ○ | オシメルチニブ | 64 (53~76) |
― | 248 | ||
| ALK | PROFILE 1005/1007試験26) | ○ | クリゾチニブ | 18 (5~40) |
― | 109 | ||
| ALEX試験27) | ○ | アレクチニブ | 78.6 | ― | 14 | |||
| ○ | クリゾチニブ | 40.0 | ― | 15 | ||||
| ASCEND-4試験28) | ○ | セリチニブ | 69.2 (38.6~90.9) |
― | 13 | |||
| ○ | (細胞傷害性抗癌薬) | 27.8 (9.7~53.5) |
― | 18 | ||||
| 第Ⅰ/Ⅱ相試験33) | ○ | ロルラチニブ | 63.0 (51.5~73.4) |
― | 81 | |||
| CROWN試験34) | ○ | ロルラチニブ | 66 (49~80) |
― | 38 | |||
| ○ | クリゾチニブ | 20 (9~36) |
― | 40 | ||||
| ALTA試験35) | ○ | ブリグチニブ | 67 (41~87) |
― | 18 | |||
| ALTA-1L試験36) | ○ | ブリグチニブ | 78 (52~94) |
― | 18 | |||
| ○ | クリゾチニブ | 29 (11~52) |
― | 21 | ||||
| ROS1 | ALKA-372-001試験 STARTRK-1,2試験37) |
○ | エヌトレクチニブ | 52.2 (37.0~67.1) |
8.3 (6.4~15.7) |
24 | ||
| MET | GEOMETRY mono-1試験38) | ○ | ○ | カプマチニブ | 54 | ― | 13 | |
| VISION試験39) | ○ | ○ | テポチニブ | 45 | ― | 15 | ||
| RET | LIBRETTO-001試験40) | ○ | ○ | セルペルカチニブ | 91 (59~100) |
― | 11 | |
| 細胞傷害性抗癌薬/血管新生阻害薬 | 脳転移を有する症例を対象とした海外第Ⅱ相試験41) | ○ | CDDP+PEM | 41.9 (27~57.9) |
5.7 (4.0~7.6) |
43 | ||
| 脳転移を有する症例を対象とした海外前向き第Ⅱ相試験(BRAIN試験42)) | ○ | CBDCA+PTX+ベバシズマブ | 61.2 (48.5~72.9) |
8.1 (5.5~11.3) |
67 | |||
| 免疫チェックポイント阻害薬 | 脳転移を有する症例を対象とした海外前向き第Ⅱ相試験43) | ○ | ペムブロリズマブ | 29.7 (15.9~47.0) |
― | 37 | ||
以上より,無症候性脳転移に対する薬物療法については,有効性を示唆するデータが複数報告されているものの,いずれも単群第Ⅱ相試験や第Ⅲ相試験のサブグループ解析である。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (42/42) |
0% | 0% | 0% | 0% |
- 1)
- Muacevic A, Wowra B, Siefert A, et al. Microsurgery plus whole brain irradiation versus Gamma Knife surgery alone for treatment of single metastases to the brain:a randomized controlled multicentre phase III trial. J Neurooncol. 2008;87(3):299-307.
- 2)
- Patchell RA, Tibbs PA, Regine WF, et al. Postoperative radiotherapy in the treatment of single metastases to the brain:a randomized trial. JAMA. 1998;280(17):1485-9.
- 3)
- Ashworth A, Rodrigues G, Boldt G, et al. Is there an oligometastatic state in non-small cell lung cancer? A systematic review of the literature. Lung Cancer. 2013;82(2):197-203.
- 4)
- Borgelt B, Gelber R, Kramer S, et al. The palliation of brain metastases:final results of the first two studies by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 1980;6(1):1-9.
- 5)
- Mulvenna P, Nankivell M, Barton R, et al. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy(QUARTZ):results from a phase 3, non-inferiority, randomised trial. Lancet. 2016;388(10055):2004-14.
- 6)
- Coia LR. The role of radiation therapy in the treatment of brain metastases. Int J Radiat Oncol Biol Phys. 1992;23(1):229-38.
- 7)
- Coia LR, Aaronson N, Linggood R, et al. A report of the consensus workshop panel on the treatment of brain metastases. Int J Radiat Oncol Biol Phys. 1992;23(1):223-7.
- 8)
- Murray KJ, Scott C, Zachariah B, et al. Importance of the mini-mental status examination in the treatment of patients with brain metastases:a report from the Radiation Therapy Oncology Group protocol 91-04. Int J Radiat Oncol Biol Phys. 2000;48(1):59-64.
- 9)
- Chatani M, Teshima T, Hata K, et al. Prognostic factors in patients with brain metastases from lung carcinoma. Strahlenther Onkol. 1986;162(3):157-61.
- 10)
- Haie-Meder C, Pellae-Cosset B, Laplanche A, et al. Results of a randomized clinical trial comparing two radiation schedules in the palliative treatment of brain metastases. Radiother Oncol. 1993;26(2):111-6.
- 11)
- Trifiletti DM, Ballman KV, Brown PD, et al. Optimizing whole brain radiation therapy dose and fractionation:results from a prospective phase 3 trial(NCCTG N107C[Alliance]/CEC.3). Int J Radiat Oncol Biol Phys. 2020;106(2):255-60.
- 12)
- Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483-91.
- 13)
- Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial. Lancet Oncol. 2009;10(11):1037-44.
- 14)
- Soffietti R, Kocher M, Abacioglu UM, et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery:quality-of-life results. J Clin Oncol. 2013;31(1):65-72.
- 15)
- Brown PD, Jaeckle K, Ballman KV, et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases:a randomized clinical trial. JAMA. 2016;316(4):401-9.
- 16)
- Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases(JLGK0901):a multi-institutional prospective observational study. Lancet Oncol. 2014;15(4):387-95.
- 17)
- Rusthoven CG, Yamamoto M, Bernhardt D, et al. Evaluation of first-line radiosurgery vs whole-brain radiotherapy for small cell lung cancer brain metastases:the FIRE-SCLC cohort study. JAMA Oncol. 2020;6(7):1028-37.
- 18)
- Tsao M, Xu W, Sahgal A. A meta-analysis evaluating stereotactic radiosurgery, whole-brain radiotherapy, or both for patients presenting with a limited number of brain metastases. Cancer. 2012;118(9):2486-93.
- 19)
- Kayama T, Sato S, Sakurada K, et al. Effects of surgery with salvage stereotactic radiosurgery versus surgery with whole-brain radiation therapy in patients with one to four brain metastases(JCOG0504):a phase III, noninferiority, randomized controlled trial. J Clin Oncol. 2018;36(33), 3282-9.
- 20)
- Ahn MJ, Chiu CH, Cheng Y, et al. Osimertinib for patients with leptomeningeal metastases associated with EGFR T790M-positive advanced NSCLC:The AURA leptomeningeal metastases analysis. J Thorac Oncol. 2020;15(4):637-48.
- 21)
- Nanjo S, Hata A, Okuda C, et al. Standard-dose osimertinib for refractory leptomeningeal metastases in T790M-positive EGFR-mutant non-small cell lung cancer. Br J Cancer. 2018;118(1):32-7.
- 22)
- Morris PG, Reiner AS, Szenberg OR, et al. Leptomeningeal metastasis from non-small cell lung cancer:survival and the impact of whole brain radiotherapy. J Thorac Oncol. 2012;7(2):382-5.
- 23)
- Li YS, Jiang BY, Yang JJ, et al. Leptomeningeal metastases in patients with NSCLC with EGFR mutations. J Thorac Oncol. 2016;11(11):1962-9.
- 24)
- Park SJ, Kim HT, Lee DH, et al. Efficacy of epidermal growth factor receptor tyrosine kinase inhibitors for brain metastasis in non-small cell lung cancer patients harboring either exon 19 or 21 mutation. Lung Cancer. 2012;77(3):556-60.
- 25)
- Schuler M, Wu YL, Hirsh V, et al. First-line afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor receptor gene mutations and brain metastases. J Thorac Oncol. 2016;11(3):380-90.
- 26)
- Costa DB, Shaw AT, Ou SH, et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases. J Clin Oncol. 2015;33(17):1881-8.
- 27)
- Gadgeel S, Peters S, Mok T, et al. Alectinib versus crizotinib in treatment-naive anaplastic lymphoma kinase-positive(ALK+)non-small-cell lung cancer:CNS efficacy results from the ALEX study. Ann Oncol. 2018;29(11):2214-22.
- 28)
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer(ASCEND-4):a randomised, open-label, phase 3 study. Lancet. 2017;389(10072):917-29.
- 29)
- Iuchi T, Shingyoji M, Sakaida T, et al. Phase II trial of gefitinib alone without radiation therapy for Japanese patients with brain metastases from EGFR-mutant lung adenocarcinoma. Lung Cancer. 2013;82(2):282-7.
- 30)
- Reungwetwattana T, Nakagawa K, Cho BC, et al. CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non-small-cell lung cancer. J Clin Oncol. 2018;36(33):3290-7.
- 31)
- Wu YL, Ahn MJ, Garassino MC, et al. CNS efficacy of osimertinib in patients with T790M-positive advanced non-small-cell lung cancer:data from a randomized phase III trial(AURA3). J Clin Oncol. 2018;36(26):2702-9.
- 32)
- Erickson AW, Brastianos PK, Das S. Assessment of effectiveness and safety of osimertinib for patients with intracranial metastatic disease:A systematic review and meta-analysis. JAMA Netw Open. 2020;3(3):e201617.
- 33)
- Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer:results from a global phase 2 study. Lancet Oncol. 2018;19(12):1654-67.
- 34)
- Shaw AT, Bauer TM, Marinis F, et al. First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med. 2020;383(21):2018-29.
- 35)
- Huber RM, Hansen KH, Paz-Ares Rodríguez L, et al. Brigatinib in crizotinib-refractory ALK+NSCLC:2-year follow-up on systemic and intracranial outcomes in the phase 2 ALTA trial. J Thorac Oncol. 2020;15(3):404-15.
- 36)
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus crizotinib in ALK-positive non-small-cell lung cancer. N Engl J Med. 2018;379(21):2027-39.
- 37)
- Dziadziuszko R, Krebs MG, De Braud F, et al. Updated integrated analysis of the efficacy and safety of entrectinib in locally advanced or metastatic ROS1 fusion-positive non-small-cell lung cancer. J Clin Oncol. 2021;39(11):1253-63.
- 38)
- Wolf J, Seto T, Han JY, et al. Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med. 2020;383(10):944-95.
- 39)
- Le X, Sakai H, Felip E, et al. Tepotinib efficacy and safety in patients with met exon 14 skipping NSCLC:outcomes in patient subgroups from the VISION study with relevance for clinical practice. Clin Cancer Res. 2022;28(6):1117-26.
- 40)
- Drilon A, Oxnard GR, Tan DSW, et al. Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer. N Engl J Med. 2020;383(9):813-24.
- 41)
- Barlesi F, Gervais R, Lena H, et al. Pemetrexed and cisplatin as first-line chemotherapy for advanced non-small-cell lung cancer(NSCLC)with asymptomatic inoperable brain metastases:a multicenter phase II trial(GFPC 07-01). Ann Oncol. 2011;22(11):2466-70.
- 42)
- Besse B, Le Moulec S, Mazières J, et al. Bevacizumab in patients with nonsquamous non-small cell lung cancer and asymptomatic, untreated brain metastases(BRAIN):a nonrandomized, phase II study. Clin Cancer Res. 2015;21(8):1896-903.
- 43)
- Goldberg SB, Schalper KA, Gettinger SN, et al. Pembrolizumab for management of patients with NSCLC and brain metastases:long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 2020;21(5):655-63.
- レジメン
- 転移性脳腫瘍に対する治療
| 緩和的放射線治療 (全脳照射) |
30Gy/10回(2週),37.5Gy/15回(3週),40Gy/20回(4週)など |
|---|


*定位放射線照射(STI)は,線量分割の違いにより,1回照射の場合を定位手術的照射(SRS),分割照射の場合を定位放射線治療(SRT)と定義されている。ガンマナイフ,サイバーナイフやリニアックによる1回照射はSRSに含まれる。脳幹など重要組織が近接している場合や大きい腫瘍にはSRTで治療を行うことがある。