Ⅲ.小細胞肺癌(SCLC)
2
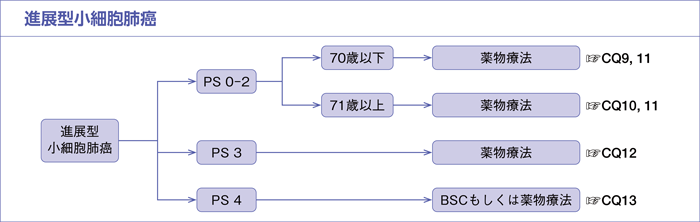
進展型小細胞肺癌(ED-SCLC)
文献検索と採択
- 文献検索期間
-
- 2004年12月1日から2022年11月30日
- 文献検索方法
-
- キーワード:small-cell lung cancer, chemotherapy,(NOT non-small-cell lung cancer)
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2023年版改訂は,下記の検索式で2022年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式(検索日:2023年1月12日)
-
#1 S SMALL CELL LUNG CARCINOMA+NT/CT AND (EXTENSIVE OR ED OR EXTENDED)/TI,AB #2 S ((SMALL OR OAT)(2W)CELL?(3A)(LUNG OR PULMONARY)(3A)(ADENOCARCINOM? OR CARCINOM? OR CANCER? OR TUMOR? OR TUMOUR?) OR SCLC)(4A)(EXTENSIVE OR ED OR EXTENDED) #3 S CARCINOMA, NON-SMALL-CELL LUNG+NT/CT OR (NONSMALL? OR NON(W)SMALL OR LARGE? OR SQUAMOUS?)(3A)(LUNG OR PULMONARY)(3A)(NEOPLASM? OR CARCINOM? OR CANCER? OR TUMOR? OR TUMOUR?) OR ADENOCARCINOM?(3A)(LUNG? OR PULMONARY) OR NSCLC #4 S #2 NOT #3 #5 S #1 OR #4 #6 S #5 AND ENGLISH/LA AND (2021-2023)/PY AND (20211201-20221130)/UP #7 S #6 AND (META-ANALYSIS/DT OR META-ANALYSIS AS TOPIC+NT/CT OR (METAANALYSIS OR META(W)ANALYSIS)/TI,AB) #8 S #6 AND (SYSTEMATIC REVIEW/DT OR SYSTEMATIC REVIEWS AS TOPIC+NT/CT OR SYSTEMATIC(W)REVIEW?/TI,AB) #9 S #6 AND (PRACTICE GUIDELINE/DT OR PRACTICE GUIDELINES AS TOPIC+NT/CT OR CONSENSUS+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCES AS TOPIC+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCE/DT OR (GUIDELINE? OR CONSENSUS?)/TI) #10 S #6 AND (RANDOMIZED CONTROLLED TRIAL?/DT OR PRAGMATIC CLINICAL TRIAL/DT OR EQUIVALENCE TRIAL/DT OR RANDOMIZED CONTROLLED TRIALS AS TOPIC+NT/CT OR (RANDOM?/TI,AB NOT MEDLINE/FS) ) #11 S #6 AND (CLINICAL TRIAL/DT OR CLINICAL STUDY/DT OR CLINICAL TRIALS AS TOPIC+NT/CT OR CLINICAL(W)(TRIAL? OR STUD?) OR (CASE(W)(CONTROL? OR COMPARISON?)/TI,AB NOT MEDLINE/FS)) #12 S #6 AND (EPIDEMIOLOGIC STUDIES+NT/CT OR EPIDEMIOLOGIC RESEARCH DESIGN+NT/CT OR COMPARATIVE STUDY/DT OR MULTICENTER STUDY/DT OR MULTICENTER STUDIES AS TOPIC+NT/CT OR ((COHORT? OR COMPARATIVE? OR FOLLOWUP OR FOLLOW(W)UP OR MULTICENTER?)(3W)STUD?/TI,AB NOT MEDLINE/FS)) #13 S #7 OR #8 OR #9 OR #10 OR #11 OR #12 #14 S #13/HUMAN OR (#13 NOT ANIMALS/CT)
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で本邦における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
本文中に用いた略語および用語の解説
| AMR | アムルビシン | |
|---|---|---|
| CBDCA | カルボプラチン | |
| CDDP | シスプラチン | |
| CPA | シクロホスファミド | |
| CPT-11 | イリノテカン | |
| DXR | ドキソルビシン | |
| ETP | エトポシド | |
| GEM | ゲムシタビン | |
| PTX | パクリタキセル | |
| VCR | ビンクリスチン | |
| VNR | ビノレルビン | |
| プラチナ製剤 | CDDPとCBDCAの総称 | |
| ACE | ドキソルビシン+シクロホスファミド+エトポシド | |
| CAV | シクロホスファミド+ドキソルビシン+ビンクリスチン | |
| CE | カルボプラチン+エトポシド | |
| PA | シスプラチン+アムルビシン | |
| PE | シスプラチン+エトポシド | |
| PI | シスプラチン+イリノテカン | |
| SPE | 分割投与シスプラチン+エトポシド | |
| BSC | best supportive care | 緩和治療,ベストサポーティブケア |
| ED | extensive disease | 進展型(小細胞肺癌の) |
| HR | hazard ratio | ハザード比 |
| JCOG | Japan Clinical Oncology Group | 日本臨床腫瘍研究グループ |
| LD | limited disease | 限局型(小細胞肺癌の) |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PD-L1 | programmed cell death ligand 1 | プログラム細胞死リガンド1 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 全身状態 |
| SCLC | small cell lung cancer | 小細胞肺癌 |
樹形図
CQ9.
進展型小細胞肺癌(PS 0-2,70歳以下)における最適な一次治療は何か?
- 推 奨
-
- a.
- 進展型小細胞肺癌(PS 0-2,70歳以下)にはシスプラチン+イリノテカン療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- 進展型小細胞肺癌(PS 0-2,70歳以下)にはシスプラチン+エトポシド療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:100%〕
-
a.EDに対して,1980年代以降CDDP+ETP(PE)療法とのランダム化比較試験が行われた。2000年に報告されたCDDPを含む薬物療法とそれ以外との比較試験のメタアナリシスでは,CDDPを含むレジメンがORRおよび1年OS率が有意に高く,治療関連死には差を認めなかったとしている1)。2000年以降,PS 0-2を対象とした,PE療法とDXR+CPA+ETP(ACE)療法との比較試験が実施され,ORR,OSに有意差はなく,ACE療法が有意に好中球減少,敗血症の割合が高かったことが示されていることから2),世界的にはPE療法が標準治療と考えられてきた。
本邦で70歳以下のPS 0-2を対象とした,PE療法とCDDP+CPT-11(PI)療法とのランダム化比較試験(JCOG9511試験)が行われ,PI療法が有意にOSを延長することが示された(HR 0.60,95%CI:0.43-0.83,P=0.002,中央値:9.4カ月vs 12.8カ月)3)。その後,北米を中心にPE療法とPI療法との第Ⅲ相試験による追試が行われたが,各試験単独では両群間でOSに有意差を認めず,JCOG9511試験の結果を再現することはできなかった4)~7)。しかしながら,これら第Ⅲ相試験を含むプラチナ製剤+ETPとプラチナ製剤+CPT-11とのランダム化比較試験のメタアナリシスでは,CPT-11群が有意にOSを延長し,PFSおよびORRもCPT-11群で改善する傾向にあることが示された8)~10)。
また,PI療法もしくはPE療法とCDDP+AMR(PA)療法とのランダム化比較試験が,本邦および中国で非劣性のデザインで行われ,PI療法に対してPA療法はOSの非劣性を証明することはできなかった(HR 1.43,95%CI:1.10-1.85,中央値:PI 17.7カ月vs PA 15.0カ月)11)。一方,PE療法に対しては,非劣性は証明されたものの両群のOSに有意差はなかった(HR 0.81,95%CI:0.63-1.03,中央値:PE 10.3カ月vs PA 11.8カ月)12)。
PI療法の特徴として血液毒性が軽度な一方,嘔吐,下痢の頻度が高いことが示されている8)~10)13)。また,間質性肺炎を有する患者には禁忌とされている。そのため,下痢の発症が懸念される患者,間質性肺炎の発症が懸念される,もしくは間質性肺炎を合併している患者にはPE療法を行うよう勧められる。
以上より,進展型小細胞肺癌(PS 0-2,70歳以下)にはPI療法を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (22/22) |
0% | 0% | 0% | 0% |
-
b.JCOG9511試験においてPE療法はPI療法に劣り,複数のメタアナリシスでも同様の結果が認められているが,世界的に標準とされているレジメンはPE療法である。
以上より,進展型小細胞肺癌(PS 0-2,70歳以下)にはPE療法を行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (22/22) |
0% | 0% | 0% |
CQ10.
進展型小細胞肺癌(PS 0-2,71歳以上)における最適な一次治療は何か?
- 推 奨
-
- a.
- 進展型小細胞肺癌(PS 0-2,71歳以上)に対してシスプラチンの一括投与が可能な場合にはシスプラチン+エトポシド療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:96%〕
-
- b.
- 進展型小細胞肺癌(PS 0-2,71歳以上)に対してシスプラチンの一括投与が困難な場合にはカルボプラチン+エトポシド療法あるいはsplit PE療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:96%〕
-
a.1980年代以降CDDP+ETP(PE)療法は小細胞肺癌の治療に頻用され,海外の第Ⅲ相試験では年齢制限なく臨床試験が行われていることが多い。本邦では75歳未満のPS 0-3の小細胞肺癌(LD,EDを含む)に対しPE療法とCPA+DXR+VCR(CAV)療法とCAV/PE交代療法を比較する第Ⅲ相試験が行われ,PE療法とCAV/PE療法のORRがCAV療法より有意に高く(PE 78%,CAV/PE 76%,CAV 55%,P<0.005),毒性は許容範囲であった14)。
以上より,進展型小細胞肺癌(PS 0-2,71歳以上)に対して,CDDPの一括投与が可能な場合にはPE療法を行うよう推奨する。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 96% (22/23) |
4% (1/23) |
0% | 0% | 0% |
-
なお,CDDP+CPT-11(PI)療法に関して,71歳以上の高齢者の小細胞肺癌に対する本邦のエビデンスは現時点では存在しない。しかしながら,本邦で行われたPS 0-2のEDに対する第Ⅲ相試験の結果,PIがPEに比べ有意にOSを延長することが示されたこと3),ならびに本邦で行われた74歳までのPS 0-1の進行非小細胞肺癌を対象にCDDP+CPT-11,CDDP+GEM,CDDP+VNR,CBDCA+PTXの4群を比較する第Ⅲ相試験15)の結果より毒性は許容範囲であることから,実地臨床ではPIが74歳までのEDに使用されることもある。
-
b.本邦で,70歳以上のPS 0-2の高齢者および70歳未満のPS 3の患者を対象としたCBDCA+ETP(CE)療法とsplit PE(SPE療法:CDDP 3日間分割投与)との第Ⅲ相試験(JCOG9702試験)が行われ,CE群でGrade 3/4の血小板減少がより多く認められた(CE 56% vs SPE 16%,P<0.01)が,ORR(73% vs 73%),70歳以上かつPS 0-2のサブグループにおけるOS(中央値:10.8カ月vs 10.1カ月)はほぼ同様であった16)。
以上より,進展型小細胞肺癌(PS 0-2,71歳以上)に対して,CDDPの一括投与が困難な場合にはCE療法あるいはSPE療法を推奨する。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 96% (22/23) |
4% (1/23) |
0% | 0% | 0% |
CQ11.
進展型小細胞肺癌(PS 0-1)に対して,プラチナ製剤併用療法にPD-L1阻害薬の上乗せは勧められるか?
- 推 奨
- 進展型小細胞肺癌(PS 0-1)には,プラチナ製剤/エトポシド併用療法+PD-L1阻害薬の併用治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
PS 0-1のED症例を対象に,CBDCA+ETP(CE療法)+アテゾリズマブ(PD-L1阻害薬)後にアテゾリズマブ単剤での維持療法を行う群(併用群)とCE療法+プラセボ(プラセボ群)を比較する第Ⅲ相試験(IMpower133試験)が行われた17)。併用群はプラセボ群に対して,主要評価項目であるOSの有意な延長を認めた(HR 0.70,95%CI:0.54-0.91,P=0.007,中央値:12.3カ月vs 10.3カ月)。また,副次評価項目であるPFSについても有意な延長を認めた(HR 0.77,95%CI:0.62-0.96,P=0.02,中央値:5.2カ月vs 4.3カ月)。なお,本試験において用いられたプラチナ製剤はCBDCAであるが,プラセボ群のOS中央値は,既報告のCDDP+ETP(PE療法)における9.1カ月~10.3カ月3)~6)に劣らない結果であった。同試験の更新された報告によるOSはHR 0.76(95%CI:0.60-0.95)であり,18カ月OS率はアテゾリズマブ併用群で34.0%,プラセボ群で21.0%であった18)。毒性について,Grade 3以上の皮疹(2% vs 0%)やインフュージョンリアクション(2% vs 0.5%)などの免疫関連の毒性が併用群において増加する傾向であることには留意する必要がある。追加報告では,Grade 3以上の治療関連毒性(58.6% vs 57.6%),肺臓炎(2.5% vs 2.6%)であった。日本人集団の報告では,毒性に関して両群間で明らかな差は認められなかった19)。また,同試験においてアテゾリズマブ併用群でQOLの維持および一部の指標で改善が示された20)。
さらに,PS 0-1のED症例を対象に,プラチナ製剤併用療法〔CDDP+ETP(PE療法)またはCBDCA+ETP(CE療法)〕+デュルバルマブ(PD-L1阻害薬)後にデュルバルマブ単剤での維持療法を行う群(デュルバルマブ併用群),およびプラチナ製剤併用療法+デュルバルマブ(PD-L1阻害薬)+トレメリムマブ(CTLA-4阻害薬)後にデュルバルマブ単剤での維持療法を行う群(デュルバルマブ+トレメリムマブ併用群)の有用性を,プラチナ製剤併用療法(化学療法群)と比較する第Ⅲ相試験(CASPIAN試験)が行われた21)。OSの中間解析において,デュルバルマブ併用群は化学療法群に対して,主要評価項目であるOSの有意な延長を認めた(HR 0.73,95%CI:0.59-0.91,P=0.0047,中央値:13.0カ月vs 10.3カ月)。なお,副次評価項目であるPFSは,HR 0.73(95%CI:0.65-0.94,中央値:5.1カ月vs 5.4カ月)であった。同試験の更新された報告によるOSはHR 0.71(95%CI:0.60-0.86)であり,36カ月OS率はデュルバルマブ併用群で17.6%,化学療法群で5.8%であった22)。毒性について,甲状腺機能低下症(9% vs 1%)や甲状腺機能亢進症(5% vs 0%)などの免疫関連の毒性がデュルバルマブ併用群において増加する傾向であることには留意する必要がある。追加報告では,Grade 3以上の毒性(73% vs 65%),肺臓炎(5% vs 3%)であった。日本人集団の報告では,毒性に関して全体集団と同様の傾向であった23)。また,同試験においてデュルバルマブ併用群でQOLの維持および一部の指標で改善が示された24)。
以上より,進展型小細胞肺癌(PS 0-1)にはプラチナ製剤併用療法+PD-L1阻害薬の併用治療を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (26/26) |
0% | 0% | 0% | 0% |
なお,安全性の観点から現時点で前述したレジメン以外の併用療法は勧められない。詳細については,項末のレジメンを参照のこと。
CQ12.
進展型小細胞肺癌(PS 3)に対して,薬物療法は勧められるか?
- 推 奨
- 進展型小細胞肺癌(PS 3)に対して,カルボプラチン+エトポシド療法あるいはsplit PE療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:91%〕
海外で行われた,PS 3を含めた2つの第Ⅲ相試験25)26)(ただし,いずれもWHO PS 3)があり,PS 3に関しては小細胞肺癌に対する治療効果によってPSの改善が得られる可能性があれば薬物療法の対象になり得る。
本邦で,70歳以上のPS 0-2の高齢者および70歳未満のPS 3の患者を対象としたCBDCA+ETP(CE)療法とsplit PE(SPE療法:CDDP 3日間分割投与)との第Ⅲ相試験(JCOG9702試験)が行われ,CE群でGrade 3/4の血小板減少がより多く認められた(CE 56% vs SPE 16%,P<0.01)が,ORR(73% vs 73%),70歳未満のPS 3のサブグループ解析におけるOS(中央値:7.1カ月vs 6.9カ月)はほぼ同様であった16)。しかし,この試験におけるPS 3の登録は8%(18/220例)にとどまることは留意すべきである。
以上より,進展型小細胞肺癌(PS 3)に対してCE療法もしくはsplit PE療法を行うよう提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 91% (21/23) |
9% (2/23) |
0% | 0% |
CQ13.
進展型小細胞肺癌(PS 4)に対して,薬物療法は勧められるか?
- 推 奨
- 進展型小細胞肺癌(PS 4)に対して,薬物療法は行わないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:70%〕
PS 4を含めた第Ⅲ相試験26)はあるが,PS 4の割合は3%(9/339例)とごくわずかであり,かつ薬物療法同士の比較試験でありBSCとの比較試験ではない。したがって,この試験では薬物療法を勧められるかどうかのエビデンスにはならない。その他にPS 4を主たる対象とした前向き試験は行われておらず,むしろ毒性を考慮すべきPS 4に関するエビデンスはないのが現状である。
以上より,進展型小細胞肺癌(PS 4)に対して薬物療法は行わないよう提案する。エビデンスの強さはD,ただし総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 26% (6/23) |
70% (16/23) |
4% (1/23) |
- 1)
- Pujol JL, Carestia L, Daurès JP. Is there a case for cisplatin in the treatment of small-cell lung cancer? A meta-analysis of randomized trials of a cisplatin-containing regimen versus a regimen without this alkylating agent. Br J Cancer. 2000;83(1):8-15.
- 2)
- Baka S, Califano R, Ferraldeschi R, et al. Phase III randomised trial of doxorubicin-based chemotherapy compared with platinum-based chemotherapy in small-cell lung cancer. Br J Cancer. 2008;99(3):442-7.
- 3)
- Noda K, Nishiwaki Y, Kawahara M, et al. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer. N Engl J Med. 2002;346(2):85-91.
- 4)
- Hanna N, Bunn PA Jr, Langer C, et al. Randomized phase III trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer. J Clin Oncol. 2006;24(13):2038-43.
- 5)
- Lara PN Jr, Natale R, Crowley J, et al. Phase III trial of irinotecan/cisplatin compared with etoposide/cisplatin in extensive-stage small-cell lung cancer:clinical and pharmacogenomic results from SWOG S0124. J Clin Oncol. 2009;27(15):2530-5.
- 6)
- Zatloukal P, Cardenal F, Szczesna A, et al. A multicenter international randomized phase III study comparing cisplatin in combination with irinotecan or etoposide in previously untreated small-cell lung cancer patients with extensive disease. Ann Oncol. 2010;21(9):1810-6.
- 7)
- Kim DW, Kim HG, Kim JH, et al. Randomized phase III trial of irinotecan plus cisplatin versus etoposide plus cisplatin in chemotherapy-Naïve Korean patients with extensive-disease small cell lung cancer. Cancer Res Treat. 2019;51(1):119-27.
- 8)
- Jiang J, Liang X, Zhou X, et al. A meta-analysis of randomized controlled trials comparing irinotecan/platinum with etoposide/platinum in patients with previously untreated extensive-stage small cell lung cancer. J Thorac Oncol. 2010;5(6):867-73.
- 9)
- Lima JP, dos Santos LV, Sasse EC, et al. Camptothecins compared with etoposide in combination with platinum analog in extensive stage small cell lung cancer:systematic review with meta-analysis. J Thorac Oncol. 2010;5(12):1986-93.
- 10)
- Han D, Wang G, Sun L, et al. Comparison of irinotecan/platinum versus etoposide/platinum chemotherapy for extensive-stage small cell lung cancer:A meta-analysis. Eur J Cancer Care(Engl). 2017;26(6). e12723.
- 11)
- Satouchi M, Kotani Y, Shibata T, et al. Phase III study comparing amrubicin plus cisplatin with irinotecan plus cisplatin in the treatment of extensive-disease small-cell lung cancer:JCOG 0509. J Clin Oncol. 2014;32(12):1262-8.
- 12)
- Sun Y, Cheng Y, Hao X, et al. Randomized phase III trial of amrubicin/cisplatin versus etoposide/cisplatin as first-line treatment for extensive small-cell lung cancer. BMC Cancer. 2016;16:265.
- 13)
- Jiang L, Yang KH, Mi DH, et al. Safety of irinotecan/cisplatin versus etoposide/cisplatin for patients with extensive-stage small-cell lung cancer:a metaanalysis. Clin Lung Cancer. 2007;8(8):497-501.
- 14)
- Fukuoka M, Furuse K, Saijo N, et al. Randomized trial of cyclophosphamide, doxorubicin, and vincristine versus cisplatin and etoposide versus alternation of these regimens in small-cell lung cancer. J Natl Cancer Inst. 1991;83(12):855-61.
- 15)
- Ohe Y, Ohashi Y, Kubota K, et al. Randomized phase III study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer:Four-Arm Cooperative Study in Japan. Ann Oncol. 2007;18(2):317-23.
- 16)
- Okamoto H, Watanabe K, Kunikane H, et al. Randomised phase III trial of carboplatin plus etoposide vs split doses of cisplatin plus etoposide in elderly or poor-risk patients with extensive disease small-cell lung cancer:JCOG 9702. Br J Cancer. 2007;97(2):162-9.
- 17)
- Horn L, Mansfield AS, Szczęsna A, et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med. 2018;379(23):2220-9.
- 18)
- Liu SV, Reck M, Mansfield AS, et al. Updated overall survival and PD-L1 subgroup analysis of patients with extensive-stage small-cell lung cancer treated with atezolizumab, carboplatin, and etoposide(IMpower133). J Clin Oncol. 2021;39(6):619-30.
- 19)
- Nishio M, Sugawara S, Atagi S, et al. Subgroup analysis of japanese patients in a phase III study of atezolizumab in extensive-stage small-cell lung cancer(IMpower133). Clin Lung Cancer. 2019;20(6):469-76.e1.
- 20)
- Mansfield AS, Każarnowicz A, Karaseva N, et al. Safety and patient-reported outcomes of atezolizumab, carboplatin, and etoposide in extensive-stage small-cell lung cancer(IMpower133):a randomized phase I/III trial. Ann Oncol. 2020;31(2):310-7.
- 21)
- Paz-Ares L, Dvorkin M, Chen Y, et al. Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer(CASPIAN):a randomised, controlled, open-label, phase 3 trial. Lancet. 2019;394(10212):1929-39.
- 22)
- Goldman JW, Dvorkin M, Chen Y, et al. Durvalumab, with or without tremelimumab, plus platinum-etoposide versus platinum-etoposide alone in first-line treatment of extensive-stage small-cell lung cancer(CASPIAN):updated results from a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2021;22(1):51-65.
- 23)
- Hotta K, Nishio M, Saito H, et al. First-line durvalumab plus platinum-etoposide in extensive-stage small-cell lung cancer:CASPIAN Japan subgroup analysis. Int J Clin Oncol. 2021;26(6):1073-82.
- 24)
- Goldman JW, Garassino MC, Chen Y, et al. Patient-reported outcomes with first-line durvalumab plus platinum-etoposide versus platinum-etoposide in extensive-stage small-cell lung cancer(CASPIAN):a randomized, controlled, open-label, phase III study. Lung Cancer. 2020;149:46-52.
- 25)
- Souhami RL, Spiro SG, Rudd RM, et al. Five-day oral etoposide treatment for advanced small-cell lung cancer:randomized comparison with intravenous chemotherapy. J Natl Cancer Inst. 1997;89(8):577-80.
- 26)
- Girling DJ. Comparison of oral etoposide and standard intravenous multidrug chemotherapy for small-cell lung cancer:a stopped multicentre randomised trial. Medical Research Council Lung Cancer Working Party. Lancet. 1996;348(9027):563-6.
- レジメン
- 進展型小細胞肺癌
| CDDP+CPT-11療法 | CDDP | 60 mg/m2,day 1 | 4週毎 |
|---|---|---|---|
| CPT-11 | 60 mg/m2,day 1,8,15 | ||
| CDDP+ETP療法 | CDDP | 80 mg/m2,day 1 | 3週毎 |
| ETP | 100 mg/m2,day 1-3 | ||
| CBDCA+ETP療法 | CBDCA | AUC=5,day 1 | 3~4週毎 |
| ETP | 80 mg/m2,day 1-3 | ||
| CDDP+ETP療法 (CDDP分割) |
CDDP | 25 mg/m2,day 1-3 | 3~4週毎 |
| ETP | 80 mg/m2,day 1-3 |
| アテゾリズマブ併用 | CBDCA | AUC=5,day 1 | 3週毎 |
|---|---|---|---|
| ETP | 100 mg/m2,day 1-3 | ||
| アテゾリズマブ | 1200 mg/body,day 1 | ||
4サイクル終了後、増悪を認めなければアテゾリズマブの単剤投与を継続する。 |
|||
| デュルバルマブ併用 | CBDCA | AUC=5または6,day 1 | 3週毎 |
| ETP | 80-100 mg/m2,day 1-3 | ||
| デュルバルマブ | 1500 mg/body,day 1 | ||
4サイクル終了後、増悪を認めなければデュルバルマブの単剤投与を4週毎に継続する。 |
|||
| CDDP | 75-80 mg/m2,day 1 | 3週毎 | |
| ETP | 80-100 mg/m2,day 1-3 | ||
| デュルバルマブ | 1500 mg/body,day 1 | ||
4サイクル終了後、増悪を認めなければデュルバルマブの単剤投与を4週毎に継続する。 |
|||