Ⅱ.非小細胞肺癌(NSCLC)
7
Ⅳ期非小細胞肺癌
文献検索と採択
- 文献検索期間
-
- 2004年12月1日から2022年11月30日
- 文献検索方法
-
- キーワード:lung cancer, non-small cell lung cancer, chemotherapy
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2023年版改訂は,下記の検索式で2022年版以降の検索を行い,各CQにおいて採用を検討した。修正 #3
- 検索式(検索日:2023年1月12日)
-
#1 S *CARCINOMA, NON-SMALL-CELL LUNG+NT/CT(L)(TH OR DT)/CT AND (CARCINOMA, NON-SMALL-CELL LUNG+NT/CT(L)SC/CT OR NEOPLASM METASTASIS+NT/CT) #2 S *CARCINOMA, NON-SMALL-CELL LUNG+NT/CT(L)(TH OR DT)/CT AND (STAGE(2W)(IV# OR IV OR 4 OR 4A OR 4B) OR ADVANCE? OR PROGRES? OR METASTA?)/TI,AB #3 S ((NONSMALL? OR NON(W)SMALL)(3A)(LUNG OR PULMONARY)(3A)(CARCINOM? OR CANCER?) OR (LUNG OR PULOMONARY)(3A)(LARGE OR SQUAMOUS? OR ADENOCARCINOMA?) OR NSCLC)/TI AND (STAGE(2W)(IV# OR IV OR 4 OR 4A OR 4B) OR ADVANCE? OR PROGRESS? OR METASTA?)/TI AND (?THERAP? OR TREAT?)/TI #4 S #1 OR #2 OR #3 #5 S #4 AND ENGLISH/LA AND (2021-2023)/PY AND (20211201-20221130)/UP #6 S #5 AND (META-ANALYSIS/DT OR META-ANALYSIS AS TOPIC+NT/CT OR (METAANALYSIS OR META(W)ANALYSIS)/TI,AB) #7 S #5 AND (SYSTEMATIC REVIEW/DT OR SYSTEMATIC REVIEWS AS TOPIC+NT/CT OR SYSTEMATIC(W)REVIEW?/TI,AB) #8 S #5 AND (PRACTICE GUIDELINE/DT OR PRACTICE GUIDELINES AS TOPIC+NT/CT OR CONSENSUS+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCES AS TOPIC+NT/CT OR CONSENSUS DEVELOPMENT CONFERENCE/DT OR (GUIDELINE? OR CONSENSUS?)/TI) #9 S #5 AND (RANDOMIZED CONTROLLED TRIAL?/DT OR PRAGMATIC CLINICAL TRIAL/DT OR EQUIVALENCE TRIAL/DT OR RANDOMIZED CONTROLLED TRIALS AS TOPIC+NT/CT OR (RANDOM?/TI,AB NOT MEDLINE/FS) ) #10 S #5 AND (CLINICAL TRIAL/DT OR CLINICAL STUDY/DT OR CLINICAL TRIALS AS TOPIC+NT/CT OR CLINICAL(W)(TRIAL? OR STUD?) OR (CASE(W)(CONTROL? OR COMPARISON?)/TI,AB NOT MEDLINE/FS)) #11 S #5 AND (EPIDEMIOLOGIC STUDIES+NT/CT OR EPIDEMIOLOGIC RESEARCH DESIGN+NT/CT OR COMPARATIVE STUDY/DT OR MULTICENTER STUDY/DT OR MULTICENTER STUDIES AS TOPIC+NT/CT OR ((COHORT? OR COMPARATIVE? OR FOLLOWUP OR FOLLOW(W)UP OR MULTICENTER?)(3W)STUD?/TI,AB NOT MEDLINE/FS)) #12 S (#6 OR #7 OR #8 OR #9 OR #10 OR #11) #13 S #12 AND ((NONSMALL? OR NON(W)SMALL)(3A)(LUNG OR PULMONARY)(3A)(CARCINOM? OR CANCER?) OR (LUNG OR PULOMONARY)(3A)(LARGE OR SQUAMOUS? OR ADENOCARCINOMA?) OR NSCLC)/TI #14 S *CARCINOMA, NON-SMALL-CELL LUNG+NT/CT #15 S #12 AND #13 AND #14 #16 S #15/HUMAN OR (#15 NOT ANIMALS/CT)
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で本邦における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
- 原稿作成中に検索された2022年12月1日以降の文献も重要性を考慮したうえで適宜追加した。
本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | |
|---|---|---|
| CDDP | シスプラチン | |
| CPT-11 | イリノテカン | |
| DTX | ドセタキセル | |
| GEM | ゲムシタビン | |
| IFM | イホスファミド | |
| nab-PTX | ナブパクリタキセル | |
| NDP/CDGP | ネダプラチン | |
| PEM | ペメトレキセド | |
| PTX | パクリタキセル | |
| S-1 | テガフール・ギメラシル・オテラシルカリウム配合剤 | |
| VNR | ビノレルビン | |
| PD-1/PD-L1阻害薬 | ニボルマブ,ペムブロリズマブ,アテゾリズマブ,デュルバルマブの総称 | |
| CTLA-4阻害薬 | イピリムマブ,トレメリムマブの総称 | |
| 免疫チェックポイント阻害薬 | ニボルマブ,ペムブロリズマブ,アテゾリズマブ,デュルバルマブ,イピリムマブ,トレメリムマブの総称 | |
| プラチナ製剤 | CDDP,CBDCA,NDP/CDGPの総称 | |
| 第一・二世代のEGFR-TKI | ゲフィチニブ,エルロチニブ,アファチニブ,ダコミチニブの総称 | |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
|---|---|---|
| AST | aspartate aminotransferase | アスパラギン酸アミノトランスフェラーゼ |
| PD | progressive disease | 進行 |
| PR | partial response | 部分奏効 |
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| IC | tumor-infiltrating immune cells | 腫瘍浸潤免疫細胞 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PRO | patient reported outcome | 患者報告アウトカム |
| PS | performance status | 全身状態 |
| QOL | quality of life | 生活の質 |
| TC | tumor cells | 腫瘍細胞 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害薬 |
| TPS | tumor proportion score | PD-L1免疫染色による腫瘍細胞における陽性率 |
| Score | 定 義 |
|---|---|
| 0 | 全く問題なく活動できる。 発病前と同じ日常生活が制限なく行える。 |
| 1 | 肉体的に激しい活動は制限されるが,歩行可能で,軽作業や座っての作業は行うことができる。 例:軽い家事,事務作業 |
| 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。 日中の50%以上はベッド外で過ごす。 |
| 3 | 限られた自分の身の回りのことしかできない。 日中の50%以上をベッドか椅子で過ごす。 |
| 4 | 全く動けない。 自分の身の回りのことは全くできない。 完全にベッドか椅子で過ごす。 |
出典:Common Toxicity Criteria, Version2.0 Publish Date April 30, 1999
(JCOGホームページ.ガイドライン・各種規準より日本語訳を引用)
現在本邦では,高齢者人口の増加に伴い高齢の肺癌患者が増加している。全国がん登録による罹患データ(2019年)によると,肺癌の罹患年齢のピークは75~79歳であり,約半数が75歳以上である。本邦の従来の臨床試験では,75歳以上の肺癌患者は除外されることが多かった。近年実施された高齢肺癌患者を対象とする国内第Ⅲ相試験では,70歳以上を対象として実施されたものでも75歳以上の登録例が多く,75歳以上を対象として行われたものもあり,75歳以上の肺癌患者でも治療機会が増えている。
以上より,本ガイドラインでは非小細胞肺癌において「75歳以上」を高齢者と定義する。
肺癌診療ガイドラインでは,GRADEアプローチに基づく推奨度の決定を作成委員間の投票で行っている。投票結果に応じて推奨度を決定しており,そのうち最も投票率が高かった項目の割合を合意率としてCQ内に記載している。ただし,Ⅳ期非小細胞肺癌の領域に限っては,特にCQ47,64~67について,1つのCQに対し推奨度の異なる治療法が含まれるため合意率の記載のみでは投票結果を推奨度に反映できない。そのため,推奨率〔推奨1“強”+推奨2“弱”(提案)の割合〕を追記した。なお,投票結果の詳細はCQ毎に提示しているため詳細を確認いただきたい。
- 総 論
- Ⅳ期非小細胞肺癌における薬物療法の意義
Ⅳ期非小細胞肺癌で用いられる薬物療法においては,長らく細胞傷害性抗癌薬がその中心を担ってきた。細胞傷害性抗癌薬と緩和治療を比較したメタアナリシスによって,細胞傷害性抗癌薬を用いた治療により有意に生存を延長させることが示されている1)。これは1年OS率にして9%(20%から29%)の改善,もしくは約1.5カ月のOS延長に相当する。第三世代細胞傷害性抗癌薬を用いた検討では,第三世代細胞傷害性抗癌薬単剤療法でも緩和治療に比して1年OS率で約7%の改善効果が示されている2)。毒性については,別のメタアナリシスで進行非小細胞肺癌における細胞傷害性抗癌薬の治療関連死が1.26%であったと報告されており,その内訳は発熱性好中球減少,虚血や血栓などの心血管系の毒性,肺炎や間質性肺疾患などの肺毒性であった3)。QOLに関しては,第三世代細胞傷害性抗癌薬単剤は緩和治療と比較してQOLを改善させることが報告されている4)。また,第三世代細胞傷害性抗癌薬にプラチナ製剤を追加する治療を行うことの意義を評価した第Ⅲ相試験では,プラチナ製剤と第三世代細胞傷害性抗癌薬を使用した治療がOS・PFS延長を示すと同時にQOLは同等であったと報告されている5)。
一方,2000年代以降になって分子標的治療薬・免疫チェックポイント阻害薬といった新規治療が登場し,これらは細胞傷害性抗癌薬との比較によってその有効性を示している。
分子標的治療薬の多くはEGFR遺伝子変異,ALK融合遺伝子などといった癌発生の直接的な原因となるようなドライバーと称される遺伝子変異/転座に対する阻害薬である。全身状態良好で,これらドライバー遺伝子の変異/転座を有する患者に対して,各ドライバー遺伝子に対する標的療法を行うことでORRの増加,PFSの延長などの有効性が報告されている。EGFR遺伝子変異,ALK融合遺伝子では細胞傷害性抗癌薬と比較した第Ⅲ相試験が実施され,標的となるキナーゼ阻害薬を用いた治療のほうが細胞傷害性抗癌薬に比して有効であることが報告されている(BQ1, 2)。なお,EGFR遺伝子変異,ALK融合遺伝子については,キナーゼ阻害薬同士の比較やキナーゼ阻害薬と他治療との併用の比較がなされており,それらの比較試験で優越性が示された治療法が主に勧められる(CQ47,54)。頻度の少ないEGFRのuncommon mutation,その他のドライバー遺伝子(ROS1,BRAF,MET,RET,NTRK,HER2)変異/転座陽性例では細胞傷害性抗癌薬と比較した第Ⅲ相試験が実施されていないが,第Ⅱ相試験などではそれぞれの阻害薬を投与することによって同程度の高い有効性が報告されている(CQ50,57~61,63)。また多くの分子標的治療薬は一般的に細胞傷害性抗癌薬よりも毒性が軽度であることが多く,少数例の検討ながらPS不良例における前向き試験での有効性が報告されている点も重要である(CQ49,55)。なお,標的療法の適応となるドライバー遺伝子変異/転座陽性例は腺癌症例に多く認められるが,扁平上皮癌症例やその他の組織型においても認められる。
2015年以降,本邦で使用可能となった免疫チェックポイント阻害薬は,細胞傷害性抗癌薬や分子標的治療薬と異なる作用機序を有する新規薬で,腫瘍免疫における負の調節因子であるPD-1/PD-L1やCTLA-4などの免疫チェックポイント分子を標的とした抗体薬である。EGFR遺伝子変異,ALK融合遺伝子を有さない,PD-L1 TPSが50%以上のⅣ期非小細胞肺癌を対象としたPD-1阻害薬(ペムブロリズマブ)とプラチナ製剤併用療法の第Ⅲ相試験(KEYNOTE-024試験)では,ペムブロリズマブ群においてORR,PFS,OSの有意な改善が示され,毒性も忍容可能であった。さらに,PD-L1を問わないⅣ期非小細胞肺癌を対象としてプラチナ製剤併用療法にPD-1/PD-L1阻害薬やCTLA-4阻害薬を併用した治療を評価した複数の第Ⅲ相試験では,免疫チェックポイント阻害薬を併用することによってプラチナ製剤併用療法と比較しOSの有意な延長が示されている。
以上,全身状態良好なⅣ期非小細胞肺癌患者に対しては薬物療法(細胞傷害性抗癌薬,分子標的治療薬,免疫チェックポイント阻害薬)がOSを延長し,QOLも改善することが示されている。治療方針の決定に際して,まず腫瘍におけるドライバー遺伝子変異/転座の有無を検索し,陽性であった場合には各ドライバー遺伝子に対する標的療法を適切なタイミングで検討することが重要である。一方,ドライバー遺伝子変異/転座が陰性であった場合には,免疫チェックポイント阻害薬の投与を避けるべき症例を除いて免疫チェックポイント阻害薬を含む治療を検討する。
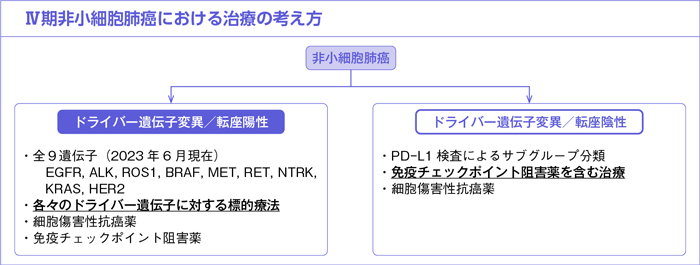
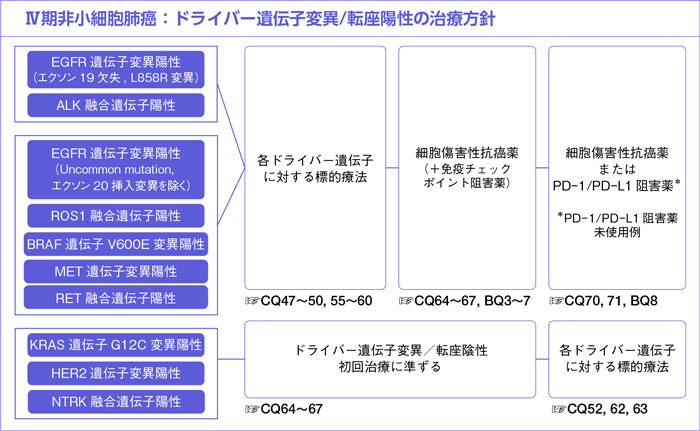
ドライバー遺伝子変異/転座陽性例では前述したようにそれぞれのドライバー遺伝子に対する標的療法によってORR,PFSの改善が報告されている。なおこれらの第Ⅲ相試験では,プラチナ製剤併用療法の後治療として各ドライバー遺伝子に対する標的療法へのクロスオーバーが高率に行われたために,OSの有意な差は示されていない。米国で行われた前向き観察研究において,733例を対象に10個のドライバー遺伝子を検索したところ,466例(64%)にドライバー遺伝子変異/転座を認めた。生存解析において,ドライバー遺伝子変異/転座陽性例のうち標的療法を実施した260例のOS中央値は3.5年であったのに対し,標的療法を実施しなかった症例のOS中央値は2.4年であった(propensity score-adjusted hazard ratio:0.69,95%CI:0.53-0.9,P=0.006)6)。そのため,ドライバー遺伝子変異/転座陽性例において各ドライバー遺伝子に対する標的療法の投与機会を逸しないことが重要である。なお,本ガイドラインにおけるドライバー遺伝子変異/転座は,現時点で治療標的となる薬剤が承認されている以下の遺伝子異常(EGFR遺伝子変異,ALK融合遺伝子,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異,RET融合遺伝子,NTRK融合遺伝子,KRAS遺伝子変異,HER2遺伝子変異)と定義する。
75歳以上のドライバー遺伝子変異/転座陽性例において,各ドライバー遺伝子に対する標的療法の意義を検討したエビデンスは限られている。75歳以上のEGFR遺伝子変異陽性進行非小細胞肺癌を対象とした国内でのゲフィチニブ単剤の第Ⅱ相試験(NEJ003試験)において,ORR 74%,PFS中央値12.3カ月と若年者と同等の有効性と安全性が報告されている7)。その他のドライバー遺伝子変異/転座陽性例においても,一般に各ドライバー遺伝子に対する標的療法は毒性が細胞傷害性抗癌薬と比べて軽い場合が多く,高齢者に対しても比較的安全に使用できると想定される。
ドライバー遺伝子変異/転座陽性例に対しこれまでに行われた第Ⅲ相試験では,多くの症例が標的療法の前後で細胞傷害性抗癌薬の投与を受けていた。後解析ではあるが,これらの第Ⅲ相試験において細胞傷害性抗癌薬を投与されている患者の予後が良い傾向にあり8)9),本邦の大規模観察研究においても同様の傾向が認められている10)。すなわち,各ドライバー遺伝子に対する標的療法に増悪後の二次治療では,全身状態に応じて細胞傷害性抗癌薬が勧められる。二次治療以降で各標的療法が使用可能なドライバー遺伝子(NTRK融合遺伝子,KRAS遺伝子変異,HER2遺伝子変異)に関しての一次治療は,ドライバー遺伝子変異/転座陰性例の初回治療に準ずる(CQ64~67)。EGFR遺伝子変異陽性例に対する免疫チェックポイント阻害薬についてはCQ52,53を参照のこと。
2)ドライバー遺伝子変異/転座陰性例:CQ64~67
Ⅳ期非小細胞肺癌を対象とした複数の第Ⅲ相試験において,免疫チェックポイント阻害薬を含む治療はプラチナ製剤併用療法と比較しOSを有意に延長させることが示されている。なお,それらの第Ⅲ相試験ではEGFR遺伝子変異およびALK融合遺伝子陽性例は適格基準もしくは解析対象集団から除外されることが多かったが,それ以外のドライバー遺伝子変異/転座陽性例は解析に含まれていた可能性があることに注意が必要である。
ドライバー遺伝子変異/転座陰性例の治療法を決定/選択するにあたっては,PD-L1検査を行うことが有用である。腫瘍細胞におけるPD-L1発現によって免疫チェックポイント阻害薬の効果が異なる薬剤もあることから,①PD-L1 TPS 50%以上,②PD-L1 TPS 1~49%,③PD-L1 TPS 1%未満,の3つのサブグループに分類する。
PD-L1 TPS 50%以上例は,PD-1/PD-L1阻害薬のみで高い臨床効果が期待できるサブグループであり,初回治療としてペムブロリズマブ単剤療法もしくはアテゾリズマブ単剤療法(SP142 TC3またはIC3に限る)を行うよう勧められる。また,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療も勧められる(CQ63)。
PD-L1 TPS 1~49%は,一次治療において免疫チェックポイント阻害薬単独療法が細胞傷害性抗癌薬よりも有効であることは示されていない。一方で,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療,PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療は,プラチナ製剤併用療法のみと比較し生存を延長する傾向が示されている。免疫チェックポイント阻害薬による治療が可能な症例は,免疫チェックポイント阻害薬を含むいずれかの治療法が勧められる(CQ65)。
PD-L1 TPS 1%未満例は,一次治療においてPD-1/PD-L1阻害薬単剤療法の適応がない。プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療,PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療,ニボルマブ+イピリムマブ併用療法のいずれかが勧められる(CQ66)。
- 1)
- Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010;(5):CD007309.
- 2)
- Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer:a meta-analysis. J Thorac Oncol. 2007;2(9):845-53.
- 3)
- Fujiwara Y, Hotta K, Di Maio M, et al. Time trend in treatment-related deaths of patients with advanced non-small-cell lung cancer enrolled into phase III trials of systemic treatment. Ann Oncol. 2011;22(2):376-82.
- 4)
- Anderson H, Hopwood P, Stephens RJ, et al. Gemcitabine plus best supportive care(BSC)vs BSC in inoperable non-small cell lung cancer--a randomized trial with quality of life as the primary outcome. UK NSCLC Gemcitabine Group. Non-Small Cell Lung Cancer. Br J Cancer. 2000;83(4):447-53.
- 5)
- Sederholm C, Hillerdal G, Lamberg K, et al. Phase III trial of gemcitabine plus carboplatin versus single-agent gemcitabine in the treatment of locally advanced or metastatic non-small-cell lung cancer:the Swedish Lung Cancer Study Group. J Clin Oncol. 2005;23(33):8380-8.
- 6)
- Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014;311(19):1998-2006.
- 7)
- Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations:NEJ 003 study. J Thorac Oncol. 2012;7(9):1417-22.
- 8)
- Yoshioka H, Shimokawa M, Seto T, et al. Final overall survival results of WJTOG3405, a randomized phase III trial comparing gefitinib versus cisplatin with docetaxel as the first-line treatment for patients with stage IIIB/IV or postoperative recurrent EGFR mutation-positive non-small-cell lung cancer. Ann Oncol. 2019;30(12):1978-84.
- 9)
- Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naive non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002). Ann Oncol. 2013;24(1):54-9.
- 10)
- Inoue A, Yoshida K, Morita S, et al. Characteristics and overall survival of EGFR mutation-positive non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors:a retrospective analysis for 1660 Japanese patients. Jpn J Clin Oncol. 2016;46(5):462-7.
- 7-1
- ドライバー遺伝子変異/転座陽性
樹形図
7-1-1.EGFR遺伝子変異陽性
樹形図
EGFR遺伝子変異陽性の一次治療:エクソン19欠失またはL858R変異陽性
CQ47.
PS 0-1の場合,一次治療として薬物療法が勧められるか?*
- 推 奨
-
- a.
- オシメルチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:93%(推奨率:100%)〕
-
- b.
- ゲフィチニブ+カルボプラチン+ペメトレキセド併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:79%(推奨率:96%)〕
-
- c.
- エルロチニブに血管新生阻害薬を併用した治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:86%(推奨率:90%)〕
-
- d.
- ダコミチニブ単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:86%(推奨率:86%)〕
-
a.EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性,PS 0-1のⅣ期非小細胞肺癌患者を対象として,オシメルチニブ単剤療法と第一世代EGFR-TKI単剤療法(ゲフィチニブまたはエルロチニブ)を比較する第Ⅲ相試験(FLAURA試験)が行われ,主要評価項目であるPFSはHR 0.46(95%CI:0.37-0.57,P<0.001,中央値:18.9カ月vs 10.2カ月)と有意に延長することが示され1),OSに関してもHR 0.80(95.05%CI:0.64-1.00,P=0.046,中央値:38.6カ月vs 31.8カ月)と有意に延長することが示された2)。なお,PFSはサブグループ別の差異を認めなかったが,OSのサブグループ解析では,アジア人やL858R変異の集団において,それぞれのOS-HRが1.00(95%CI:0.75-1.32),1.00(95%CI:0.71-1.40)という結果であった。その後,中国で同様のデザインの第Ⅲ相試験(FLAURA China試験)が行われ,同試験においても主要評価項目であるPFSはHR 0.56(95%CI:0.37-0.85,P=0.007,中央値:17.8カ月vs 9.8カ月)と有意に延長することが示された3)。また毒性においても,第一世代EGFR-TKI単剤療法では下痢57%,ざ瘡様皮疹48%,AST上昇25%,間質性肺炎2%に対し,オシメルチニブ単剤療法では下痢58%,ざ瘡様皮疹25%,AST上昇9%,間質性肺炎4%であり,皮疹,肝機能障害に関してはオシメルチニブのほうが軽い傾向がみられた2)。本試験の日本人集団においては間質性肺炎がオシメルチニブ単剤療法では12.3%(8例/65例),ゲフィチニブ単剤療法では1.8%(1例/55例)と報告されており,全体集団に比して高率であった4)。
以上より,治療効果と毒性のバランスを考慮し,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはオシメルチニブ単剤療法を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (26/28) |
7% (2/28) |
0% | 0% | 0% |
-
b.ゲフィチニブ+CBDCA+PEM併用療法とゲフィチニブ単剤療法の第Ⅲ相試験(NEJ009試験)で,主要評価項目の1つであるPFSはHR 0.49(95%CI:0.39-0.62,P<0.01,中央値:20.9カ月vs 11.9カ月)であったが,PFS2*においてはHR 0.99(95%CI:0.78-1.25,P=0.90,中央値:20.9カ月vs 20.7カ月)と両群間で有意差を認めなかった(*PFS2は,ゲフィチニブ単剤療法群において,ゲフィチニブでPDになった後の次治療でPDになるまでの期間と,ゲフィチニブ+CBDCA+PEM併用療法でPDになるまでの期間の比較)。OSの解析においては探索的検討ではあるが,HR 0.722(中央値:50.9カ月vs 38.8カ月)という結果であった。毒性については,併用群でGrade 3以上の血液毒性の頻度が高く,好中球減少(31.2% vs 0.6%),貧血(21.2% vs 2.3%),血小板減少(17.1% vs 0%)であった5)。なお,海外で実施された同じデザインの第Ⅲ相試験では,主要評価項目であるPFSはHR 0.51(95%CI:0.39-0.66,P<0.001,中央値:16カ月vs 8カ月)であり,OSにおいてもHR 0.45(95%CI:0.31-0.65,P<0.001,中央値:未到達vs 17カ月)と併用群において有意な延長がみられた。毒性については,Grade 3以上の毒性が併用群で高く(51% vs 25%),血液毒性,腎障害,低カリウム血症の頻度が高かった6)。
以上より,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはゲフィチニブ+CBDCA+PEM併用療法を行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 18% (5/28) |
79% (22/28) |
0% | 0% | 4% (1/28) |
-
c.エルロチニブと血管新生阻害薬の併用療法については,複数の試験が行われている。
エルロチニブ+ベバシズマブの併用療法とエルロチニブ単剤療法のランダム化第Ⅱ相試験は2編報告されている。本邦で行われたJO25567試験では,主要評価項目であるPFSがHR 0.54(95%CI:0.36-0.79,P=0.0015,中央値:16.0カ月vs 9.7カ月)と有意差が認められ7),OSではHR 0.81(95%CI:0.53-1.23,中央値:47.0カ月vs 47.4カ月)であった8)。一方,米国で行われたランダム化第Ⅱ相試験では,主要評価項目であるPFSはHR 0.81(95%CI:0.50-1.31,P=0.39,中央値:17.9カ月vs 13.5カ月)と有意な延長が示されず,OSではHR 1.41(95%CI:0.72-2.81,中央値:32.4カ月vs 50.6カ月)と上乗せ効果が乏しい傾向がみられた9)。同じデザインで行われた本邦の第Ⅲ相試験(NEJ026試験)では,主要評価項目であるPFSはHR 0.605(95%CI:0.417-0.877,P=0.01573,中央値:16.9カ月vs 13.3カ月)とエルロチニブ単剤療法に対しPFSを有意に延長することが示された10)が,OSはHR 1.007(95%CI:0.68-1.49)であった11)。その後,中国およびイタリアで同様のデザインの第Ⅲ相試験(CTONG1509試験,REVERLY試験)が行われ,主要評価項目であるPFSはそれぞれHR 0.55(95%CI:0.41-0.75,P=0.01573,中央値:17.9カ月vs 11.2カ月),HR 0.66(95%CI:0.47-0.92,P=0.015,中央値:15.4カ月vs 9.6カ月)であり,NEJ026試験と同様にエルロチニブ単剤療法に対しPFSを有意に延長することが示された12,13)。毒性については,併用群でベバシズマブ関連の有害事象が認められた(Grade 3以上の高血圧が9%,蛋白尿が32%,出血性事象が26%など)10)。
エルロチニブ+ラムシルマブ併用療法とエルロチニブ+プラセボ療法を比較した第Ⅲ相試験(RELAY試験)では,主要評価項目であるPFSがHR 0.59(95%CI:0.46-0.79,P<0.0001,中央値:19.4カ月vs 12.4カ月)と有意に延長することが示された。毒性については,ラムシルマブ併用群で特有の有害事象が認められており(Grade 3以上の高血圧が24%),その他Grade 3以上の下痢(7% vs 1%),ざ瘡様皮疹(15% vs 9%)が認められた14)。日本人集団の報告では,毒性の頻度は全体集団と同様であった15)。また,QOL指標は両群で差は認められなかった16)。
以上より,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはエルロチニブに血管新生阻害薬を併用した治療を行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/28) |
86% (24/28) |
4% (1/28) |
4% (1/28) |
4% (1/28) |
-
d.EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ダコミチニブ単剤療法とゲフィチニブ単剤療法を比較する第Ⅲ相試験(ARCHER1050試験)が行われ,主要評価項目であるPFSはHR 0.59(95%CI:0.47-0.74,P<0.0001,中央値:14.7カ月vs 9.2カ月)と,ダコミチニブ単剤療法はゲフィチニブ単剤療法に対しPFSを有意に延長することが示された17)。OSは探索的検討ではあるが,HR 0.76(95%CI:0.582-0.993,中央値:34.1カ月vs 26.8カ月)という結果であった18)。しかし,ゲフィチニブ単剤療法では下痢56%,爪囲炎20%,ざ瘡様皮疹29%に対し,ダコミチニブ単剤療法では下痢87%,爪囲炎62%,ざ瘡様皮疹49%であり,毒性においてはダコミチニブ単剤療法で頻度が高かった。日本人集団の報告では毒性の頻度が増えるものの,全体集団と同様であった19)。また,QOL指標は両群で差は認められなかった20)。
以上より,治療効果と毒性のバランスを考慮し,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはダコミチニブ単剤療法を行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 86% (24/28) |
11% (3/28) |
0% | 4% (1/28) |
CQ48.
PS 2の場合,一次治療として薬物療法が勧められるか?
- 推 奨
-
- a.
- EGFR-TKI単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:86%〕
-
- b.
- ゲフィチニブ+カルボプラチン+ペメトレキセド併用療法を行うよう勧めるだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
-
a.EGFR遺伝子変異陽性の進行非小細胞肺癌を対象としたエルロチニブ単剤療法とプラチナ製剤併用療法の2つの第Ⅲ相試験において,PS 2は各々7%,14%含まれておりPS 0-1と同等の有効性が示されている21)22)。また,ゲフィチニブ単剤療法はPS不良例に対する有効性が報告されている23)24)。アファチニブ単剤療法,ダコミチニブ単剤療法に関しては,PS 2に対する安全性と有効性の検討は十分ではない17)25)26)。オシメルチニブ単剤療法についても,PS 2に対する有効性の検討は十分ではないが,ゲフィチニブ単剤療法やエルロチニブ単剤療法と比較しても間質性肺疾患以外の毒性は軽度であり,使用を考慮し得る1)。
以上より,PS 2の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としては,毒性を考慮したうえで,EGFR-TKI単剤療法が勧められる。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 86% (24/28) |
14% (4/28) |
0% | 0% | 0% |
-
b.海外で実施されたゲフィチニブ+CBDCA+PEM併用療法とゲフィチニブ単剤療法の第Ⅲ相試験において,PS 2は21~22%含まれており,探索的な解析においてPFSのHRは0.57(95%CI:0.33-0.98)で,併用群において良い傾向が示された6)。一方で,Grade 3以上の毒性の頻度は,併用群で58%,単剤群で28%であり,併用群で毒性の頻度が有意に高いことが報告されている27)。なお,前述した試験は海外の単施設で実施されたものであり,バイアスリスクが高く結果に影響を与えている可能性があり,本試験の結果を本邦の日常診療に反映することが可能か小委員会の中でも意見が分かれた。
協議の結果,PS 2の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療において,ゲフィチニブ+CBDCA+PEM併用療法の投与の可否を判断するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 46% (13/28) |
39% (11/28) |
14% (4/28) |
0% |
CQ49.
PS 3-4の場合,一次治療としてEGFR-TKIが勧められるか?
- 推 奨
- ゲフィチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:75%〕
EGFR遺伝子高感受性変異陽性でPS 3-4が大多数を占める予後不良群を対象としてゲフィチニブの投与を評価する第Ⅱ相試験(NEJ001試験)が行われ,約80%の患者でPSが改善し,ORR 66%,OS中央値17.8カ月,PFS中央値6.5カ月と極めて良好な治療効果が得られた23)。一方,PS不良,男性,喫煙歴,既存の間質性肺炎,正常肺領域が少ない患者,心疾患を合併した患者などで間質性肺疾患発症のリスクが高いことが報告されており28)29),慎重な検討も必要である。なお,ガイドライン検討委員会薬物療法及び集学的治療小委員会では,特にPS 4に対する投与の是非について議論がなされた。このような集団においては益の評価項目としてPSや症状の改善は重要であり,EGFR-TKI単剤療法によってこれらの改善が期待されるものであるのかを十分吟味する必要がある。
以上より,PS 3-4の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としては,ゲフィチニブ単剤療法が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 75% (18/24) |
25% (6/24) |
0% | 0% | 0% |
EGFR遺伝子変異陽性の一次治療:エクソン18-21変異(エクソン19欠失・L858R変異を除く)
CQ50.
エクソン18-21変異:Uncommon mutationに対して,一次治療でEGFR-TKIは勧められるか?
- 推 奨
-
- a.
- エクソン18-21の遺伝子変異(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)にはEGFR-TKI単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:78%〕
-
- b.
- エクソン20の挿入変異にはEGFR-TKI療法を行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:70%〕
-
- c.
- EGFR-TKI未治療のT790M変異にオシメルチニブ単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:67%〕
※EGFR遺伝子変異の種類,検査法などの詳細については日本肺癌学会ホームページ「肺癌患者におけるEGFR遺伝子変異検査の手引き」を参照。
※Uncommon mutationがある場合は,エクソン19の欠失とL858R変異が同時にあったとしても,uncommon mutationに分類する。
-
a.EGFR遺伝子変異の約90%をエクソン19の欠失変異,エクソン21のL858R変異が占める。その他の遺伝子変異はuncommon mutationと称され,エクソン18-21にわたり(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)が報告されている30)。これらの変異でもEGFR-TKIの感受性を有する変異はあるが,ORRはやや劣ると報告されている31)。また,過去の第Ⅲ相試験の多くは,これらの変異が除外されているか,含まれたとしても全体の1割程度にすぎない。
T790M変異とエクソン20の挿入変異以外のuncommon mutationでは,EGFR-TKI単剤療法の効果が報告されている。ゲフィチニブ単剤療法,エルロチニブ単剤療法の後方視的検討では,ORRは48.4%,PFS中央値は5.0カ月31),アファチニブ単剤療法の3つの前向き試験のプール解析では,ORRは71.1%,PFS中央値は10.7カ月と報告されている32)。また,海外で実施されたuncommon mutationに対するオシメルチニブ単剤療法の第Ⅱ相試験(KCSG-LU15-09試験)では,ORRは50%,PFS中央値は8.2カ月であった33)。ただし,それぞれの報告でuncommon mutationの頻度や治療効果が異なっていることから,これらの結果をもとに各EGFR-TKIを比較することは根拠に乏しいと考えられる。
以上より,エクソン18-21の遺伝子変異(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)陽性例に対しては,ゲフィチニブ,エルロチニブ,アファチニブ,オシメルチニブのいずれかのEGFR-TKI単剤療法が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 22% (6/27) |
78% (21/27) |
0% | 0% | 0% |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 4% (1/27) |
0% | 26% (7/27) |
70% (19/27) |
-
c.EGFR-TKIによる治療の前にT790M変異陽性の患者の報告は少なく,前述のFLAURA試験でもT790M変異を認めたのは556例中5例のみであった。なお,オシメルチニブ単剤療法の第Ⅰ相試験では未治療のT790M変異陽性の患者7例中6例でPRを認めている36)。EGFR-TKI未治療のT790M変異に対するデータは限られているが,既治療のT790M変異陽性に対するオシメルチニブ単剤療法の効果は第Ⅲ相試験でも示されており,未治療例においても効果が期待できると考えられる。
以上より,EGFR-TKI未治療のT790M変異陽性例に対しては,オシメルチニブ単剤療法が勧められる。エビデンスの強さはD,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/27) |
67% (18/27) |
30% (8/27) |
0% | 0% |
EGFR遺伝子変異陽性の二次治療以降
CQ51.
一次治療EGFR-TKI*耐性または増悪後のT790M変異陽性例に対してEGFR-TKIは勧められるか?
- 推 奨
- オシメルチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
*オシメルチニブを一次治療で用いた場合には当該CQには当てはまらない。
※T790M変異陰性もしくは不明の場合,「ドライバー遺伝子変異/転座陰性」に準じて細胞傷害性抗癌薬を用いた治療(CQ64~66)が勧められる。
オシメルチニブは,活性型EGFR遺伝子変異と耐性変異であるEGFR T790M変異の両方を阻害する第三世代EGFR-TKIである。第一・二世代のEGFR-TKIによる治療の後にT790M変異陽性となった患者を対象にオシメルチニブ単剤療法とプラチナ製剤併用療法(CDDPまたはCBDCA+PEM療法)を比較した第Ⅲ相試験(AURA3試験)が報告された37)。主要評価項目であるPFSのHRは0.30(95%CI:0.23-0.41,P<0.001,中央値:10.1カ月vs 4.4カ月)であった。OSのHRは0.87(95%CI:0.67-1.12,中央値:26.8カ月vs 22.5カ月)であった38)。Grade 3以上の毒性の頻度は,オシメルチニブ単剤療法群のほうが低かった(6%vs 34%)37)。また本邦において,T790M変異陽性となったPS不良(PS 2-4)患者を対象としたオシメルチニブ単剤療法の効果と安全性を検証する単群第Ⅱ相試験が行われた。主要評価項目であるPFSの中央値は7.0カ月,OSの中央値は12.7カ月であり,72%の患者でPSの改善を認めた。Grade 3以上の毒性の頻度は以前の報告と同様だったが,16.6%(3例)で間質性肺炎を認めた39)。また,同様のデザインで行われた単群第Ⅱ相試験(NEJ032B試験)では,主要評価項目であるORRは53.1%,PFSの中央値は5.1カ月,OSの中央値は10.0カ月であった。間質性肺炎が15.2%(5例),そのうちGrade 3以上のものが6.1%(2例)で認められた40)。
以上より,一次治療EGFR-TKI耐性または増悪後のT790M変異陽性例に対しては,オシメルチニブ単剤療法が勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (26/26) |
0% | 0% | 0% | 0% |
CQ52.
一次治療EGFR-TKI*耐性または増悪後例に二次治療で細胞傷害性抗癌薬と免疫チェックポイント阻害薬を併用した治療は勧められるか?
- 推 奨
- 一次治療EGFR-TKI*耐性または増悪後例に二次治療で細胞傷害性抗癌薬と免疫チェックポイント阻害薬を併用した治療を行うよう勧めるだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
*オシメルチニブを一次治療で用いていない場合,および一次治療EGFR-TKI耐性後T790M変異陽性の二次治療では,当該CQは当てはまらない。
※EGFR遺伝子変異陽性例を含む試験が実施されたのは現時点でアテゾリズマブを併用した試験のみである。
一次治療における非扁平上皮非小細胞肺癌に対する,CBDCA+PTX+ベバシズマブ+アテゾリズマブ療法とCBDCA+PTX+ベバシズマブ療法を比較した第Ⅲ相試験(IMpower150試験)のEGFR遺伝子変異陽性のサブグループ解析において,OSのHR 0.61(95%CI:0.29-1.28,中央値:未到達vs 18.7カ月),PFSのHR 0.61(95%CI:0.36-1.03,中央値:10.2カ月vs 6.9カ月)とアテゾリズマブ併用群が良好な傾向を示した41)。さらに活性型EGFR遺伝子変異(エクソン19欠失・L858R変異)のみを対象としたEGFR-TKI治療後の患者におけるOSの更新された解析では,OSのHR 0.74(95%CI:0.38-1.46,中央値:29.4カ月vs 18.1カ月)と良好な傾向を示した42)。しかし,このサブグループ解析はプロトコールであらかじめ予定されていた解析ではなく,EGFR遺伝子変異の有無が割付調整因子に設定されていないなど,解釈には注意が必要である。また,非扁平上皮非小細胞肺癌に対するCBDCA+nab-PTX+アテゾリズマブ療法とCBDCA+nab-PTX療法を比較した第Ⅲ相試験(IMpower130試験)のEGFR遺伝子変異もしくはALK融合遺伝子陽性のサブグループ解析において,PFSのHR 0.75(95%CI:0.36-1.54,中央値:7.0カ月vs 6.0カ月),OSのHR 0.98(95%CI:0.41-2.31,中央値:14.4カ月vs 10.0カ月)であった43)。上記試験においてEGFR遺伝子変異陽性では一次治療としてEGFR-TKIの治療歴のある患者が対象とされており,二次治療の患者が登録されている。
いずれも探索的なサブグループ解析のみであり,現時点では,一次治療EGFR-TKI耐性または増悪後例に二次治療で細胞傷害性抗癌薬と免疫チェックポイント阻害薬を併用した治療を行うよう勧めるだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 52% (14/27) |
30% (8/27) |
19% (5/27) |
0% |
CQ53.
EGFR遺伝子変異陽性例に免疫チェックポイント阻害薬単独療法は勧められるか?
- 推 奨
- EGFR遺伝子変異陽性例に免疫チェックポイント阻害薬単独療法を行うよう勧めるだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
非小細胞肺癌の一次治療において,EGFR遺伝子変異陽性,かつPD-L1陽性例を対象としたペムブロリズマブの有効性を評価する第Ⅱ相試験が行われた。中間解析において10例中のORRは0%であり,早期での無効中止となっており有効性は示されなかった44)。非小細胞肺癌の二次治療において,免疫チェックポイント阻害薬(ニボルマブ,ペムブロリズマブ,アテゾリズマブ)とDTXの比較第Ⅱ/Ⅲ相試験を統合解析した報告の中で,EGFR遺伝子変異陽性例における免疫チェックポイント阻害薬のDTXに対するOSはHR 1.11(95%CI:0.80-1.53,P=0.54)であり,免疫チェックポイント阻害薬を用いた治療は全体集団では有効性が示されているもののEGFR遺伝子変異陽性例において優れているという結果は示されていない45)。このため,EGFR遺伝子変異陽性の患者に対する免疫チェックポイント阻害薬単独療法の効果は,EGFR遺伝子変異陰性の患者と比べて低い可能性がある。治療ラインとして一次治療,二次治療において,免疫チェックポイント阻害薬単独療法は,現時点で明確な有効性は示されていない。
一方,それ以降の治療ラインでの使用の可否に関しても議論がなされたが,本CQにおいて,EGFR遺伝子変異陽性例の患者における免疫チェックポイント阻害薬単独療法の投与の可否を判断するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 14% (4/29) |
48% (14/29) |
31% (9/29) |
7% (2/29) |
- 1)
- Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113-25.
- 2)
- Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med. 2020;382(1):41-50.
- 3)
- Cheng Y, He Y, Li W, et al. Osimertinib versus comparator EGFR TKI as first-line treatment for EGFR-mutated advanced NSCLC:FLAURA China, a randomized study. Target Oncol. 2021;16(2):165-76.
- 4)
- Ohe Y, Imamura F, Nogami N, et al. Osimertinib versus standard-of-care EGFR-TKI as first-line treatment for EGFRm advanced NSCLC:FLAURA Japanese subset. Jpn J Clin Oncol. 2019;49(1):29-36.
- 5)
- Hosomi Y, Morita S, Sugawara S, et al. Gefitinib alone versus gefitinib plus chemotherapy for non-small-cell lung cancer with mutated epidermal growth factor receptor:NEJ009 Study. J Clin Oncol. 2020;38(2):115-23.
- 6)
- Noronha V, Patil VM, Joshi A, et al. Gefitinib versus gefitinib plus pemetrexed and carboplatin chemotherapy in EGFR-Mutated Lung Cancer. J Clin Oncol. 2020;38(2):124-36.
- 7)
- Seto T, Kato T, Nishio M, et al. Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations(JO25567):an open-label, randomised, multicentre, phase 2 study. Lancet Oncol. 2014;15(11):1236-44.
- 8)
- Yamamoto N, Seto T, Nishio M, et al. Erlotinib plus bevacizumab vs erlotinib monotherapy as first-line treatment for advanced EGFR mutation-positive non-squamous non-small-cell lung cancer:survival follow-up results of the randomized JO25567 study. Lung Cancer. 2021;151:20-4.
- 9)
- Stinchcombe TE, Jänne PA, Wang X, et al. Effect of erlotinib plus bevacizumab vs erlotinib alone on progression-free survival in patients with advanced EGFR-mutant non-small cell lung cancer:a phase 2 randomized clinical trial. JAMA Oncol. 2019;5(10):1448-55.
- 10)
- Saito H, Fukuhara T, Furuya N, et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer(NEJ026):interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol. 2019;20(5):625-35.
- 11)
- Kawashima Y, Fukuhara T, Saito H, et al. Bevacizumab plus erlotinib versus erlotinib alone in Japanese patients with advanced, metastatic, EGFR-mutant non-small-cell lung cancer(NEJ026):overall survival analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Respir Med. 2022;10(1):72-82.
- 12)
- Zhou Q, Xu CR, Cheng Y, et al. Bevacizumab plus erlotinib in Chinese patients with untreated, EGFR-mutated, advanced NSCLC(ARTEMIS-CTONG1509):a multicenter phase 3 study. Cancer Cell. 2021;39(9):1279-91. e3.
- 13)
- Piccirillo MC, Bonanno L, Garassino MC, et al. Addition of bevacizumab to erlotinib as first-line treatment of patients with egfr-mutated advanced nonsquamous NSCLC:The BEVERLY multicenter randomized phase 3 trial. J Thorac Oncol. 2022;17(9):1086-97.
- 14)
- Nakagawa K, Garon EB, Seto T, et al. Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer(RELAY):a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(12):1655-69.
- 15)
- Nishio K, Seto T, Nishio M, et al. Ramucirumab plus erlotinib versus placebo plus erlotinib in patients with untreated metastatic EGFR-mutated NSCLC:RELAY Japanese subset. JTO Clin Res Rep. 2021;2(6):100171.
- 16)
- Yoh K, Atagi S, Reck M, et al. Patient-reported outcomes in RELAY, a phase 3 trial of ramucirumab plus erlotinib versus placebo plus erlotinib in untreated EGFR-mutated metastatic non-small-cell lung cancer. Curr Med Res Opin. 2020;36(10):1667-75.
- 17)
- Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer(ARCHER 1050):a randomised, open-label, phase 3 trial. Lancet Oncol. 2017;18(11):1454-66.
- 18)
- Mok TS, Cheng Y, Zhou X, et al. Improvement in overall survival in a randomized study that compared dacomitinib with gefitinib in patients with advanced non-small-cell lung cancer and EGFR-activating mutations. J Clin Oncol. 2018;36(22):2244-50.
- 19)
- Nishio M, Kato T, Niho S, et al. Safety and efficacy of first-line dacomitinib in Japanese patients with advanced non-small cell lung cancer. Cancer Sci. 2020;111(5):1724-38.
- 20)
- Paty J, Sandin R, Reisman A, et al. The patient's perspective on treatment with dacomitinib:patient-reported outcomes from the phase III trial ARCHER 1050. Future Oncol. 2021;17(7):783-94.
- 21)
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011;12(8):735-42.
- 22)
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012;13(3):239-46.
- 23)
- Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009;27(9):1394-400.
- 24)
- Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations:NEJ 003 study. J Thorac Oncol. 2012;7(9):1417-22.
- 25)
- Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013;31(27):3327-34.
- 26)
- Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6):an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15(2):213-22.
- 27)
- Prabhash K, Noronha V, Patil V, et al. P1.01-88 PS 2 patients with advanced EGFR Mutant NSCLC:subset analysis of a Phase III randomized trial comparing gefitinib to gefitinib with chemotherapy. J Thorac Oncol. 2019;14(10):suppl. S395.
- 28)
- Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer:a cohort and nested case-control study. Am J Respir Crit Care Med. 2008;177(12):1348-57.
- 29)
- Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006;24(16):2549-56.
- 30)
- Beau-Faller M, Prim N, Ruppert AM, et al. Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients:a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol. 2014;25(1):126-31.
- 31)
- Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on “uncommon” epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res. 2011;17(11):3812-21.
- 32)
- Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations:a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015;16(7):830-8.
- 33)
- Cho JH, Lim SH, An HJ, et al. Osimertinib for patients with non-small-cell lung cancer harboring uncommon EGFR mutations:a multicenter, open-label, phase II trial(KCSG-LU15-09). J Clin Oncol. 2020;38(5):488-95.
- 34)
- Yasuda H, Kobayashi S, Costa DB. EGFR exon 20 insertion mutations in non-small-cell lung cancer:preclinical data and clinical implications. Lancet Oncol. 2012;13(1):e23-31.
- 35)
- Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR exon 20 insertion-mutated non-small-cell lung cancer progressing on platinum chemotherapy:initial results from the CHRYSALIS phase I study. J Clin Oncol. 2021;39(30):3391-402.
- 36)
- Ramalingam SS, Yang JC, Lee CK, et al. Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol. 2018;36(9):841-9.
- 37)
- Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med. 2017;376(7):629-40.
- 38)
- Papadimitrakopoulou VA, Mok TS, Han JY, et al. Osimertinib versus platinum-pemetrexed for patients with EGFR T790M advanced NSCLC and progression on a prior EGFR-tyrosine kinase inhibitor:AURA3 overall survival analysis. Ann Oncol. 2020;31(11):1536-44.
- 39)
- Nakashima K, Ozawa Y, Daga H, et al. Osimertinib for patients with poor performance status and EGFR T790M mutation-positive advanced non-small cell lung cancer:a phase II clinical trial. Invest New Drugs. 2020;38(6):1854-61.
- 40)
- Tsubata Y, Watanabe K, Saito R, et al. Osimertinib in poor performance status patients with T790M-positive advanced non-small-cell lung cancer after progression of first- and second-generation EGFR-TKI treatments(NEJ032B). Int J Clin Oncol. 2022;27(1):112-20.
- 41)
- Reck M, Mok TSK, Nishio M, et al. Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer(IMpower150):key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial. Lancet Respir Med. 2019;7(5):387-401.
- 42)
- Nogami N, Barlesi F, Socinski MA, et al. IMpower150 final exploratory analyses for atezolizumab plus bevacizumab and chemotherapy in key NSCLC patient subgroups with egfr mutations or metastases in the liver or brain. J Thorac Oncol. 2022;17(2):309-23.
- 43)
- West H, McCleod M, Hussein M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130):a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019;20(7):924-37.
- 44)
- Lisberg A, Cummings A, Goldman JW, et al. A phase II study of pembrolizumab in EGFR-mutant, PD-L1+, tyrosine kinase inhibitor naïve patients with advanced NSCLC. J Thorac Oncol. 2018;13(8):1138-45.
- 45)
- Lee CK, Man J, Lord S, et al. Clinical and molecular characteristics associated with survival among patients treated with checkpoint inhibitors for advanced non-small cell lung carcinoma:a systematic review and meta-analysis. JAMA Oncol. 2018;4(2):210-6.
7-1-2.ALK融合遺伝子陽性
樹形図
ALK融合遺伝子陽性の一次治療
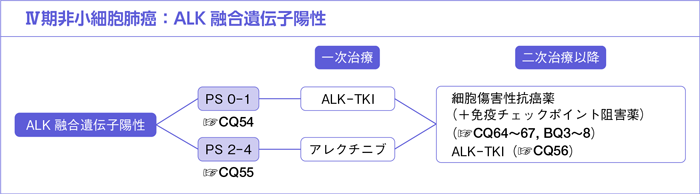
CQ54.
PS 0-1の場合,一次治療としてALK-TKIが勧められるか?*
- 推 奨
-
- a.
- アレクチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- ブリグチニブ単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:73%〕
-
- c.
- ロルラチニブ単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:73%〕
*BQ2参照。
-
a.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,アレクチニブ単剤療法とクリゾチニブ単剤療法を比較した第Ⅲ相試験が3編報告されている。国内で実施された試験(J-ALEX試験)ではPFSのHRが0.38(95%CI:0.26-0.55,P<0.0001,中央値:25.9カ月vs 10.2カ月)と,PFSを有意に延長することが示された1)。その後に,米国で行われた試験(ALEX試験)において,PFSのHRが0.47(95%CI:0.34-0.65,P<0.001,中央値:未到達vs 11.1カ月),アジアで行われた試験(ALESIA試験)において,PFSのHRが0.22(95%CI:0.13-0.38,P<0.0001,中央値:未到達vs 11.1カ月)と,同じくPFSを有意に延長することが示されている2)3)。OSについては,上記のALEX試験の更新された報告において,HR 0.67(95%CI:0.46-0.98,中央値:未到達vs 57.4カ月)でアレクチニブ単剤療法が良い傾向にあった4)。また,Grade 3以上の有害事象は,J-ALEX試験においてアレクチニブ単剤療法で32%,クリゾチニブ単剤療法で57%と,アレクチニブ単剤療法のほうが低頻度であった5)。アレクチニブ単剤療法の主な毒性は,味覚障害,筋肉痛,皮疹であり,また他のキナーゼ阻害薬と同様に間質性肺炎に注意が必要である。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはアレクチニブ単剤療法を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (30/30) |
0% | 0% | 0% | 0% |
-
b.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,ブリグチニブ単剤療法とクリゾチニブ単剤療法を比較した第Ⅲ相試験(ALTA-1L試験)が行われ,主要評価項目であるPFSはHR 0.49(95%CI:0.33-0.74,P<0.001,中央値:未到達vs 9.8カ月)であり,ブリグチニブ単剤療法のクリゾチニブ単剤療法に対する有意な延長が報告されている6)。また,更新された中間解析の報告において,PFS中央値はブリグチニブ単剤療法で24.0カ月,クリゾチニブ単剤療法で9.8カ月であった7)。Grade 3以上の有害事象は,ブリグチニブ単剤療法で61%,クリゾチニブ単剤療法で55%であった。ブリグチニブ単剤療法の主な毒性は,下痢,悪心,嘔吐などの消化器毒性,高血圧,クレアチンキナーゼ上昇,皮疹,間質性肺炎が挙げられる。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはブリグチニブ単剤療法を行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 27% (8/30) |
73% (22/30) |
0% | 0% | 0% |
-
c.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,ロルラチニブ単剤療法とクリゾチニブ単剤療法を比較した第Ⅲ相試験(CROWN試験)が行われ,主要評価項目であるPFSはHR 0.28(95%CI:0.19-0.41,P<0.001,中央値:未到達vs 9.3カ月)であり,ロルラチニブ単剤療法のクリゾチニブ単剤療法に対する有意な延長が報告されている8)。Grade 3以上の有害事象は,ロルラチニブ単剤療法で72%,クリゾチニブ単剤療法で56%であった。ロルラチニブ単剤療法の主な毒性は,高コレステロール血症,高トリグリセリド血症,体重増加,高血圧であり,特徴的な有害事象として認知機能障害(2%)が報告されている。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはロルラチニブ単剤療法を行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 27% (8/30) |
73% (22/30) |
0% | 0% | 0% |
CQ55.
PS 2-4の場合,一次治療としてALK-TKIが勧められるか?
- 推 奨
- アレクチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
ALK融合遺伝子陽性の患者に対するアレクチニブ単剤療法は,PS不良例に対する有効性が報告されている9)。本邦において,ALK融合遺伝子陽性のPS不良患者を対象として,アレクチニブ単剤療法の有効性および安全性を評価した第Ⅱ相試験(LOGiK1401試験)が行われた。患者数はPS 2:12例,PS 3:5例,PS 4:1例であるが,安全性に大きな問題はなかった。主要評価項目であるORRは72.2%,PFS中央値は10.1カ月であり,さらに83.3%の患者でPSの改善を認めた。同試験の更新された報告では,PFS中央値が16.2カ月,OS中央値は30.3カ月であった10)。
以上より,PS 2-4の場合,ALK融合遺伝子陽性例の一次治療としては,アレクチニブ単剤療法が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (27/27) |
0% | 0% | 0% | 0% |
ALK融合遺伝子陽性の二次治療以降
CQ56.
アレクチニブ耐性または増悪後の症例に対して,ALK-TKIは勧められるか?
- 推 奨
- ALK-TKI単剤療法(ブリグチニブ,ロルラチニブ,セリチニブ)を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:72%〕
アレクチニブを含むALK-TKI耐性または増悪後の症例の二次治療以降において,プラチナ製剤併用療法とALK-TKIを比較した試験は存在しない。
本邦で実施されたアレクチニブまたはクリゾチニブを含むその他すべてのALK-TKI耐性後の症例を対象としたブリグチニブ単剤療法の第Ⅱ相試験(J-ALTA試験)では,アレクチニブの使用歴のある47例に対するブリグチニブ単剤療法の効果は,ORR 34%,PFS中央値7.3カ月であった11)。海外で実施された,アレクチニブを含むALK-TKI耐性後の20例(16例でアレクチニブ投与歴あり)を対象としたブリグチニブ単剤療法の第Ⅱ相試験においても,ORR 40%,PFS中央値 7.0カ月と同様の成績を示した12)。さらに,ブリグチニブの投与によってQOL指標の一部が改善することが示されている13)(主な毒性についてはCQ54を参照)。
ALK融合遺伝子陽性例を対象としたロルラチニブ単剤療法の第Ⅱ相試験が行われた。全体198例のうち31%(62例)でアレクチニブ投与歴があり,このうち直近のALK-TKIがアレクチニブであった症例(62例)においては,ORR 37.1%であった14)。日本人集団の報告では全体集団と同様の傾向であった15)(主な毒性についてはCQ54を参照)。
前治療でアレクチニブ使用歴のある20症例に対するセリチニブ単剤療法の第Ⅱ相試験(ASCEND-9試験)が本邦で行われ,ORR 25%,PFS中央値3.7カ月であった。主な毒性は,下痢,嘔気・嘔吐,肝機能障害,クレアチニン上昇,食欲不振,便秘,QT延長,発熱であり,その他重篤な有害事象の報告はなかった16)。
以上より,アレクチニブ耐性または増悪後のPS 0-2の症例には,ALK-TKI(ブリグチニブ,ロルラチニブ,セリチニブ)単剤療法を行うよう提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 24% (7/29) |
72% (21/29) |
3% (1/29) |
0% | 0% |
- 1)
- Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer(J-ALEX):an open-label, randomised phase 3 trial. Lancet. 2017;390(10089):29-39.
- 2)
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med. 2017;377(9):829-38.
- 3)
- Zhou C, Kim SW, Reungwetwattana T, et al. Alectinib versus crizotinib in untreated Asian patients with anaplastic lymphoma kinase-positive non-small-cell lung cancer(ALESIA):a randomised phase 3 study. Lancet Respir Med. 2019;7(5):437-46.
- 4)
- Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-64.
- 5)
- Takiguchi Y, Hida T, Nokihara H, et al. Updated efficacy and safety of the j-alex study comparing alectinib(ALC)with crizotinib(CRZ)in ALK-inhibitor naïve ALK fusion positive non-small cell lung cancer(ALK+NSCLC). J Clin Oncol. 2017;35(15 suppl 9064).
- 6)
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus crizotinib in ALK-positive non-small-cell lung cancer. N Engl J Med. 2018;379(21):2027-39.
- 7)
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus crizotinib in advanced ALK inhibitor-naive ALK-positive non-small cell lung cancer:Second interim analysis of the phase III ALTA-1L trial. J Clin Oncol. 2020;38(31):3592-603.
- 8)
- Shaw AT, Bauer TM, de Marinis F, et al. First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med. 2020;383(21):2018-29.
- 9)
- Iwama E, Goto Y, Murakami H, et al. Alectinib for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017;12(7):1161-6.
- 10)
- Iwama E, Goto Y, Murakami H, et al. Survival analysis for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status treated with alectinib:updated results of Lung Oncology Group in Kyushu 1401. Oncologist. 2020;25(4):306-e618.
- 11)
- Nishio M, Yoshida T, Kumagai T, et al. Brigatinib in Japanese patients with ALK-positive NSCLC previously treated with alectinib and other tyrosine kinase inhibitors:outcomes of the phase 2 J-ALTA trial. J Thorac Oncol. 2021;16(3):452-63.
- 12)
- Stinchcombe TE, Doebele RC, Wang X, et al. Preliminary clinical and molecular analysis results from a single-arm phase 2 trial of brigatinib in patients with disease progression after next-generation ALK tyrosine kinase inhibitors in advanced ALK+NSCLC. J Thorac Oncol. 2021;16(1):156-61.
- 13)
- Lenderking WR, Lin H, Speck RM, et al. Patient-reported outcomes and quality of life in advanced ALK+non-small-cell lung cancer trial of brigatinib(ALTA). Future Oncol. 2019;15(24):2841-55.
- 14)
- Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer:results from a global phase 2 study. Lancet Oncol. 2018;19(12):1654-67.
- 15)
- Seto T, Hayashi H, Satouchi M, et al. Lorlatinib in previously treated anaplastic lymphoma kinase-rearranged non-small cell lung cancer:Japanese subgroup analysis of a global study. Cancer Sci. 2020;111(10):3726-38.
- 16)
- Hida T, Seto T, Horinouchi H, et al. Phase II study of ceritinib in alectinib-pretreated patients with anaplastic lymphoma kinase-rearranged metastatic non-small-cell lung cancer in Japan:ASCEND-9. Cancer Sci. 2018;109(9):2863-72.
7-1-3.ROS1融合遺伝子陽性
樹形図
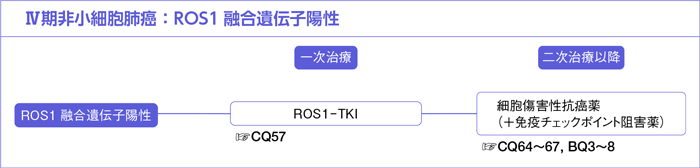
CQ57.
ROS1融合遺伝子陽性にROS1-TKIは勧められるか?
- 推 奨
- ROS1-TKI単剤療法(クリゾチニブ,エヌトレクチニブのいずれか)を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
ROS1融合遺伝子陽性の非小細胞肺癌ではクリゾチニブ単剤療法の効果が複数報告されている。米国を中心とした試験では50例が参加し,ORRは72%,PFS中央値19.2カ月1),追加報告(53例)でのOS中央値は51.4カ月であった2)。本邦を含む東アジアで実施された試験では,127例が登録され,ORR 71.7%,PFS中央値15.9カ月3),追加報告でのOS中央値は44.2カ月であった4)。その他,同じデザインで行われた第Ⅱ相試験3編5)~7)を含めた5試験の統合解析はORR 67%(95%CI:58-75%)であり,いずれの試験においても一貫して良好な成績が示されている。クリゾチニブ単剤療法の主な毒性は,視覚障害,下痢や悪心などの消化器毒性,肝機能障害が挙げられる。
また,同じくROS1融合遺伝子陽性の非小細胞肺癌に対して,エヌトレクチニブ単剤療法を評価した2つの第Ⅰ相試験(ALKA-372-001試験,STARTRK-1試験),および第Ⅱ相試験(STARTRK-2試験)の統合解析が報告された。全体で53例のROS1融合遺伝子陽性例が登録され,主要評価項目であるORRは77%,PFS中央値は19.0カ月であった8)。同試験の更新された報告では,ORRは67.1%,PFS中央値は15.7カ月であった9)。また,無症候性脳転移に対しても高い頭蓋内奏効率が報告されている(Ⅳ.転移など各病態に対する治療:CQ12参照)。エヌトレクチニブ単剤療法の主な毒性は,味覚障害,便秘,下痢などの消化器毒性,倦怠感,浮腫,クレアチニン上昇,ヘモグロビン低下が挙げられる。なお,今回の統合解析においてクリゾチニブ既治療例は含まれておらず,クリゾチニブ耐性後のエヌトレクチニブ単剤療法の効果は明らかではない。
以上より,ROS1融合遺伝子陽性例に対しては,クリゾチニブ,エヌトレクチニブのいずれかの単剤療法が勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (29/29) |
0% | 0% | 0% | 0% |
- 1)
- Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014;371(21):1963-71.
- 2)
- Shaw AT, Riely GJ, Bang YJ, et al. Crizotinib in ROS1-rearranged advanced non-small-cell lung cancer(NSCLC):updated results, including overall survival, from PROFILE 1001. Ann Oncol. 2019;30(7):1121-6.
- 3)
- Wu YL, Yang JC, Kim DW, et al. Phase II study of crizotinib in East Asian patients with ROS1-positive advanced non-small-cell lung cancer. J Clin Oncol. 2018;36(14):1405-11.
- 4)
- Wu YL, Lu S, Yang JC, et al. Final Overall survival, safety, and quality of life results from a phase 2 study of crizotinib in east asian patients with ROS1-positive advanced NSCLC. JTO Clin Res Rep. 2022;3(10):100406.
- 5)
- Michels S, Massutí B, Schildhaus HU, et al. Safety and efficacy of crizotinib in patients with advanced or metastatic ROS1-rearranged lung cancer(EUCROSS):a european phase II clinical trial. J Thorac Oncol. 2019;14(7):1266-76.
- 6)
- Landi L, Chiari R, Tiseo M, et al. Crizotinib in MET-deregulated or ROS1-rearranged pretreated non-small cell lung cancer(METROS):a phase II, prospective, multicenter, two-arms trial. Clin Cancer Res. 2019;25(24):7312-9.
- 7)
- Moro-Sibilot D, Cozic N, Pérol M, et al. Crizotinib in c-MET- or ROS1-positive NSCLC:results of the AcSé phase II trial. Ann Oncol. 2019;30(12):1985-91.
- 8)
- Drilon A, Siena S, Dziadziuszko R, et al. Entrectinib in ROS1 fusion-positive non-small-cell lung cancer:integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020;21(2):261-70.
- 9)
- Dziadziuszko R, Krebs MG, De Braud F, et al. Updated integrated analysis of the efficacy and safety of entrectinib in locally advanced or metastatic ROS1 fusion-positive non-small-cell lung cancer. J Clin Oncol. 2021;39(11):1253-63.
7-1-4.BRAF遺伝子V600E変異陽性
樹形図

CQ58.
BRAF遺伝子V600E変異陽性にダブラフェニブ+トラメチニブは勧められるか?
- 推 奨
- ダブラフェニブ+トラメチニブ併用療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:93%〕
BRAF遺伝子V600E変異陽性の非小細胞肺癌ではダブラフェニブ単剤療法や,ダブラフェニブ+トラメチニブ併用療法の効果が複数報告されている。Ⅳ期非小細胞肺癌のBRAF遺伝子V600E変異陽性の既治療例57例を対象とした,ダブラフェニブ+トラメチニブ併用療法の第Ⅱ相試験が行われ,主要評価項目のORRは66.7%,PFS中央値は9.7カ月であった1)。Ⅳ期非小細胞肺癌のBRAF遺伝子V600E変異陽性の未治療例36例を対象とした,ダブラフェニブ+トラメチニブ併用療法の第Ⅱ相試験では,主要評価項目のORRは64%,PFS中央値は10.9カ月であった2)。両試験の更新された報告では,既治療例においてOS中央値は18.2カ月,5年OS率は19%,未治療例においてOS中央値は17.3カ月,5年OS率は22%であった3)。ただし,両試験に登録された日本人の症例数が限られている。ダブラフェニブ+トラメチニブ併用療法では,主な毒性として発熱,肝機能障害,心駆出率減少が認められている。
以上より,BRAF遺伝子V600E変異陽性例に対しては,ダブラフェニブ+トラメチニブ併用療法が勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (27/29) |
7% (2/29) |
0% | 0% | 0% |
- 1)
- Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer:an open-label, multicentre phase 2 trial. Lancet Oncol. 2016;17(7):984-93.
- 2)
- Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer:an open-label, phase 2 trial. Lancet Oncol. 2017;18(10):1307-16.
- 3)
- Planchard D, Besse B, Groen HJM, et al. Phase 2 study of dabrafenib plus trametinib in patients with BRAF V600E-mutant metastatic NSCLC:updated 5-year survival rates and genomic analysis. J Thorac Oncol. 2022;17(1):103-15.
7-1-5.MET遺伝子変異陽性
樹形図

CQ59.
MET遺伝子変異陽性にMET-TKIは勧められるか?
- 推 奨
- MET-TKI単剤療法(テポチニブ,カプマチニブのいずれか)を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:92%〕
MET遺伝子変異(エクソン14スキッピング変異)陽性の非小細胞肺癌を対象として,テポチニブ単剤療法の第Ⅱ相試験(VISION試験)が行われた。主要評価項目はORRであった。有効性評価が可能であった146例のORRは44.5%,そのうち観察期間が9カ月以上得られたコホート(99例)におけるORRは46%,PFS中央値は8.5カ月,OS中央値は17.1カ月であった。テポチニブ単剤療法の主な毒性は,末梢浮腫,悪心,下痢,クレアチニン上昇が認められている。なお,テポチニブ単剤の投与によってQOL指標の一部が改善することが示されている1)。日本人集団の報告では全体集団と同様の傾向であった2)。
また,同じくMET遺伝子変異(エクソン14スキッピング変異)陽性の非小細胞肺癌を対象として,カプマチニブ単剤療法の第Ⅱ相試験(GEOMETRY mono-1試験)が行われた。主要評価項目はORRであった。二~三次治療例コホート(69例)におけるORRは41%,PFS中央値は5.4カ月であり,初回治療例コホート(28例)におけるORRは68%,PFS中央値は12.4カ月であった。カプマチニブ単剤療法の主な毒性は,末梢浮腫,倦怠感,悪心,嘔吐,クレアチニン上昇が認められている3)。日本人集団の報告では全体集団と同様の傾向であった4)。
以上より,MET遺伝子変異陽性例に対しては,テポチニブ,カプマチニブのいずれかの単剤療法が勧められる。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 92% (23/25) |
8% (2/25) |
0% | 0% | 0% |
- 1)
- Paik PK, Felip E, Veillon R, et al. Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med. 2020;383(10):931-43.
- 2)
- Sakai H, Morise M, Kato T, et al. Tepotinib in patients with NSCLC harbouring MET exon 14 skipping:Japanese subset analysis from the Phase II VISION study. Jpn J Clin Oncol. 2021;51(8):1261-8.
- 3)
- Wolf J, Seto T, Han JY, et al. Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med. 2020;383(10):944-57.
- 4)
- Seto T, Ohashi K, Sugawara S, et al. Capmatinib in Japanese patients with MET exon 14 skipping-mutated or MET-amplified advanced NSCLC:GEOMETRY mono-1 study. Cancer Sci. 2021;112(4):1556-66.
7-1-6.RET融合遺伝子陽性
樹形図

CQ60.
RET融合遺伝子陽性にセルペルカチニブは勧められるか?
- 推 奨
- セルペルカチニブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:77%〕
RET融合遺伝子陽性の非小細胞肺癌を対象として,セルペルカチニブ単剤療法の第Ⅰ/Ⅱ相試験(LIBRETTO-001試験)が行われた。主要評価項目はORRであった。既治療例コホート(105例)におけるORRは64%,PFS中央値は16.5カ月であり,初回治療例コホート(39例)におけるORRは85%,PFS中央値は未到達であった。セルペルカチニブ単剤療法の主な毒性は,下痢,口内乾燥,高血圧,肝機能障害,倦怠感,過敏症が認められている1)2)。
以上より,RET融合遺伝子陽性例に対しては,セルペルカチニブ単剤療法が勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 77% (20/26) |
23% (6/26) |
0% | 0% | 0% |
- 1)
- Drilon A, Oxnard GR, Tan DSW, et al. Efficacy of selpercatinib in RET fusion-positive non-small-cell lung cancer. N Engl J Med. 2020;383(9):813-24.
- 2)
- McCoach CE, Rolfo C, Drilon A, et al. Hypersensitivity reactions to selpercatinib treatment with or without prior immune checkpoint inhibitor therapy in patients with NSCLC in LIBRETTO-001. J Thorac Oncol. 2022;17(6):768-78.
7-1-7.NTRK融合遺伝子陽性
樹形図

CQ61.
NTRK融合遺伝子陽性*にTRK-TKIは勧められるか?
- 推 奨
- TRK-TKI単剤療法(エヌトレクチニブ,ラロトレクチニブのいずれか)を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:D,合意率:71%〕
*主にがんゲノムプロファイリング検査で検索されるため,実施可能な施設は限られる(2023年6月時点)。
※一次治療は,ドライバー遺伝子変異/転座陰性(CQ64~66)を参照のこと。
NTRK融合遺伝子陽性の固形癌に対して,エヌトレクチニブ単剤療法を評価する試験が癌腫横断的に行われた。2つの第Ⅰ相試験(ALKA-372-001試験,STARTRK-1試験)では,有効性評価が可能な症例のうちNTRK融合遺伝子陽性例の3例中1例にNSCLCが含まれており,奏効が得られている1)。前述した第Ⅰ相試験および第Ⅱ相試験(STARTRK-2試験)の統合解析では,全体で54例のNTRK融合遺伝子陽性固形癌が登録され,主要評価項目であるORRは57%,PFS中央値は11カ月であった2)。更新された報告(121例)においてNSCLCは22例(18.2%)含まれており,ORRは74%,PFS中央値は13.8カ月であった3)。エヌトレクチニブ単剤療法の主な毒性は,味覚障害,便秘,下痢などの消化器毒性,倦怠感,浮腫,クレアチニン上昇,ヘモグロビン低下が挙げられる。
また,同じくNTRK融合遺伝子陽性の固形癌に対して,ラロトレクチニブ単剤療法を評価する試験が癌腫横断的に行われた。3つの第Ⅰ/Ⅱ相試験(SCOUT試験,NAVIGATE試験,他)の統合解析が行われた。全体で159例のNTRK融合遺伝子陽性固形癌が登録され,主要評価項目であるORRは79%,PFS中央値は28.3カ月であった4)。そのうち肺癌症例は20例(NSCLC 19例)含まれており,ORRは73%,PFS中央値は35.4カ月であった5)。ラロトレクチニブ単剤療法の主な毒性は,便秘,下痢などの消化器毒性,倦怠感,めまい,好中球減少,ヘモグロビン低下が挙げられる。
以上より,NTRK融合遺伝子陽性例に対しては,エヌトレクチニブ,ラロトレクチニブのいずれかの単剤療法が勧められる。エビデンスの強さはD,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 71% (20/28) |
25% (7/28) |
4% (1/28) |
0% | 0% |
- 1)
- Drilon A, Siena S, Ou SI, et al. Safety and antitumor activity of the multitargeted pan-TRK, ROS1, and ALK inhibitor entrectinib:combined results from two phase I trials(ALKA-372-001 and STARTRK-1). Cancer Discov. 2017;7(4):400-9.
- 2)
- Doebele RC, Drilon A, Paz-Ares L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours:integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020;21(2):271-82.
- 3)
- Demetri GD, De Braud F, Drilon A, et al. Updated integrated analysis of the efficacy and safety of entrectinib in patients with NTRK fusion-positive solid tumors. Clin Cancer Res. 2022;28(7):1302-12.
- 4)
- Hong DS, DuBois SG, Kummar S, et al. Larotrectinib in patients with TRK fusion-positive solid tumours:a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol. 2020;21(4):531-40.
- 5)
- Drilon A, Tan DSW, Lassen UN, et al. Efficacy and safety of larotrectinib in patients with tropomyosin receptor kinase fusion-positive lung cancers. JCO Precis Oncol. 2022;6:e2100418.
7-1-8.KRAS遺伝子G12C変異陽性
樹形図

- 推 奨
- 二次治療*以降でソトラシブ単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:71%〕
*一次治療は,ドライバー遺伝子変異/転座陰性(CQ64~67)を参照のこと。
既治療KRAS遺伝子G12C変異陽性の非小細胞肺癌(345例)を対象として,ソトラシブ単剤療法とDTX単剤療法を比較する第Ⅲ相試験(CodeBreaK200試験)が行われた。主要評価項目であるPFSはHR 0.66(95%CI:0.51-0.86,P=0.0017,中央値:5.6カ月vs 4.5カ月)であり,ソトラシブ単剤療法はDTX単剤療法に対してPFSを有意に延長することが示された。ORRもソトラシブ単剤療法群で高かった(28.1% vs 13.2%)。なお,OSはHR 1.01(95%CI:0.77-1.33,P=0.53,中央値:10.6カ月vs 11.3カ月)と両群で差は認められなかった。ソトラシブ単剤療法の主な毒性は,下痢,悪心,倦怠感,肝機能障害が認められている1)。
以上より,KRAS遺伝子G12C変異陽性例に対しては,二次治療以降でソトラシブ単剤療法が勧められる。エビデンスの強さはB,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 71% (20/28) |
29% (8/28) |
0% | 0% | 0% |
7-1-9.HER2遺伝子変異陽性
樹形図

CQ63.
HER2遺伝子変異陽性にトラスツズマブ デルクステカンは勧められるか?
- 推 奨
- 二次治療*以降でトラスツズマブ デルクステカン単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:61%〕
*一次治療は,ドライバー遺伝子変異/転座陰性(CQ64~67)を参照のこと。
活性型HER2遺伝子変異陽性の既治療非小細胞肺癌91例を対象として,トラスツズマブ デルクステカン単剤療法(6.4 mg/kg)を評価する第Ⅱ相試験(DESTINY-Lung01試験)が行われた。主要評価項目であるORRは55%,PFS中央値は8.2カ月,OS中央値は17.8カ月であった。主な毒性は,悪心・嘔吐や下痢などの消化器毒性,好中球減少や貧血などの血液毒性,倦怠感,脱毛,食欲不振が挙げられたほか,26%(24例)で間質性肺炎が認められ,Grade 5も2例認められた1)。その後,同じく活性型HER2遺伝子変異陽性の既治療非小細胞肺癌152例を対象として,トラスツズマブ デルクステカン単剤療法5.4 mg/kgと6.4 mg/kgのランダム化第Ⅱ相試験(DESTINY-Lung02試験)が行われ,中間解析(80例)の結果が報告された。ORRは5.4 mg/kg群で53.8%,6.4 mg/kg群で42.9%であった。Grade 3以上の治療関連有害事象発現率は,5.4 mg/kg群で31.7%,6.4 mg/kg群で58.0%であり,間質性肺炎の頻度はそれぞれ5.9%,14.0%であった2)。
以上より,HER2遺伝子変異陽性例に対しては,二次治療以降でトラスツズマブ デルクステカン単剤療法が勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 61% (17/28) |
39% (11/28) |
0% | 0% | 0% |
- 1)
- Li BT, Smit EF, Goto Y, et al. Trastuzumab deruxtecan in HER2-mutant non-small-cell lung cancer. N Engl J Med. 2022;386(3):241-51.
- 2)
- Goto K, Kim SW, Kubo T, et al. Trastuzumab deruxtecan(T-DXd)in patients(Pts)with HER2-mutant metastatic non-small cell lung cancer(NSCLC):interim results from the phase 2 DESTINY-Lung02 trial. Ann Oncol. 2022;33(suppl_7):S808-S869.
- 7-2
- ドライバー遺伝子変異/転座陰性
7-2-1.ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%以上の一次治療
樹形図
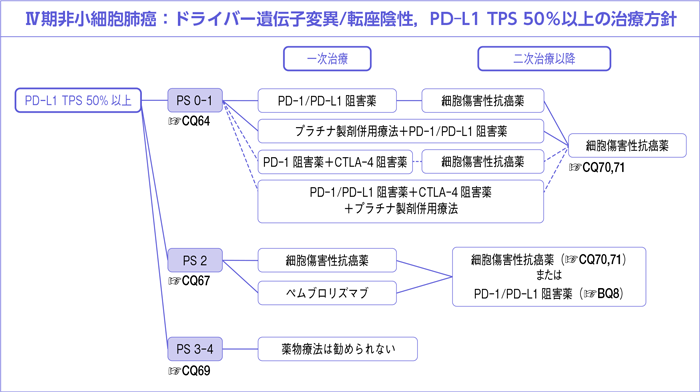
CQ64.
全身状態良好(PS 0-1)なPD-L1 TPS 50%以上に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- ペムブロリズマブ単剤療法もしくはアテゾリズマブ単剤療法*を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:93%〕
-
- b.
- プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:69%〕
-
- c.
- ニボルマブ+イピリムマブ併用療法を行うよう推奨するだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
-
- d.
- PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を行うよう推奨するだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
*PD-L1(SP142)TC3/IC3に限る。
-
a.EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 50%以上のPS 0-1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤療法とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-024試験)が行われた。中間解析において主要評価項目であるPFSはHR 0.50(95%CI:0.37-0.68,P<0.001,中央値:10.3カ月vs 6.0カ月)1),OSは更新された報告において,HR 0.62(95%CI:0.48-0.81,中央値:26.3カ月vs 13.4カ月)であり2),ペムブロリズマブ単剤療法はプラチナ製剤併用療法に対しPFS,OSを有意に延長することが示された。また,ORRは46.1% vs 31.1%であり,ペムブロリズマブ単剤療法が有意に優れていた。主な毒性は,ペムブロリズマブ単剤療法群で下痢や倦怠感,発熱,プラチナ製剤併用療法群で貧血,悪心,倦怠感などであり,Grade 3以上の毒性はペムブロリズマブ単剤療法群で有意に少なかった(31.2% vs 53.3%)。一方,ペムブロリズマブ単剤療法群で甲状腺機能障害,肺臓炎,インフュージョンリアクション,皮疹,大腸炎などの免疫関連の毒性が報告されGrade 3以上は13.6%と報告されており,それらの毒性管理には注意が必要である。同試験には40例の日本人患者が登録されており,そのうちペムブロリズマブ単剤療法群は21例であった3)。Grade 3以上の毒性は8例(38%)で認められ,Grade 3以上の免疫関連有害事象は4例(19%)で認められた。また,ペムブロリズマブ単剤療法群がプラチナ製剤併用療法に比べてQOLを維持させること,および肺癌による症状が悪化するまでの期間を有意に遅らせることも報告されている4)。
さらに,前述した試験と同様のデザインで,PD-L1 TPS 1%以上を対象として,ペムブロリズマブ単剤療法とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-042試験)が行われた5)。PD-L1 TPS 50%以上のサブグループにおける解析では,主要評価項目であるOSはHR 0.69(95%CI:0.56-0.85,P=0.0003,中央値:20.0カ月vs 12.2カ月)とペムブロリズマブ単剤療法はプラチナ製剤併用療法に対しOSを有意に延長することが示され,また,PFSはHR 0.81(95%CI:0.67-0.99,中央値:7.1カ月vs 6.4カ月)であり,PFSも延長することが示された。また,ORRは39% vs 32%であった。
なお,75歳以上の症例において,有効性,安全性に関する報告は少ない。前述したKEYNOTE-042試験における75歳以上の症例の統合解析では,ペムブロリズマブ単剤療法が細胞傷害性抗癌薬に比べてGrade 3以上の毒性の頻度が低いことが報告されている(24.2% vs 61.0%)6)。ただし,75歳以上と75歳未満のGrade 3以上の毒性頻度はそれぞれ24.2%,16.9%と75歳以上で高い傾向にあり,毒性管理には十分な注意が必要である。
SP142を用いたPD-L1免疫染色でTC1もしくはIC1以上(PD-L1発現あり相当),PS 0-1のⅣ期非小細胞肺癌患者を対象として,アテゾリズマブ単剤療法とプラチナ製剤併用療法を比較する第Ⅲ相試験(IMpower110試験)が行われた7)。この試験の解析ではPD-L1別によるヒエラルキー解析が用いられた。最初のステップであるTC3ないしはIC3(PD-L1高発現相当)の患者205例を対象としたOSの解析のみで有効性が証明された。同サブグループにおけるアテゾリズマブ単剤療法群とプラチナ製剤併用療法群の比較解析において,OSはHR 0.59(95%CI:0.40-0.89,中央値:20.2カ月vs 13.1カ月),PFSはHR 0.63(95%CI:0.45-0.88,中央値:8.1カ月vs 5.0カ月)であり,アテゾリズマブ単剤療法はプラチナ製剤併用療法に対しPFS,OSを延長することが示唆された。また,ORRは38.3% vs 28.6%であった。Grade 3以上の毒性の頻度においてもアテゾリズマブ単剤のほうが低頻度であった(30.1% vs 52.5%)。アテゾリズマブ単剤療法群で肝機能障害,皮疹,内分泌障害,肺臓炎などの免疫関連の毒性の増加が報告されており,それらの毒性管理には注意が必要である。
〔SP142を用いたPD-L1免疫染色では,腫瘍細胞(tumor cells;TC)に加え,腫瘍浸潤免疫細胞(tumor-infiltrating immune cells;IC)のPD-L1発現をそれぞれ0~3の4段階で測定し評価している。〕
以上より,PD-L1 TPS 50%以上のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してペムブロリズマブ単剤療法もしくはアテゾリズマブ単剤療法〔PD-L1(SP142)TC3/IC3に限る〕を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (27/29) |
7% (2/29) |
0% | 0% | 0% |
-
b-1.非扁平上皮癌
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-189試験)が行われた。中間解析において主要評価項目であるPFSは,HR 0.52(95%CI:0.43-0.64,P<0.0001,中央値:8.8カ月vs 4.9カ月)8),OSは更新された報告において,HR 0.60(95%CI:0.50-0.72,中央値:22.0カ月vs 10.6カ月)であり9),プラチナ製剤+PEM療法に対するペムブロリズマブの上乗せはPFS,OSを有意に延長することが示された。PD-L1 TPS 50%以上のサブグループ解析において,PFSはHR 0.35(95%CI:0.25-0.49,中央値:11.3カ月vs 4.8カ月),OSはHR 0.68(95%CI:0.49-0.96,中央値:27.7カ月 vs 10.1カ月)と,良好な生存効果を示した。主な毒性は,ペムブロリズマブ併用療法群で悪心,貧血,倦怠感,便秘などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は同等であった(72.8% vs 67.3%)。ただし,ペムブロリズマブ併用療法群でGrade 3以上の免疫関連の毒性が12.8%と報告され,急性腎障害および肺臓炎により2例の治療関連死が報告されており,これらの毒性管理には注意が必要である。同試験のPROにおいては,ペムブロリズマブ併用療法群で,QOLの維持もしくは肺癌による症状の悪化までの期間の延長が示された10)。
PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower150試験)が行われ,CBDCA/PTX/ベバシズマブ+アテゾリズマブ併用療法(B群)とCBDCA/PTX/ベバシズマブ療法(C群)の比較結果が報告された11)。主要評価項目はEGFR遺伝子変異/ALK融合遺伝子陰性集団におけるPFSおよびOSであった。C群に対するB群のPFSは,HR 0.62(95%CI:0.52-0.74,P<0.001,中央値:8.3カ月vs 6.8カ月),OSはHR 0.78(95%CI:0.64-0.96,P=0.02,中央値:19.2カ月vs 14.7カ月)であり,CBDCA/PTX/ベバシズマブ療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された。なお,最終解析におけるOSはHR 0.80(95%CI:0.68-0.95,中央値:19.8カ月vs 15.0カ月)であった12)。PD-L1発現が「TC3/IC3」のサブグループ解析において,PFSはHR 0.39(95%CI:0.25-0.60,中央値:12.6カ月vs 6.8カ月),最終解析におけるOSはHR 0.70(95%CI:0.46-1.08,中央値:30.0カ月vs 15.0カ月)と,PD-L1高発現症例において良好な結果を示した。主な毒性は,アテゾリズマブ併用療法群で食欲不振,末梢神経障害,悪心,倦怠感などであり,Grade 3以上の毒性はCBDCA/PTX/ベバシズマブ療法群と比較し頻度は高い傾向を認めた(60.4% vs 51.5%)。また免疫関連の毒性として,アテゾリズマブ併用療法群で皮疹,肝機能障害,甲状腺機能障害,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
また同様の患者集団を対象として,CBDCA+nab-PTX療法にアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower130試験)では,主要評価項目としてEGFR遺伝子変異/ALK融合遺伝子陰性集団におけるPFSおよびOSが比較検証された13)。CBDCA+nab-PTX療法に対するアテゾリズマブの上乗せはPFSがHR 0.64(95%CI:0.54-0.77,P<0.001,中央値:7.0カ月vs 5.5カ月),OSがHR 0.79(95%CI:0.64-0.98,P=0.033,中央値:18.6カ月vs 13.9カ月)とPFS,OSを有意に延長することが示された。また,PD-L1発現が「TC3/IC3」のサブグループ解析においても,PFSはHR 0.51(95%CI:0.34-0.77,中央値:6.4カ月vs 4.6カ月),OSはHR 0.84(95%CI:0.51-1.39,中央値:17.3カ月vs 16.9カ月)と,PD-L1高発現症例において良好な結果を示した。主な毒性は,アテゾリズマブ併用療法群で好中球減少や貧血などの骨髄抑制,食欲不振,悪心,倦怠感,下痢などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は高い傾向を認めた(81% vs 71%)。また免疫関連の毒性として,アテゾリズマブ併用群では甲状腺機能障害(15%),肝機能障害(10%)を主に認め,さらに皮疹,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
-
b-2.扁平上皮癌
PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-407試験)が行われた14)。主要評価項目であるOSは更新された報告においてHR 0.71(95%CI:0.59-0.85,中央値:17.2カ月vs 11.6カ月),PFSはHR 0.62(95%CI:0.52-0.74,中央値:8.0カ月vs 5.1カ月)であり,CBDCA+PTX/nab-PTX療法に対するペムブロリズマブの上乗せはPFSとOSを有意に延長することが示された15)。PD-L1 TPS 50%以上のサブグループ解析において,OSはHR 0.68(95%CI:0.47-0.97, 中央値:19.9カ月vs 11.5カ月)であり,良好な生存効果を示した。主な毒性は,ペムブロリズマブ併用療法群で貧血,食欲不振,好中球減少などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は同等であった(74.8% vs 70.0%)。ただし,治療関連死亡はペムブロリズマブ併用療法群で高い傾向を認めた(4.3% vs 1.8%)。また同試験のPROにおいては,ペムブロリズマブ併用療法群でプラチナ製剤併用療法群に比べて,QOLが維持されることが示された16)。
75歳以上の症例においては,前述の主な第Ⅲ相試験においてある一定数が登録されているが,高齢者に限った安全性のデータは示されていないため,これらの併用療法の投与には慎重を期すべきである。
以上より,PD-L1高発現のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してプラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療を行うよう勧められる。ただし,ペムブロリズマブ/アテゾリズマブ単剤療法と比較したデータはなく,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療がペムブロリズマブ/アテゾリズマブ単剤療法より優れているかどうかは明らかではない。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 69% (20/29) |
31% (9/29) |
0% | 0% | 0% |
なお,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療のレジメンの詳細については項末を参照のこと。
-
c.EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 1%以上,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブ併用療法,ニボルマブ単剤療法とプラチナ製剤併用療法を3群比較する第Ⅲ相試験(CheckMate227Part1試験)が行われた17)。ニボルマブ+イピリムマブ併用療法群とプラチナ製剤併用療法群の比較において,主要評価項目であるOSはHR 0.79(97.72%CI:0.65-0.96,中央値:17.1カ月vs 14.9カ月)であり,ニボルマブ+イピリムマブ併用療法はプラチナ製剤併用療法に対しOSを延長することが示された。ORRは45.4%vs 35.4%であった。更新された報告に基づくPD-L1 TPS 50%以上のサブグループ解析では,OSはHR 0.69(95%CI:0.54-0.86,中央値:20.6カ月vs 14.0カ月),PFSはHR 0.61(95%CI:0.48-0.77,中央値:6.7カ月vs 5.6カ月)であり,良好な生存効果を示した。Grade 3/4の毒性の頻度はどちらも同程度であった(33% vs 36%)18)。ニボルマブ+イピリムマブ併用療法群で内分泌障害,肺臓炎,皮疹,胃腸障害などの免疫関連の毒性の増加が報告されており,それらの毒性管理には注意が必要である。
なお75歳以上の症例では,PD-L1 TPS 1%以上の集団におけるOSはHR 0.95(95%CI:0.56-1.62,中央値:13.5カ月vs 11.4カ月)となっており,高齢者に限った安全性のデータも示されていないため,これらの併用療法の投与には慎重を期すべきである。
一方で,EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 50%以上,Ⅳ期非小細胞肺癌患者を対象として,ペムブロリズマブ+イピリムマブ併用療法とペムブロリズマブ+プラセボ療法を比較する第Ⅲ相試験(KEYNOTE-598試験)が行われた19)。OSはHR 1.08(95%CI:0.85-1.37,中央値:21.4カ月vs 21.9カ月),PFSはHR 1.06(95%CI:0.86-1.30,中央値:8.2カ月vs 8.4カ月)であり,ペムブロリズマブ+イピリムマブ併用療法はペムブロリズマブ+プラセボ療法に対し優越性が示せなかった。Grade 3以上の毒性はペムブロリズマブ+イピリムマブ群62.4%,ペムブロリズマブ群50.2%であり,ペムブロリズマブ+イピリムマブ群で多く認められた。
以上より,治療効果と毒性のバランスを考慮した場合に,PD-L1 TPS 50%以上のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してニボルマブ+イピリムマブ併用療法を選択すべきかどうか小委員会の中でも意見が分かれた。本CQに関して,議論の末に投票を行った結果,PD-L1高発現のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してニボルマブ+イピリムマブ併用療法を推奨するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 55% (16/29) |
3% (1/29) |
34% (10/29) |
7% (2/29) |
-
d.EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブ+プラチナ製剤併用療法(2サイクル導入療法)を併用した治療とプラチナ製剤併用療法を比較する第Ⅲ相試験(CheckMate9LA試験)が行われた20)。主要評価項目であるOSはHR 0.66(95%CI:0.55-0.80,中央値:15.6カ月vs 10.9カ月)であり,ニボルマブ+イピリムマブ+プラチナ製剤併用療法はプラチナ製剤併用療法に対しOSを有意に延長することが示された。ORRは38% vs 25%であった。また,更新された報告に基づくPD-L1 TPS 50%以上のサブグループ解析では,OSはHR 0.75(95%CI:0.53-1.07,中央値:18.9カ月vs 12.9カ月)であり,良好な生存効果を示した21)。Grade 3/4の毒性の頻度は,ニボルマブ+イピリムマブ+プラチナ製剤併用療法群で高い傾向にあった(48.0% vs 38.1%)。また,ニボルマブ+イピリムマブ+プラチナ製剤併用療法群では血液毒性の頻度が低い一方で,内分泌障害,肺臓炎,皮疹,胃腸障害などの免疫関連の毒性の増加が報告されており,それらの毒性管理には注意が必要である。
なお75歳以上の症例では,試験全体でOSはHR 1.05(95%CI:0.65-1.71,中央値:8.51カ月vs 11.5カ月)となっており,高齢者に限った安全性のデータも示されていないため,これらの併用療法の投与には慎重を期すべきである。
加えて,本邦で行われた第Ⅲ相試験(NIPPON試験)において,試験治療群であるニボルマブ+イピリムマブ+プラチナ製剤併用療法群において,予期していた範囲を超える11/148例(7.4%)の治療関連死が発生した。そのため,同レジメンの安全性を担保して試験を継続することは困難と判断され,試験が中止された。肺臓炎や心筋炎,サイトカイン放出症候群,敗血症,血球貪食症候群が治療関連死亡の原因であり,これらの稀な毒性に特に注意を払いつつ,リスクベネフィットを考慮して本レジメンの使用を検討すべきである。
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,デュルバルマブ+プラチナ製剤併用療法,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法,プラチナ製剤併用療法を3群比較する第Ⅲ相試験(POSEIDON試験)が行われた22)。主要評価項目であるプラチナ製剤併用療法群に対するデュルバルマブ+プラチナ製剤併用療法のOSはHR 0.86(95%CI:0.72-1.02,中央値:13.3カ月vs 11.7カ月)であり,デュルバルマブ+プラチナ製剤併用療法はプラチナ製剤併用療法に対し有意なOSの延長を示せなかった。一方,プラチナ製剤併用療法群に対するデュルバルマブ+トレメリムマブ+プラチナ製剤併用療法のOSはHR 0.77(95%CI:0.65-0.92,中央値:14.0カ月vs 11.7カ月),PFSはHR 0.72(95%CI:0.60-0.86,中央値:6.2カ月vs 4.8カ月)であり,OSとPFSを有意に延長することが示された。ORRは46% vs 33%であった。PD-L1 TPS 50%以上のサブグループ解析でのプラチナ製剤併用療法群に対するデュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群のOSはHR 0.65(95%CI:0.47-0.89,中央値:16.0カ月vs 10.8カ月)であり,良好な生存効果を示した。Grade 3以上の毒性の頻度は,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群で高い傾向にあった(66% vs 61%)。また,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群では血液毒性に加え,内分泌障害,肝機能障害,皮疹などの免疫関連の毒性の増加が報告されており,それらの毒性管理には注意が必要である。
なお,高齢者に限った有効性,安全性のデータは示されていないため,これらの併用療法の投与には慎重を期すべきである。
以上より,治療効果と毒性のバランスを考慮した場合に,PD-L1高発現のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してPD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を選択すべきかどうか小委員会の中でも意見が分かれた。本CQに関して,議論の末に投票を行った結果,PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を推奨するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 55% (16/29) |
7% (2/29) |
24% (7/29) |
14% (4/29) |
7-2-2.ドライバー遺伝子変異/転座陰性,PD-L1 TPS 1~49%の一次治療
樹形図
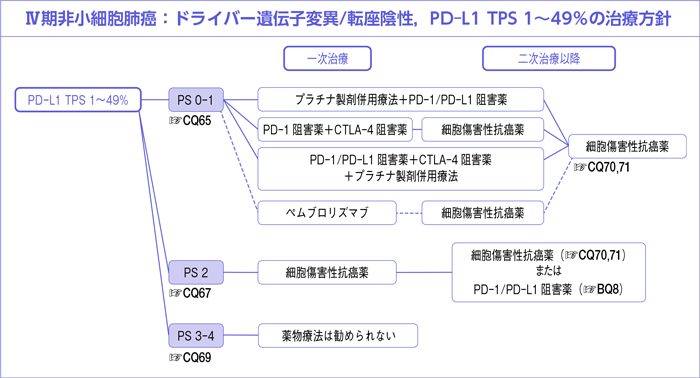
CQ65.
全身状態良好(PS 0-1)なPD-L1 TPS 1~49%に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:89%(推奨率:96%)〕
-
- b.
- ニボルマブ+イピリムマブ併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:68%(推奨率:68%)〕
-
- c.
- PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:61%(推奨率:64%)〕
-
- d.
- ペムブロリズマブ単剤療法を行うよう推奨するだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
-
a-1.非扁平上皮癌
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-189試験)において,プラチナ製剤+PEM療法に対するペムブロリズマブの上乗せはPFS,OSを有意に延長することが示された8)(CQ64)。更新された報告に基づくPD-L1発現別のサブグループ解析では,PD-L1 TPS 1~49%のPFSはHR 0.57(95%CI:0.41-0.80, 中央値:9.4カ月vs 4.9カ月),OSはHR 0.65(95%CI:0.46-0.90, 中央値:21.8カ月vs 12.1カ月)と,PD-L1 TPSが1~49%の症例においてもPFSおよびOSを延長させた9)。ペムブロリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性およびQOLについてはCQ64を参照)。
PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower150試験)において,CBDCA/PTX/ベバシズマブ療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された11)(CQ64)。PD-L1発現別のサブグループ解析では,「TC1/2 or IC1/2」のPFSはHR 0.56(95%CI:0.41-0.77),OSはHR 0.80(95%CI:0.55-1.15)と良好な結果を示した12)。アテゾリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
また,CBDCA+nab-PTX療法にアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower130試験)において,CBDCA+nab-PTX療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された13)(CQ64)。PD-L1発現別のサブグループ解析では,「TC1/2 or IC1/2」のPFSはHR 0.61(95%CI:0.43-0.85),OSはHR 0.70(95%CI:0.45-1.08)と良好な結果を示した。アテゾリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
-
a-2.扁平上皮癌
PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-407試験)において,CBDCA+PTX/nab-PTX療法に対するペムブロリズマブの上乗せはPFSとOSを有意に延長することが示された14)(CQ64)。更新された報告に基づくPD-L1発現別のサブグループ解析では,PD-L1 TPS 1~49%のPFSはHR 0.60(95%CI:0.45-0.81,中央値:8.2カ月vs 6.0カ月),OSはHR 0.61(95%CI:0.45-0.83,中央値:18.0カ月vs 13.1カ月)と,PD-L1 TPSが1~49%の症例においてもPFSおよびOSを延長させた15)。ペムブロリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性およびQOLについてはCQ64を参照)。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療を行うことが勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 89% (25/28) |
7% (2/28) |
4% (1/28) |
0% | 0% |
-
b.EGFR遺伝子変異やALK融合遺伝子のないPD-L1 TPS 1%以上,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブ併用療法,ニボルマブ単剤療法とプラチナ製剤併用療法を3群比較する第Ⅲ相試験(CheckMate227Part1試験)において,ニボルマブ+イピリムマブ併用療法はプラチナ製剤併用療法に対しPFS,OSを延長することが示された17)(CQ64)。一方,更新された報告に基づくPD-L1 TPS 1~49%のサブグループ解析において,プラチナ製剤併用療法群に対するニボルマブ+イピリムマブ併用療法群のOSはHR 0.90(95%CI:0.72-1.12,中央値:15.5カ月vs 15.1カ月)であった18)。ニボルマブ+イピリムマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,プラチナ製剤併用療法に免疫チェックポイント阻害薬を併用した治療が優先される状況において,益と害を鑑みてニボルマブ+イピリムマブ併用療法を考慮してもよい。ただし,PD-L1 TPS 1~49%においてニボルマブ+イピリムマブ併用療法がプラチナ製剤併用療法と比べて生存効果で優れている結果が示されていないことに留意すべきである。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 68% (19/28) |
11% (3/28) |
21% (6/28) |
0% |
-
c.EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブにプラチナ製剤併用療法(2サイクル導入療法)を併用した治療とプラチナ製剤併用療法を比較する第Ⅲ相試験(CheckMate9LA試験)において,ニボルマブ+イピリムマブ+プラチナ製剤併用療法はプラチナ製剤併用療法に対しOSを有意に延長することが示された20)(CQ64)。更新された報告に基づくPD-L1 TPS 1~49%のサブグループ解析では,OSはHR 0.70(95%CI:0.53-0.93,中央値:15.2カ月vs 10.4カ月)と良好な生存効果を示した21)。ニボルマブ+イピリムマブ+プラチナ製剤併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,デュルバルマブ+プラチナ製剤併用療法,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法,プラチナ製剤併用療法を3群比較する第Ⅲ相試験(POSEIDON試験)において,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法はプラチナ製剤併用療法と比較しOSを有意に延長することが示された(CQ64)。PD-L1 TPS 1~49%のサブグループ解析では,プラチナ製剤併用療法群に対するデュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群のPFSはHR 0.54(95%CI:0.39-0.76,中央値:6.4カ月vs 5.0カ月),OSはHR 0.64(95%CI:0.46-0.88,中央値:16.0カ月vs 10.8カ月)と良好な生存効果を示した22)。デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を行うことが勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/28) |
61% (17/28) |
7% (2/28) |
29% (8/28) |
0% |
-
d.EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 1%以上のPS 0-1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤療法とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-042試験)が行われた。探索的評価項目であるPD-L1 TPS 1~49%のサブグループ解析において,OSは更新された報告において,HR 0.88(95%CI:0.75-1.04,中央値:13.4カ月vs 12.1カ月)であり,その生存曲線は交差していた23)。毒性は,CQ64で述べたペムブロリズマブ単剤療法の有害事象と同様であり,これらの毒性管理には注意が必要である。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,プラチナ製剤併用療法に免疫チェックポイント阻害薬を併用した治療が優先される状況において,ペムブロリズマブ単剤療法を行うよう勧めるだけの根拠が明確ではないと判断した。特に,PD-L1 TPS 1~49%においてペムブロリズマブ単剤療法がプラチナ製剤併用療法と比べて生存効果で優れている結果が示されていないことに留意すべきである。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 43% (12/28) |
25% (7/28) |
32% (9/28) |
0% |
7-2-3.ドライバー遺伝子変異/転座陰性,PD-L1 TPS 1%未満の一次治療
樹形図
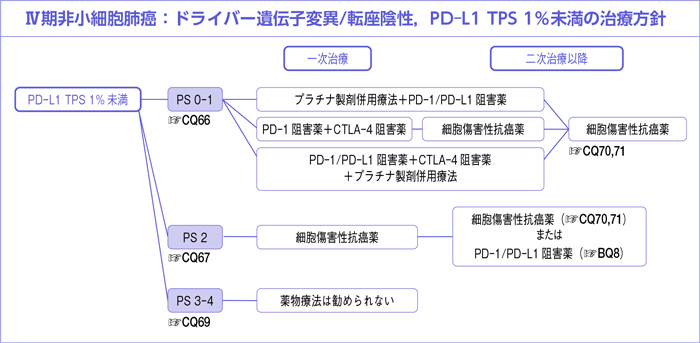
CQ66.
全身状態良好(PS 0-1)なPD-L1 TPS 1%未満に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:75%(推奨率:96%)〕
-
- b.
- ニボルマブ+イピリムマブ併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:75%(推奨率:93%)〕
-
- c.
- PD-1/PD-L1阻害薬+CTLA-4阻害薬にプラチナ製剤併用療法を併用した治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:75%(推奨率:75%)〕
-
a-1.非扁平上皮癌
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-189試験)が行われ,プラチナ製剤+PEM療法に対するペムブロリズマブの上乗せはPFS,OSを有意に延長することが示された8)(CQ64)。更新された報告に基づくPD-L1発現別のサブグループ解析では,PD-L1 TPS 1%未満のPFSはHR 0.67(95%CI:0.49-0.92, 中央値:6.2カ月vs 5.1カ月),OSはHR 0.55(95%CI:0.39-0.76, 中央値:17.2カ月vs 10.2カ月)と,PFSおよびOSを延長させた9)。ペムブロリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性およびQOLについてはCQ64を参照)。
PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower150試験)が行われ,CBDCA/PTX/ベバシズマブ療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された11)(CQ64)。PD-L1発現別のサブグループ解析では,「TC0 and IC0」のPFSはHR 0.77(95%CI:0.61-0.99),OSはHR 0.82(95%CI:0.62-1.08)と,PD-L1の発現がみられない症例においても良好な結果を示し,最終解析においても,OSはHR 0.90(16.9カ月vs 14.1カ月,95%CI:0.71-1.14)であった12)。アテゾリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
また,CBDCA+nab-PTX療法にアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower130試験)において,CBDCA+nab-PTX療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された13)(CQ64)。PD-L1発現別のサブグループ解析では,「TC0 and IC0」のPFSはHR 0.72(95%CI:0.56-0.91),OSはHR 0.81(95%CI:0.61-1.08)と,PD-L1の発現がみられない症例においても良好な結果を示した。アテゾリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
(前述の2試験ではSP142を用いたPD-L1免疫染色でPD-L1発現を評価している)
-
a-2.扁平上皮癌
PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-407試験)が行われ,CBDCA+PTX/nab-PTX療法に対するペムブロリズマブの上乗せはPFSとOSを有意に延長することが示された14)(CQ64)。更新された報告に基づくPD-L1発現別のサブグループ解析においても,PD-L1 TPS 1%未満のPFSはHR 0.70(95%CI:0.52-0.95, 中央値:6.3カ月vs 5.9カ月),OSはHR 0.83(95%CI:0.61-1.13, 中央値:15.0カ月vs 11.0カ月)と良好な傾向がみられた15)。ペムブロリズマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性およびQOLについてはCQ64を参照)。
以上より,PD-L1 TPS 1%未満のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療が勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 75% (21/28) |
21% (6/28) |
0% | 0% | 4% (1/28) |
なお,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用した治療のレジメンの詳細については項末を参照のこと。
-
b.第Ⅲ相試験であるCheckMate227Part1試験の探索的評価としてEGFR遺伝子変異やALK融合遺伝子のないPD-L1 TPS 1%未満,PS 0-1のⅣ期非小細胞肺癌患者を対象に,ニボルマブ+イピリムマブ併用療法,プラチナ製剤併用療法+ニボルマブ療法とプラチナ製剤併用療法の3群を比較した検討が行われた17)(CQ64)。更新された報告に基づくPD-L1 TPS 1%未満におけるニボルマブ+イピリムマブ併用療法群とプラチナ製剤併用療法群の比較において,OSはHR 0.65(95%CI:0.52-0.81,中央値:17.4カ月vs 12.2カ月),PFSはHR 0.75(95%CI:0.59-0.95,中央値:5.1カ月vs 4.7カ月)であり,ニボルマブ+イピリムマブ併用療法はプラチナ製剤併用療法に対しPFS,OSを延長することが示唆された18)。また,ORRは27.3% vs 23.1%であった。ニボルマブ+イピリムマブ併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
なお75歳以上の症例では,PD-L1 TPS 1%未満の集団におけるOSのHRは0.65(95%CI:0.25-1.68,中央値:25.3カ月vs 16.8カ月)であった。一方で,高齢者に限った安全性のデータは示されていない。
以上より,PD-L1 TPS 1%未満のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,ニボルマブ+イピリムマブ併用療法が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 18% (5/28) |
75% (21/28) |
0% | 4% (1/28) |
4% (1/28) |
-
c.EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブにプラチナ製剤併用療法(2サイクル導入療法)を併用した治療とプラチナ製剤併用療法を比較する第Ⅲ相試験(CheckMate9LA試験)が行われ,ニボルマブ+イピリムマブ+プラチナ製剤併用療法はプラチナ製剤併用療法に対しOSを有意に延長することが示された20)(CQ64)。更新された報告に基づくPD-L1 TPS 1%未満のサブグループ解析では,OSはHR 0.67(95%CI:0.51-0.88,中央値:17.7カ月vs 9.8カ月)と良好な生存効果を示した21)。ニボルマブ+イピリムマブ+プラチナ製剤併用療法では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌患者を対象として,デュルバルマブ+プラチナ製剤併用療法,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法,プラチナ製剤併用療法を3群比較する第Ⅲ相試験(POSEIDON試験)において,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法はプラチナ製剤併用療法と比較しOSを有意に延長することが示された(CQ64)。PD-L1 TPS 1%未満のサブグループ解析では,デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群とプラチナ製剤併用療法群のPFSはHR 0.79(95%CI:0.59-1.04,中央値:6.1カ月vs 4.7カ月),OSはHR 0.77(95%CI:0.58-1.00,中央値:12.7カ月vs 11.0カ月)と良好な生存効果を示した22)。デュルバルマブ+トレメリムマブ+プラチナ製剤併用療法群では免疫関連の毒性管理に注意が必要である(主な毒性についてはCQ64を参照)。
以上より,PD-L1 TPS 1%未満のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対する治療法を検討する際には,ニボルマブ+イピリムマブにプラチナ製剤併用療法を併用した治療が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 75% (21/28) |
4% (1/28) |
18% (5/28) |
4% (1/28) |
- 1)
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med. 2016;375(19):1823-33.
- 2)
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Five-year outcomes with pembrolizumab versus chemotherapy for metastatic non-small-cell lung cancer with PD-L1 tumor proportion score ≧50. J Clin Oncol. 2021;39(21):2339-49.
- 3)
- Satouchi M, Nosaki K, Takahashi T, et al. First-line pembrolizumab vs chemotherapy in metastatic non-small-cell lung cancer:KEYNOTE-024 Japan subset. Cancer Sci. 2021;112(12):5000-10.
- 4)
- Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC(KEYNOTE-024):a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-9.
- 5)
- Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042):a randomised, open-label, controlled, phase 3 trial. Lancet. 2019;393(10183):1819-30.
- 6)
- Nosaki K, Saka H, Hosomi Y, et al. Safety and efficacy of pembrolizumab monotherapy in elderly patients with PD-L1-positive advanced non-small-cell lung cancer:Pooled analysis from the KEYNOTE-010, KEYNOTE-024, and KEYNOTE-042 studies. Lung Cancer. 2019;135:188-95.
- 7)
- Herbst RS, Giaccone G, de Marinis F, et al. Atezolizumab for first-line treatment of PD-L1-selected patients with NSCLC. N Engl J Med. 2020;383(14):1328-39.
- 8)
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med. 2018;378(22):2078-92.
- 9)
- Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer:5-year outcomes from the phase 3 KEYNOTE-189 study. J Clin Oncol. 2023;41(11):1992-8.
- 10)
- Garassino MC, Gadgeel S, Esteban E, et al. Patient-reported outcomes following pembrolizumab or placebo plus pemetrexed and platinum in patients with previously untreated, metastatic, non-squamous non-small-cell lung cancer(KEYNOTE-189):a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2020;21(3):387-97.
- 11)
- Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med. 2018;378(24):2288-301.
- 12)
- Socinski MA, Nishio M, Jotte RM, et al. IMpower150 final overall survival analyses for atezolizumab plus bevacizumab and chemotherapy in first-line metastatic nonsquamous NSCLC. J Thorac Oncol. 2021;16(11):1909-24.
- 13)
- West H, McCleod M, Hussein M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130):a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019;20(7):924-37.
- 14)
- Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018;379(21):2040-51.
- 15)
- Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer:5-year update of the phase III KEYNOTE-407 study. J Clin Oncol. 2023;41(11):1999-2006.
- 16)
- Mazieres J, Kowalski D, Luft A, et al. Health-related quality of life with carboplatin-paclitaxel or nab-paclitaxel with or without pembrolizumab in patients with metastatic squamous non-small-cell lung cancer. J Clin Oncol. 2020;38(3):271-80.
- 17)
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med. 2019;381(21):2020-31.
- 18)
- Brahmer JR, Lee JS, Ciuleanu TE, et al. Five-year survival outcomes with nivolumab plus ipilimumab versus chemotherapy as first-line treatment for metastatic non-small-cell lung cancer in CheckMate 227. J Clin Oncol. 2023;41(6):1200-12.
- 19)
- Boyer M, Şendur MAN, Rodríguez-Abreu D, et al. Pembrolizumab plus ipilimumab or placebo for metastatic non-small-cell lung cancer with PD-L1 tumor proportion score ≧50%:randomized, double-blind phase III KEYNOTE-598 study. J Clin Oncol. 2021;39(21):2327-38.
- 20)
- Paz-Ares L, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer(CheckMate 9LA):an international, randomised, open-label, phase 3 trial. Lancet Oncol. 2021;22(2):198-211.
- 21)
- Paz-Ares LG, Ciuleanu TE, Cobo M, et al. First-line nivolumab plus ipilimumab with chemotherapy versus chemotherapy alone for metastatic NSCLC in CheckMate 9LA:3-year clinical update and outcomes in patients with brain metastases or select somatic mutations. J Thorac Oncol. 2023;18(2):204-22.
- 22)
- Johnson ML, Cho BC, Luft A, et al. Durvalumab with or without tremelimumab in combination with chemotherapy as first-line therapy for metastatic non-small-cell lung cancer:the phase III POSEIDON study. J Clin Oncol. 2023;41(6):1213-27.
- 23)
- de Castro G Jr, Kudaba I, Wu YL, et al. Five-year outcomes with pembrolizumab versus chemotherapy as first-line therapy in patients with non-small-cell lung cancer and programmed death ligand-1 tumor proportion score ≥ 1% in the KEYNOTE-042 study. J Clin Oncol. 2023;41(11):1986-91.
7-2-4.ドライバー遺伝子変異/転座陰性,PS 2の一次治療
CQ67.
PS 2に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- 細胞傷害性抗癌薬の治療を行うよう推奨もしくは提案する。
〔単剤療法/推奨の強さ:1,エビデンスの強さ:A,合意率:67%(推奨率:100%)〕
〔カルボプラチン併用療法/推奨の強さ:2,エビデンスの強さ:B,合意率:70%(推奨率:93%)〕
-
- b.
- PD-L1 TPS 50%以上に対して,ペムブロリズマブ単剤療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:81%(推奨率:81%)〕
-
- c.
- プラチナ製剤併用療法に免疫チェックポイント阻害薬を併用した治療を行うよう推奨するだけの根拠が明確ではない。
〔推奨に至る根拠が明確ではない〕
-
a.PS 2は多様な集団であり,標準治療は定まっていない。しかし,薬物療法と緩和治療を比較したメタアナリシスのサブグループにおいて,PSにかかわらず薬物療法によるOSの延長が認められている〔PS 2以上の場合,薬物療法によって1年OS率にして6%(8%から14%)の改善〕1)。
メタアナリシスにおいて第三世代細胞傷害性抗癌薬(DTX,PTX,VNR,GEM)単剤療法は緩和治療に比して1年OS率約7%の改善が示されているが,この中にPS 2以上は約30%含まれていた2)。また,この解析でも取り上げられた3編の試験においてPS 2のサブグループの治療成績が明らかになっており,いずれもOSが延長する傾向が確認されている3)。
以上より,PS 2症例において,第三世代細胞傷害性抗癌薬単剤療法を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 67% (18/27) |
33% (9/27) |
0% | 0% | 0% |
PTX単剤療法とCBDCA+PTX併用療法とを比較した第Ⅲ相試験(CALGB9730試験)においてPS 2のサブグループが報告されており,CBDCA+PTX併用療法はPTX単剤療法に対して1年OS率で優位に上回っていた(18% vs 10%,HR 0.60,95%CI:0.40-0.91)4)。PS 2に対するCBDCA+PTX療法とCDDP+GEM療法とを比較した試験(ECOG1599試験)では,OS中央値は各6.2カ月,6.9カ月と報告され,毒性に関しても忍容可能と考えられた5)。また,CBDCA+GEM併用療法とGEM単剤療法の比較試験が行われ,有意差が認められなかったものの,併用療法群でOS中央値が6.7カ月vs 4.8カ月(P=0.49),PFS中央値が4.1カ月vs 3.0カ月(P=0.36)の延長傾向が示された6)。さらに,PS 2症例を対象としたCBDCA+PEM併用療法とPEM単剤療法の第Ⅲ相試験が報告されている。この試験では第Ⅲ相試験としては登録数が205例と小規模で,扁平上皮癌を含む患者を対象としているなど問題があるが,併用療法群でPFSの有意な延長(HR 0.46,95%CI:0.35-0.63,P<0.001,中央値:5.8カ月vs 2.8カ月),OSの有意な延長(HR 0.62,95%CI:0.46-0.83,P=0.001,中央値:9.3カ月vs 5.3カ月)が示されている。毒性に関しては,併用療法群で貧血や好中球減少が高く,3.9%の治療関連死が認められた7)。
以上より,毒性が忍容可能と思われるPS 2症例に対してはプラチナ製剤併用療法を考慮してもよいと考えられる。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。ただし,PS 2症例に関するエビデンスは限られており,そのほとんどはCBDCA併用レジメン,もしくは通常より減量した用量が用いられていることに注意が必要である。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 22% (6/27) |
70% (19/27) |
0% | 7% (2/27) |
0% |
-
b.KEYNOTE-024試験およびIMpower110試験では,適格基準としてPS 0-1を満たす患者のみが登録されており,PS 2のⅣ期非小細胞肺癌の一次治療でPD-1/PD-L1阻害薬単剤療法を投与した際の有効性は現時点で不明確である。海外で行われたPS 2の症例60例に対するペムブロリズマブ単剤療法の第Ⅱ相試験(PePS2試験)では,一次治療が24例(40%),PD-L1 TPS 50%以上,TPS 1~49%がそれぞれ15例(25%)ずつ含まれていた。PD-L1 TPS 50%以上におけるPFS中央値は12.6カ月,OS中央値は14.6カ月であり,PD-L1 TPS 1~49%におけるPFS中央値は8.3カ月,OS中央値は12.6カ月であったが,限られた症例数での評価である点に留意する必要がある。登録された全体集団において,ペムブロリズマブ単剤の投与によって17例(28%)で治療延期ないしは治療中断を要する毒性が報告された8)。一方で,PS 2に対する細胞傷害性抗癌薬のエビデンスも十分とはいえず,有効性は限定的で毒性も懸念される。ガイドライン検討委員会薬物療法及び集学的治療小委員会では,益と害のバランスを考慮しPD-L1 TPS 50%以上の症例に対しては治療選択肢として加えてよいという意見が多くみられた。
以上より,PS 2のPD-L1 TPS 50%以上のⅣ期非小細胞肺癌に対し投与の是非を慎重に検討したうえで,一次治療においてペムブロリズマブ単剤療法を行うことをエキスパートオピニオンとして提案する。エビデンスの強さはD,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 81% (22/27) |
11% (3/27) |
7% (2/27) |
0% |
-
c.プラチナ製剤併用療法に対するPD-1/PD-L1阻害薬の上乗せを評価した4つの第Ⅲ相試験およびCheckMate9LA試験では,適格基準としてPS 0-1を満たす患者のみが登録されており,PS 2のⅣ期非小細胞肺癌の一次治療でプラチナ製剤併用療法に免疫チェックポイント阻害薬を併用投与した際の臨床成績および安全性は不明である。また,PS 2症例は細胞傷害性抗癌薬の毒性も懸念される患者群であり,さらに免疫チェックポイント阻害薬を併用投与することについては安全性における懸念を払拭できない。
以上より,PS 2のPD-L1高発現のⅣ期非小細胞肺癌に対し一次治療においてプラチナ製剤併用療法に免疫チェックポイント阻害薬を併用した治療を推奨するだけの根拠が明確ではないと判断した。評価できるエビデンスが不足しており,投票は実施していない。
- 1)
- Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010;(5):CD007309.
- 2)
- Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer:a meta-analysis. J Thorac Oncol. 2007;2(9):845-53.
- 3)
- Gridelli C, Ardizzoni A, Le Chevalier T, et al. Treatment of advanced non-small-cell lung cancer patients with ECOG performance status 2:results of an European Experts Panel. Ann Oncol. 2004;15(3):419-26.
- 4)
- Lilenbaum RC, Herndon JE 2nd, List MA, et al. Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer:the cancer and leukemia group B(study 9730). J Clin Oncol. 2005;23(1):190-6.
- 5)
- Langer C, Li S, Schiller J, et al. Randomized phase II trial of paclitaxel plus carboplatin or gemcitabine plus cisplatin in Eastern Cooperative Oncology Group performance status 2 non-small-cell lung cancer patients:ECOG 1599. J Clin Oncol. 2007;25(4):418-23.
- 6)
- Kosmidis PA, Dimopoulos MA, Syrigos K, et al. Gemcitabine versus gemcitabine-carboplatin for patients with advanced non-small cell lung cancer and a performance status of 2:a prospective randomized phase II study of the Hellenic Cooperative Oncology Group. J Thorac Oncol. 2007;2(2):135-40.
- 7)
- Zukin M, Barrios CH, Pereira JR, et al. Randomized phase III trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol. 2013;31(23):2849-53.
- 8)
- Middleton G, Brock K, Savage J, et al. Pembrolizumab in patients with non-small-cell lung cancer of performance status 2(PePS2):a single arm, phase 2 trial. Lancet Respir Med. 2020;8(9):895-904.
- 7-3
- PS不良例に対する一次治療
CQ68.
PS不良のドライバー遺伝子変異/転座陽性例に,各々のドライバー遺伝子に対する標的療法は勧められるか?
- 推 奨
-
- a.
- ドライバー遺伝子変異/転座を有するPS 2の患者に,それぞれの遺伝子変異/転座を標的とする治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:96%〕
-
- b.
- ドライバー遺伝子変異/転座を有するPS 3-4の患者に,それぞれの遺伝子変異/転座を標的とする治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:93%〕
-
a.EGFR遺伝子変異陽性やALK融合遺伝子陽性の患者を対象とした細胞傷害性抗癌薬との比較試験にもPS 2の患者が5~10%程度含まれており,PS 0-1と同等の有効性が示されている1)2)3)4)。また,EGFR遺伝子変異陽性の患者に対するゲフィチニブや,ALK融合遺伝子陽性の患者に対するアレクチニブはPS不良例に対する有効性が報告されている5)6)。
PS 2のEGFRのuncommon mutation,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異,RET融合遺伝子,KRAS遺伝子G12C変異,NTRK融合遺伝子,HER2遺伝子変異陽性例に関するデータは患者数が少ないために限られているが,EGFRやALKの結果を鑑みて,それぞれのドライバー遺伝子変異/転座を標的とする治療を行うよう推奨される。
以上より,ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET,RET,KRAS,NTRK,HER2)変異/転座を有するPS 2の患者には,それぞれの遺伝子変異/転座を標的とする治療が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 96% (27/28) |
4% (1/28) |
0% | 0% | 0% |
-
b.PS 3-4のEGFR遺伝子変異陽性の患者を対象としたゲフィチニブや,ALK融合遺伝子陽性の患者を対象としたアレクチニブはPS不良例に対する有効性が報告されており,患者数はそれぞれ22例,6例と少ないが,安全性について大きな問題は認められなかった5)6)。なお,ゲフィチニブの検討ではORRが66%,79%の患者でPSの改善を認めており,アレクチニブの検討では6例中のすべての症例でPSの改善を認めている。
PS 3-4のROS1融合遺伝子,EGFRのuncommon mutation,BRAF遺伝子変異,MET遺伝子変異,RET融合遺伝子,KRAS遺伝子G12C変異,NTRK融合遺伝子,HER2遺伝子変異陽性例に関するデータはPS 2よりもさらに限られているが,PS 2と同様に有効性が期待され得る。一方,それぞれの遺伝子変異/転座を標的とする治療によって有害事象の頻度やプロファイルは様々であり,全身状態良好例においてさえも高い頻度で休薬・減量を必要とする薬剤が存在するため,PS 3-4で用いる場合はより一層の注意が必要である。
以上より,ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET,RET,KRAS,NTRK,HER2)変異/転座を有するPS 3-4の患者には,それぞれの遺伝子変異/転座を標的とする治療が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 7% (2/28) |
93% (26/28) |
0% | 0% | 0% |
CQ69.
PS 3-4の患者(ドライバー遺伝子変異/転座陰性,PD-L1発現は問わない)に薬物療法は勧められるか?
- 推 奨
- 薬物療法を行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:D,合意率:100%〕
PS 3-4症例(ドライバー遺伝子変異/転座陰性,PD-L1発現は問わない)に対する細胞傷害性抗癌薬を用いた治療は,一般に適応がない。PD-1/PD-L1阻害薬を用いた治療はPS良好例(PS 0-1)を中心に臨床試験が行われているため,PS不良例のエビデンスは乏しく,安全性も不明であることから細胞傷害性抗癌薬と同様にPS 3-4についてのPD-1/PD-L1阻害薬療法も推奨されない。エルロチニブ療法について,PS不良や合併症のため細胞傷害性抗癌薬の適応とならない進行非小細胞肺癌に対してエルロチニブ単剤療法と緩和治療の第Ⅲ相試験(TOPICAL試験)が行われた7)。患者背景として,年齢中央値77歳,PS 3が30%を占め,EGFR遺伝子変異については陰性,不明がそれぞれ52%,46%であった。組織型では,扁平上皮癌と非扁平上皮癌が各40%,60%含まれていた。この試験において,主要評価項目であるOSの延長は認められなかった(HR 0.94,95%CI:0.81-1.10,P=0.46,中央値:エルロチニブ単剤療法群3.7カ月vs プラセボ群3.6カ月)。
以上より,PS 3-4の患者(ドライバー遺伝子変異/転座陰性,PD-L1発現は問わない)に対する薬物療法は行わないよう推奨される。エビデンスの強さはD,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 0% | 0% | 100% (25/25) |
- 1)
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011;12(8):735-42.
- 2)
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012;13(3):239-46.
- 3)
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014;371(23):2167-77.
- 4)
- Wu YL, Lu S, Lu Y, et al. Results of PROFILE 1029, a phase III comparison of first-line crizotinib versus chemotherapy in East Asian patients with ALK-positive advanced non-small cell lung cancer. J Thorac Oncol. 2018;13(10):1539-48.
- 5)
- Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009;27(9):1394-400.
- 6)
- Iwama E, Goto Y, Murakami H, et al. Alectinib for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017;12(7):1161-6.
- 7)
- Lee SM, Khan I, Upadhyay S, et al. First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy(TOPICAL):a double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2012;13(11):1161-70.
- 7-4
- 二次治療以降
CQ70.
PS 0-2に対して二次治療以降で細胞傷害性抗癌薬は勧められるか?
- 推 奨
- ドセタキセル±ラムシルマブ療法,ペメトレキセド単剤療法,S-1単剤療法,ナブパクリタキセル単剤療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
※PEMは非扁平上皮癌への投与に限定。
-
〈ドセタキセル単剤療法〉
プラチナ製剤を含む薬物療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤療法の第Ⅲ相試験が2編報告されている。1つはDTX単剤療法(100mg/m2 or 75mg/m2)vs VNR単剤療法or IFM単剤療法の比較試験(TAX320試験)で,OSでは有意差を認めないもののDTX 75mg/m2療法群で対照群と比較してORR,26週PFS率,1年OS率の有意な改善を認めた1)。また,DTX単剤療法(100mg/m2 or 75mg/m2)と緩和治療の比較ではOS中央値と1年OS率は,DTX 75mg/m2療法群,緩和治療群でそれぞれ7.5カ月と37%,4.6カ月と19%で,DTX単剤療法群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた2)。いずれの試験においても,DTX 75mg/m2療法群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞肺癌の薬物療法としてはDTX 75mg/m2療法の有用性が確立された。本邦における推奨用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,OS中央値7.8カ月と上記2編の第Ⅲ相試験のDTX 75mg/m2療法と同等の効果を有する結果を報告した3)。
-
〈ドセタキセル+ラムシルマブ療法〉
CQ71参照
-
〈ペメトレキセド単剤療法〉
Ⅳ期非小細胞肺癌の二次治療におけるPEM単剤療法とDTX単剤療法の第Ⅲ相試験(JMEI試験)が報告され,ORR,OS中央値はPEM単剤療法群で9.1%,8.3カ月,DTX単剤療法群で8.8%,7.9カ月であり,主要評価項目であるOSで非劣性は証明されなかったが,同等の効果(HR 0.99,95%CI:0.80-1.20,P=0.226)が報告された。毒性に関しては,Grade 3/4の好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がDTX単剤療法群で有意に高かった4)。同試験を組織学的に後方視的解析した結果,OS中央値は非扁平上皮癌でそれぞれ9.3カ月と8.0カ月(HR 0.78,95%CI:0.61-1.00,P=0.047)と有意差を認めた。また,PFSにおいても中央値は非扁平上皮癌でそれぞれ3.1カ月と3.0カ月(HR 0.82,95%CI:0.66-1.02,P=0.076)と有意差を認めなかったが,治療効果はほぼ同等であった5)。一方,毒性に関しては,Grade 3以上の発熱性好中球減少(1.9% vs 12.7%),好中球減少(5.3% vs 40.2%),好中球減少に伴った感染(0.0% vs 3.3%)の発現頻度は有意に少なく,ALT上昇(1.9% vs 0.0%)の頻度は有意に高いと違いを認めたが,QOLに関しては差を認めなかった。
-
〈S-1単剤療法〉
プラチナ既治療のⅣ期非小細胞肺癌,PS 0-2の二次もしくは三次治療例を対象とし,S-1単剤療法とDTX単剤療法を比較する第Ⅲ相試験(EAST-LC試験)が本邦を含むアジアで行われた。主要評価項目であるOSは非劣性を示すことが目的であり,OS中央値はS-1単剤療法群で12.75カ月,DTX単剤療法群で12.52カ月(HR 0.945,95%CI:0.833-1.073)で,DTX単剤療法に対するS-1単剤療法の非劣性が示された。またPFS中央値はS-1単剤療法群2.9カ月,DTX単剤療法群2.9カ月(HR 1.03,95%CI:0.91-1.17)で両群に差を認めず,ORRはS-1単剤療法群8.3%,DTX単剤療法群9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった6)。
-
〈ナブパクリタキセル単剤療法〉
プラチナ既治療のⅣ期非小細胞肺癌,PS 0-1の二次もしくは三次治療例を対象とし,nab-PTX単剤療法とDTX単剤療法を比較する第Ⅲ相試験(J-AXEL試験)が本邦で行われた7)。主要評価項目であるOSは非劣性を示すことが目的であり,OS中央値はnab-PTX単剤療法群で16.2カ月,DTX単剤療法群で13.6カ月(HR 0.85,95.2%CI:0.68-1.07)で,DTX単剤療法に対するnab-PTX単剤療法の非劣性が示された。またPFS中央値はnab-PTX単剤療法群4.2カ月,DTX単剤療法群3.4カ月(HR 0.76,95%CI:0.63-0.92),ORRはnab-PTX単剤療法群29.9%,DTX単剤療法群15.4%であった。毒性に関しては,Grade 3以上の白血球減少,好中球減少の頻度はDTX群で高く(25.7% vs 65.9%,39.6% vs 83.1%),発熱性好中球減少の頻度もDTX群で高かった(2.0% vs 22.1%)。一方でGrade 3以上の末梢神経障害の頻度はnab-PTX群で高かった(9.8% vs 0.8%)。
以上より,一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対してDTX±ラムシルマブ療法,S-1単剤療法,ナブパクリタキセル単剤療法,(非扁平上皮癌の場合)PEM単剤療法の投与を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (23/23) |
0% | 0% | 0% | 0% |
CQ71.
二次治療でドセタキセルを用いる場合にラムシルマブの併用は勧められるか?
- 推 奨
-
- a.
- ラムシルマブの適応となるPS 0-1症例に対して,ドセタキセルにラムシルマブを併用した治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:74%〕
-
- b.
- 75歳以上の症例に対して,ドセタキセルにラムシルマブを併用した治療を行わないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:78%〕
-
- c.
- PS 2症例に対して,ドセタキセルにラムシルマブを併用した治療を行わないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:87%〕
-
a.プラチナ製剤併用療法後に進行したPS 0-1の進行非小細胞肺癌症例を対象とし,DTX+ラムシルマブ併用療法とDTX単剤療法を比較する第Ⅲ相試験(REVEL試験)が行われ,主要評価項目であるOSは,ラムシルマブ併用療法群で有意な延長を認めた(HR 0.86,95%CI:0.75-0.98,P=0.023,中央値:10.5カ月vs 9.1カ月)。また,ラムシルマブ併用療法群において,PFS(HR 0.76,95%CI:0.68-0.86,P<0.0001,中央値:4.5カ月vs 3.0カ月),ORR(23% vs 14%,P<0.0001)も有意に良好であった。毒性に関しては,ラムシルマブ併用療法群でGrade 3/4の好中球減少,発熱性好中球減少,全Gradeの血小板減少,口内炎がより高頻度であったが,Grade 3以上の高血圧は6%で出血性イベントの多くはGrade 1/2であった8)。
また本邦において,DTX+ラムシルマブ併用療法とDTX単剤療法のランダム化比較第Ⅱ相試験(JVCG試験)が行われ,ラムシルマブ併用療法群においてPFS(HR 0.83,95%CI:0.59-1.16,中央値:5.2カ月vs 4.2カ月),OS(HR 0.77,95%CI:0.56-1.32,中央値:15.2カ月vs 13.9カ月),ORR(28.9% vs 18.5%)ともに良好な結果が示された。毒性に関しては,ラムシルマブ併用療法群において発熱性好中球減少の頻度が高く(34% vs 19%),低アルブミン血症,血小板減少,口内炎,鼻出血,蛋白尿などもDTX単剤療法よりも高頻度であったが,ほとんどはGrade 1/2であった9)。ラムシルマブの投与においてもベバシズマブと同様に出血リスクには注意が必要であり,投与に際してはその適応を十分検討する必要がある。
以上より,ラムシルマブは適応と考えられる症例においてDTXに併用した治療を行うよう勧められる。エビデンスの強さはB,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 26% (6/23) |
74% (17/23) |
0% | 0% | 0% |
-
b.75歳以上
前述の第Ⅲ相試験(REVEL試験)における75歳以上のサブグループは不明である。また,本邦において実施された第Ⅱ相試験(JVCG試験)でも75歳以上の症例は10例と少数であるため75歳以上の高齢者に対するラムシルマブ併用療法の安全性や有効性に関してのデータは十分ではない。一次治療においても,75歳以上に対してプラチナ製剤併用療法にラムシルマブと同じ血管新生阻害薬であるベバシズマブを併用した治療の有効性は限定的で,かつ毒性が高まることが知られている(BQ3参照)。ラムシルマブ併用療法についても若年者を中心とした本邦の第Ⅱ相試験において発熱性好中球減少をはじめとした毒性の増強が懸念されることを考えると,現時点で高齢者にラムシルマブを併用した治療を行う根拠は明確ではない。エビデンスの強さはD,また総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 9% (2/23) |
9% (2/23) |
78% (18/23) |
4% (1/23) |
-
c.PS 2
前述のREVEL試験,JVCG試験においては対象症例がPS 0-1であり8)9),PS 2に対するラムシルマブ併用療法の安全性や有効性に関してのデータはない。よって,PS 2に対するラムシルマブを併用した治療は行うよう勧めるだけの根拠が明確ではない。PS 0-1を対象とした試験では,ラムシルマブ併用療法群で発熱性好中球減少の発現頻度が高く,PS不良例においてはラムシルマブの併用療法により毒性の悪化が懸念される。
以上より,益と害のバランスを考慮し現時点では行わないよう勧められる。エビデンスの強さはD,ただし総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨に至る根拠が明確ではない | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 9% (2/23) |
87% (20/23) |
4% (1/23) |
- 1)
- Fossella FV, DeVore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol. 2000;18(12):2354-62.
- 2)
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol. 2000;18(10):2095-103.
- 3)
- Mukohara T, Takeda K, Miyazaki M, et al. Japanese experience with second-line chemotherapy with low-dose(60mg/M2)docetaxel in patients with advanced non-small-cell lung cancer. Cancer Chemother Pharmacol. 2001;48(5):356-60.
- 4)
- Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol. 2004;22(9):1589-97.
- 5)
- Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology:a review of two Phase III studies. Oncologist. 2009;14(3):253-63.
- 6)
- Nokihara H, Lu S, Mok TSK, et al. Randomized controlled trial of S-1 versus docetaxel in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy(East Asia S-1 Trial in Lung Cancer). Ann Oncol. 2017;28(11):2698-706.
- 7)
- Yoneshima Y, Morita S, Ando M, et al. Phase 3 trial comparing nanoparticle albumin-bound paclitaxel with docetaxel for previously treated advanced NSCLC. J Thorac Oncol. 2021;16(9):1523-32.
- 8)
- Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy(REVEL):a multicentre, double-blind, randomised phase 3 trial. Lancet. 2014;384(9944):665-73.
- 9)
- Yoh K, Hosomi Y, Kasahara K, et al. A randomized, double-blind, phase II study of ramucirumab plus docetaxel vs placebo plus docetaxel in Japanese patients with stage IV non-small cell lung cancer after disease progression on platinum-based therapy. Lung Cancer. 2016;99:186-93.
- 7-5
- Background Question/Evidence
7-5-1.ドライバー遺伝子変異/転座陽性
EGFR遺伝子変異陽性の一次治療(エクソン19欠失またはL858R変異陽性)
BQ1
PS 0-1の場合,一次治療としてEGFR-TKIが勧められるか?
- EGFR-TKI単剤療法はプラチナ製剤併用療法と比較して無増悪生存期間の延長が示されている。
〔エビデンスの強さ:A〕
EGFR遺伝子変異の約90%を占めるエクソン19の欠失変異とエクソン21のL858R変異は,EGFR-TKIの感受性を高める。進行非小細胞肺癌を対象にしたEGFR-TKI単剤療法(ゲフィチニブ,エルロチニブ,アファチニブ)とプラチナ製剤併用療法の第Ⅲ相試験におけるEGFR遺伝子変異の患者はエクソン19の欠失変異とL858R変異に限定されているか1)~3),大部分を占めていた4)~6)。すべての試験において一貫してEGFR-TKI単剤療法のプラチナ製剤併用療法に対するPFSの有意な延長が報告され,QOL指標の一部が改善することも示されている7)8)。
第一世代のEGFR-TKI単剤療法同士を直接比較した第Ⅲ相試験で優越性が示されたものはない9)。また,ランダム化第Ⅱ相試験(LUX-Lung7試験)では,第二世代EGFR-TKIであるアファチニブ単剤療法がゲフィチニブ単剤療法に対して,PFSの延長を示したものの,毒性はより高度であった10)。
以上より,EGFR遺伝子変異陽性(エクソン19欠失またはL858R変異陽性)例の一次治療としてのゲフィチニブ,エルロチニブ,アファチニブなどのEGFR-TKI単剤療法は,プラチナ製剤併用療法と比較した場合の有効性のエビデンスが確立されており,エビデンスの強さはAと評価される。
ALK融合遺伝子陽性の一次治療
BQ2
PS 0-1の場合,一次治療としてALK-TKIが勧められるか?
- ALK-TKI単剤療法はプラチナ製剤併用療法と比較して無増悪生存期間の延長が示されている。
〔エビデンスの強さ:A〕
ALK融合遺伝子陽性の患者に対してALK-TKI単剤療法とプラチナ製剤併用療法を比較した第Ⅲ相試験では,すべての試験において一貫してALK-TKI単剤療法のプラチナ製剤併用療法に対するPFSの有意な延長が報告され,QOL指標の一部においてALK-TKI単剤療法のほうがプラチナ製剤併用療法より優れることが示されている11)~13)。
ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,クリゾチニブ単剤療法とプラチナ製剤併用療法を比較した2つの第Ⅲ相試験(PROFILE1014試験,PROFILE1029試験)が行われ, ともにクリゾチニブ単剤療法のプラチナ製剤併用療法に対するPFSの有意な延長が報告されている11)13)。クリゾチニブ単剤療法の主な毒性は,視覚障害,下痢や悪心などの消化器毒性,肝機能障害が挙げられる。また,ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,セリチニブ単剤療法とプラチナ製剤併用療法を比較した第Ⅲ相試験(ASCEND-4試験)においても,セリチニブ単剤療法のプラチナ製剤併用療法に対するPFSの有意な延長が認められた12)。
以上より,ALK融合遺伝子陽性例の一次治療としてのクリゾチニブ,セリチニブなどのALK-TKI単剤療法は,プラチナ製剤併用療法と比較した場合の有効性のエビデンスが確立されており,エビデンスの強さはAと評価される。
- 1)
- Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label, randomised phase 3 trial. Lancet Oncol. 2010;11(2):121-8.
- 2)
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011;12(8):735-42.
- 3)
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012;13(3):239-46.
- 4)
- Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010;362(25):2380-8.
- 5)
- Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013;31(27):3327-34.
- 6)
- Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6):an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15(2):213-22.
- 7)
- Oizumi S, Kobayashi K, Inoue A, et al. Quality of life with gefitinib in patients with EGFR-mutated non-small cell lung cancer:quality of life analysis of North East Japan Study Group 002 Trial. Oncologist. 2012;17(6):863-70.
- 8)
- Wu YL, Hirsh V, Sequist LV, et al. Does EGFR mutation type influence patient-reported outcomes in patients with advanced EGFR mutation-positive non-small-cell lung cancer? Analysis of two large, phase III studies comparing afatinib with chemotherapy(LUX-Lung 3 and LUX-Lung 6). Patient. 2018;11(1):131-41.
- 9)
- Yang JJ, Zhou Q, Yan HH, et al. A phase III randomised controlled trial of erlotinib vs gefitinib in advanced non-small cell lung cancer with EGFR mutations. Br J Cancer. 2017;116(5):568-74.
- 10)
- Park K, Tan EH, O'Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer(LUX-Lung 7):a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016;17(5):577-89.
- 11)
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014;371(23):2167-77.
- 12)
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer(ASCEND-4):a randomised, open-label, phase 3 study. Lancet. 2017;389(10072):917-29.
- 13)
- Wu YL, Lu S, Lu Y, et al. Results of PROFILE 1029, a phase III comparison of first-line crizotinib versus chemotherapy in east asian patients with alk-positive advanced non-small cell lung cancer. J Thorac Oncol. 2018;13(10):1539-48.
7-5-2.一次治療レジメン
BQ3
75歳未満に対する一次治療においてプラチナ製剤併用療法は勧められるか?
- プラチナ製剤と第三世代以降の細胞傷害性抗癌薬を併用した治療は有効性のエビデンスが確立している。
〔エビデンスの強さ:A〕
※PEMは非扁平上皮癌への投与が推奨される。
※ネダプラチン(NDP/CDGP)は扁平上皮癌への投与が推奨される。
メタアナリシスによってプラチナ製剤(CDDPもしくはCBDCA)を含む治療が緩和治療に対して有意にOSの延長に寄与していることが示されている1)。また,プラチナ製剤併用の薬剤を第二世代と第三世代細胞傷害性抗癌薬で比較したメタアナリシスにおいて,後者がORRで12%,1年OS率で6%優ると報告されている2)。本邦では,4種類の第三世代細胞傷害性抗癌薬とプラチナ製剤併用の第Ⅲ相試験(FACS試験)の結果が報告されており,いずれの治療効果も同等であった3)。
新規薬剤においても,複数の第Ⅲ相試験によって有効性が示されているが,いくつかの薬剤は特定の組織型に対してのみ有効性が示されている。PEMはそのような薬剤の1つであり,非扁平上皮癌に対して用いられる。CDDP+PEM療法とCDDP+GEM療法の第Ⅲ相試験(JMDB試験)が行われ,全体では同等の治療効果であったが組織型による差が認められ,非扁平上皮癌においてはCDDP+PEM療法群でOSの有意な延長(HR 0.81,95%CI:0.70-0.94,P=0.005,中央値:11.8カ月vs 10.4カ月)を認めた一方で,扁平上皮癌においてはCDDP+PEM療法群でPFS(HR 1.36,95%CI:1.12-1.65,P=0.002,中央値:4.4カ月vs 5.5カ月),OS(HR 1.23,95%CI:1.00-1.51,P=0.05,中央値:9.4カ月vs 10.8カ月)ともに劣っていた4)。サブグループ解析ではあるが,有効性ならびに毒性の観点から非扁平上皮癌に対するCDDP+PEM療法は至適レジメンの1つである。また,CBDCA+PEM療法はOSを主要評価項目とした比較試験がないものの,患者が自覚する毒性がCDDPよりも軽度であることから実地臨床では頻用されている。CBDCA+PEM療法とCBDCA+GEM療法,CBDCA+DTX療法やCBDCA+PTX+ベバシズマブ療法との比較試験では,OSや主要評価項目であった有害事象などで優越性を示せていない5)~7)。しかしながら,CBDCA+PTX+ベバシズマブ療法と比較しても生存曲線に大きな差はなく7),ベバシズマブを併用した試験ではCBDCA+PTX+ベバシズマブ療法よりPFSが上回る傾向にある8)。
扁平上皮癌に対しては,ネダプラチン(NDP/CDGP)+DTX療法とCDDP+DTX療法の第Ⅲ相試験(WJOG5208L試験)が本邦で実施され,OSの有意な延長が認められた(HR 0.81,95%CI:0.65-1.02,P=0.037,中央値:13.6カ月vs 11.4カ月)。毒性はプロファイルが異なり,NDP/CDGP療法群では白血球減少,好中球減少,血小板減少が多く,CDDP療法群では悪心,倦怠感,低ナトリウム血症,低カリウム血症が多かった。本邦において第三世代以降の細胞傷害性抗癌薬併用で唯一の優越性が示された有望なレジメンである9)。
その他,S-1の有効性を評価した2編の第Ⅲ相試験(LETS試験,CATS試験)では,CBDCA+S-1療法はCBDCA+PTX療法に対して,CDDP+S-1療法はCDDP+DTX療法に対して非劣性が示された10)11)。ヒト血清アルブミンとPTXを結合させたナノ粒子製剤であるnab-PTXとCBDCAの併用療法はCBDCA+PTX療法との第Ⅲ相試験において,有意にORRの上昇を認めた(33.0% vs 25.0%)12)。これらのレジメンは組織型にかかわらず使用可能である。
以上より,複数の臨床試験においてプラチナ製剤と第三世代以降の細胞傷害性抗癌薬を併用した治療の有効性は確立されており,エビデンスの強さはAと評価される(☞2018年版CQ64参照)。各レジメンに固有の毒性プロファイルが報告されており,これらも踏まえて選択するべきと考えられる。
BQ4
75歳以上に対する一次治療においてプラチナ製剤併用療法は勧められるか?
- 75歳以上に対するプラチナ製剤併用療法は有効性のエビデンスが確立している。
〔エビデンスの強さ:A〕
※PEMは非扁平上皮癌への投与が推奨される。
一次薬物療法の第Ⅲ相試験と術後補助療法を対象とした検討では,65歳以上と以下で治療効果の差は認めず,暦年齢よりも日常生活自立度が予後に関係していた13)。また,80歳以上でもPS 0-1と良好なものは80歳以下と比べて,OSにおいて80歳以上で7カ月,80歳未満で11カ月(P=0.20)とOSに有意な差がなく,毒性についても明らかな差を認めなかったと報告されている14)。以上より,暦年齢のみで薬物療法の対象外とするべきではない。
高齢者を対象とした第三世代細胞傷害性抗癌薬単剤療法とCBDCA併用療法を比較した第Ⅲ相試験が3編報告されている。
海外で行われた第Ⅲ相試験(IFCT0501試験)では,70~89歳の患者を対象にCBDCA+weekly PTX併用療法とGEM単剤療法もしくはVNR単剤療法の比較が行われ,併用療法群でPFSの有意な延長(HR 0.51,95%CI:0.42-0.62,P<0.0001,中央値:6.0カ月vs 2.8カ月),OSの有意な延長(HR 0.64,95%CI:0.52-0.78,P<0.0001,中央値:10.3カ月vs 6.2カ月)が示された15)。しかし,この試験においては併用療法群における治療関連死が4.4%と高いなどの問題点が指摘されており,投与量も本邦における標準的なものとは異なっているなどデータの解釈には注意を要する。
本邦において,75歳以上,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象とした第Ⅲ相試験(JCOG1210/WJOG7813L試験)が行われ16),CBDCA+PEM併用療法(PEMの維持療法あり)とDTX単剤療法の比較結果が報告された。主要評価項目はCBDCA+PEM併用療法群のDTX単剤療法群に対するOS(非劣性)であり,OSのHRは0.850(95%CI:0.684-1.056,中央値:18.7カ月vs 15.5カ月)であったことから非劣性が証明された。しかしながら,CBDCA+PEM併用療法群のDTX単剤療法群に対する優越性は示されなかった。またPFSにおいては,HR 0.739(95%CI:0.609-0.896,P<0.01)とCBDCA+PEM併用療法群で有意に延長させることが示された。Grade 3以上の毒性は,CBDCA+PEM併用療法群で血小板減少と貧血が多く,DTX単剤療法群で好中球減少と発熱性好中球減少が多かった。
さらに本邦において,70歳以上,PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象とした第Ⅲ相試験(CAPITAL試験)が行われ17),CBDCA+nab-PTX併用療法とDTX単剤療法の比較結果が報告された。CBDCA+nab-PTX療法の併用期間は最大6サイクルまでとされ,その後はnab-PTXの維持療法が許容された。主要評価項目であるOSの有意な延長が証明され(HR 0.52,95%CI:0.38-0.70,P<0.001,中央値:16.9カ月vs 10.9カ月),またPFSにおいてもHR 0.42(95%CI:0.30-0.58,P<0.001,中央値:5.8カ月vs 4.0カ月)とCBDCA+nab-PTX併用療法群で有意に延長させることが示された。本試験は75歳未満/以上が割付調整因子の1つに設定され,半数以上を占めた75歳以上のサブグループ解析においても,PFS(HR 0.46,95%CI:0.31-0.68)とOS(HR 0.58,95%CI:0.37-0.90)で,ともにCBDCA+nab-PTX併用療法群で良好な結果であった。Grade 3以上の毒性は,CBDCA+nab-PTX併用療法群で貧血と血小板減少が多く,DTX単剤療法群で白血球減少,好中球減少と発熱性好中球減少が多かった。また,Grade 2以上の末梢神経障害はCBDCA+nab-PTX併用療法群で15.8%に認めたが,DTX単剤療法群では1%であった。治療関連死はCBDCA+nab-PTX併用療法群で2例(2.1%),DTX単剤療法群で1例(1.0%)であった。
以上より,PS 0-1,75歳以上の非小細胞肺癌症例に対しては,CBDCA併用療法の有効性は確立されており,エビデンスの強さはAと評価される(☞2021年版CQ69a参照)。
BQ5
非扁平上皮癌においてプラチナ製剤併用療法を受ける場合にベバシズマブの上乗せは勧められるか?
-
- a.
- ベバシズマブの適応となる75歳未満,PS 0-1症例に対して,プラチナ製剤併用療法にベバシズマブを併用した治療は有効性のエビデンスが確立している。
〔エビデンスの強さ:A〕
-
- b.
- 75歳以上の症例に対して,ベバシズマブを併用した治療は有効性のエビデンスが限定的である。
〔エビデンスの強さ:C〕
-
- c.
- PS 2症例に対して,ベバシズマブを併用した治療は有効性のエビデンスが明確ではない。
〔エビデンスの強さ:D〕
※ベバシズマブは扁平上皮癌への投与は行わない。
-
a.ベバシズマブの適応となる75歳未満,PS 0-1
メタアナリシスでは,プラチナ製剤併用療法にベバシズマブを追加することでORRの上昇,PFSの延長が示されており,OSについても延長が認められたとする報告がある18)19)。一方で,ベバシズマブの併用でGrade 3以上の毒性(蛋白尿,高血圧,出血性イベント,好中球減少,発熱性好中球減少,治療関連死)の有意な増加が報告されている18)~20)。
出血リスクに関しては,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血,コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており,ベバシズマブの投与に際してはその適応を十分に検討する必要がある20)。
CBDCA+PTX療法にベバシズマブを追加することの有効性を評価した第Ⅲ相試験(ECOG4599試験)では,ベバシズマブ併用療法群でORRの上昇,PFSの有意な延長(HR 0.66,95%CI:0.57-0.77,P<0.001,中央値:6.2カ月vs 4.5カ月)ならびにOSの有意な延長(HR 0.79,95%CI:0.67-0.92,P=0.003,中央値:12.3カ月vs 10.3カ月)を認めた21)。一方,CDDP+GEM療法にベバシズマブを追加した第Ⅲ相試験(AVAiL試験)においては,PFSは有意に延長したがOSでは有意な延長を認めなかった22)。本邦ではCBDCA+PTX療法にベバシズマブを追加するランダム化第Ⅱ相試験(JO19907試験)が行われ,併用群においてORRの上昇(60.7% vs 31.0%,P=0.0013),PFSの延長(HR 0.61,95%CI:0.42-0.89,P=0.0090,中央値:6.9カ月vs 5.9カ月)を認め,新たな毒性を認めなかったが,OSについては有意な延長を認めなかった(HR 0.99,95%CI:0.65-1.50,P=0.9526,中央値:22.8カ月vs 23.4カ月)23)。中国において同じレジメンを比較した第Ⅲ相試験(BEYOND試験)では,ベバシズマブを一次治療以後も継続することが可能なデザインであったが,PFSの有意な延長(HR 0.40,95%CI:0.29-0.54,P<0.001,中央値:9.2カ月vs 6.5カ月)と,OSの有意な延長(HR 0.68,95%CI:0.50-0.93,P=0.0154,中央値:24.3カ月vs 17.7カ月)が認められた24)。
以上より,ベバシズマブの適応となる75歳未満,PS 0-1症例に対してプラチナ製剤併用療法を用いる際にはベバシズマブを追加投与することの有効性は確立されており,エビデンスの強さはAと評価される(☞2018年版CQ69a参照)。なお,ベバシズマブの投与については,その薬剤の特性からプラチナ製剤併用療法の終了後,病勢進行もしくは毒性中止まで投与を継続する方法が一般的である21)~24)。
-
b.75歳以上
高齢者におけるプラチナ製剤併用療法+ベバシズマブについて,ECOG4599試験におけるサブグループ解析で70歳以上の高齢者では治療効果の上乗せは認められず,若年に比してGrade 3以上の好中球減少,出血,蛋白尿が多かったとされている25)。その後に報告されたECOG4599試験とPointBreak試験を統合したサブグループ解析では,OSおよびPFSにおいて75歳以上で特にベバシズマブの上乗せ効果に乏しい傾向がみられた26)。米国におけるベバシズマブ併用療法の後方視的研究(ARIES試験)では,65歳未満と65歳以上,および75歳未満と75歳以上のサブグループ解析でどちらも有効性は同等であったが,毒性の面において高齢者群でGrade 3以上の動脈血栓塞栓症が増える傾向にあり,75歳以上ではさらに高かった(65歳未満1.5%,65歳以上2.9%,75歳以上3.5%)27)。また,欧州を中心に施行されたベバシズマブ併用療法のコホート研究(SAiL試験)では,70歳未満と70歳以上で有効性は同等であったが,高齢者群でGrade 3以上の出血の有害事象が増える傾向がみられた(70歳未満3.5%,70歳以上5.3%)28)。ただし,後者に示す2試験はいずれも非ランダム化試験でありエビデンスは低い。
本邦においては75歳以上の高齢者におけるベバシズマブ併用療法の十分なデータはなく,有効性や安全性は確認されていない。
以上より,高齢者に対してベバシズマブを併用した治療は有効性のエビデンスが限定的であり,エビデンスの強さはCと評価される(☞2018年版CQ69b参照)。
-
c.PS 2
ベバシズマブ併用療法の臨床試験ならびに観察研究においてその大半がPS 0-1であり,PS 2に対するベバシズマブの安全性や有効性に関してのデータは少ない27)28)。よって,PS 2に対してベバシズマブを併用した治療はエビデンスの有効性が明確に示されておらず,エビデンスの強さはDと評価される(☞2018年版CQ69c参照)。
※ CBDCA+PTX+ベバシズマブ療法の第Ⅱ相試験においてGrade 3以上の肺出血が9.1%に認められ,扁平上皮癌では4/13例(31%)で重篤な肺出血をきたした29)。その後,出血リスクに関する検討が行われ,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられた20)。以上より,ベバシズマブは扁平上皮癌に対して用いない。
BQ6
扁平上皮癌においてプラチナ製剤併用療法を受ける場合にネシツムマブの上乗せは勧められるか?
- PS 0-1症例に対して,シスプラチン+ゲムシタビンにネシツムマブを併用した治療は有効性のエビデンスが示されている。
〔エビデンスの強さ:B〕
PS 0-2のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法(CDDP+GEM療法)に対しネシツムマブを追加することの有効性を評価した第Ⅲ相試験(SQUIRE試験)が行われた30)。主要評価項目であるOSはHR 0.84(95%CI:0.74-0.96,P=0.01,中央値:11.5カ月vs 9.9カ月)と,プラチナ製剤併用療法に対するネシツムマブの上乗せはOSを有意に延長することが示された。またPFSにおいても,HR 0.85(95%CI:0.74-0.98,P=0.006,中央値:5.7カ月vs 5.5カ月)と,有意に延長することが示された。さらに,PS 0-1のサブグループ解析においても,OSはHR 0.85(95%CI:0.72-1.01),PFSはHR 0.86(95%CI:0.73-1.02)と良好な傾向がみられた。また,PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)の日本人患者を対象として,プラチナ製剤併用療法(CDDP+GEM療法)に対しネシツムマブを追加することの有効性を評価したランダム化第Ⅱ相試験(JFCM試験)が行われた31)。さらにOSおよびPFSは,それぞれHR 0.66(95%CI:0.47-0.93,P=0.0161,中央値:14.9カ月vs 10.8カ月),HR 0.56(95%CI:0.41-0.78,P=0.0004,中央値:4.2カ月vs 4.0カ月)であり,ネシツムマブの上乗せによりOS,PFSを有意に延長させることが示された。ORRは,ネシツムマブ併用療法群で有意に高かった(51.1% vs 20.9%)。
75歳以上の症例においては,前述する2つの試験30)31)においてある一定数が登録されているが,サブグループ解析の成績は示されていない。PS 2症例においては,SQUIRE試験のサブグループ解析でOSはHR 0.78(95%CI:0.51-1.21),PFSはHR 0.79(95%CI:0.50-1.24)と全体集団に劣らない傾向が示されている一方で,PS 2の日本人症例に対する投与経験はなく,有効性および安全性は不明である。主な毒性は,ネシツムマブ併用療法群で骨髄抑制,食欲不振,倦怠感に加えてネシツムマブに特徴的な皮疹,低マグネシウム血症などであり,Grade 3/4の毒性が併用療法群で高い傾向であった。本邦で行われた第Ⅱ相試験では,発熱性好中球減少症の頻度がプラチナ製剤群と比較し高かった(12% vs 3%)。
以上より,Ⅳ期非小細胞肺癌(扁平上皮癌),PS 0-1症例に対してプラチナ製剤併用療法にネシツムマブを併用した治療は有効性のエビデンスが示されており,エビデンスの強さはBと評価される(☞2019年版CQ72参照)。ネシツムマブの投与については,前述した試験によるとプラチナ製剤併用療法の終了後,病勢進行もしくは毒性中止まで投与を継続する方法がとられている。
BQ7
非扁平上皮癌においてプラチナ製剤+ペメトレキセド併用療法を受ける場合に,維持療法は勧められるか?
- 非扁平上皮癌に対してプラチナ製剤+ペメトレキセド併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してペメトレキセドによる維持療法は有効性のエビデンスが示されている。
〔エビデンスの強さ:B〕
CDDP+PEM併用療法後のPEMを用いた維持療法の第Ⅲ相試験(PARAMOUNT試験)で,PFSの有意な延長(HR 0.62,95%CI:0.50-0.73,P<0.0001,中央値:4.1カ月vs 2.8カ月),OSの有意な延長(HR 0.78,95%CI:0.64-0.96,P=0.0195,中央値:13.9カ月vs 11.0カ月)が示された32)。QOLの低下は認めず,維持療法群において毒性の増強はみられたものの許容範囲内であった。ベバシズマブの併用に関しては,CDDP+PEM+ベバシズマブ併用療法後にPEM+ベバシズマブ療法群とベバシズマブ単独療法群の第Ⅲ相試験(AVAPERL試験)が行われ,前者でPFSの有意な延長(HR 0.48,95%CI:0.44-0.75,P<0.0001,中央値:7.4カ月vs 3.7カ月)を認めたが,OSの有意な延長は認めなかった33)。また,本邦においてCBDCA+PEM+ベバシズマブ併用療法後のPEM+ベバシズマブ療法群とベバシズマブ単独療法群を比較する第Ⅲ相試験(COMPASS/WJOG5610L試験)が行われた。PFSは前者で有意に延長(HR 0.67,95%CI:0.57-0.79,P<0.001,中央値:5.7カ月vs 4.0カ月)を認めたが,主要評価項目であるOSの有意な延長は認めなかった34)。
以上より,プラチナ製剤+PEM併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対するPEMの維持療法は有効性のエビデンスが示されており,エビデンスの強さはBと評価されている(☞2018年版CQ70a参照)。
- 1)
- Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010 May 12;(5):CD007309.
- 2)
- Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer:a meta-analysis. J Thorac Oncol. 2007;2(9):845-53.
- 3)
- Ohe Y, Ohashi Y, Kubota K, et al. Randomized phase III study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer:Four-Arm Cooperative Study in Japan. Ann Oncol. 2007;18(2):317-23.
- 4)
- Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008;26(21):3543-51.
- 5)
- Grönberg BH, Bremnes RM, Flötten O, et al. Phase III study by the Norwegian lung cancer study group:pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol. 2009;27(19):3217-24.
- 6)
- Rodrigues-Pereira J, Kim JH, Magallanes M, et al. A randomized phase 3 trial comparing pemetrexed/carboplatin and docetaxel/carboplatin as first-line treatment for advanced, nonsquamous non-small cell lung cancer. J Thorac Oncol. 2011;6(11):1907-14.
- 7)
- Zinner RG, Obasaju CK, Spigel DR, et al. PRONOUNCE:randomized, open-label, phase III study of first-line pemetrexed+carboplatin followed by maintenance pemetrexed versus paclitaxel+carboplatin+bevacizumab followed by maintenance bevacizumab in patients ith advanced nonsquamous non-small-cell lung cancer. J Thorac Oncol. 2015;10(1):134-42.
- 8)
- Patel JD, Socinski MA, Garon EB, et al. PointBreak:a randomized phase III study of pemetrexed plus carboplatin and bevacizumab followed by maintenance pemetrexed and bevacizumab versus paclitaxel plus carboplatin and bevacizumab followed by maintenance bevacizumab in patients with stage IIIB or IV nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013;31(34):4349-57.
- 9)
- Shukuya T, Yamanaka T, Seto T, et al. Nedaplatin plus docetaxel versus cisplatin plus docetaxel for advanced or relapsed squamous cell carcinoma of the lung(WJOG5208L):a randomised, open-label, phase 3 trial. Lancet Oncol. 2015;16(16):1630-8.
- 10)
- Okamoto I, Yoshioka H, Morita S, et al. Phase III trial comparing oral S-1 plus carboplatin with paclitaxel plus carboplatin in chemotherapy-naive patients with advanced non-small-cell lung cancer:results of a west Japan oncology group study. J Clin Oncol. 2010;28(36):5240-6.
- 11)
- Kubota K, Sakai H, Katakami N, et al. A randomized phase III trial of oral S-1 plus cisplatin versus docetaxel plus cisplatin in Japanese patients with advanced non-small-cell lung cancer:TCOG0701 CATS trial. Ann Oncol. 2015;26(7):1401-8.
- 12)
- Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer:final results of a phase III trial. J Clin Oncol. 2012;30(17):2055-62.
- 13)
- Maione P, Perrone F, Gallo C, et al. Pretreatment quality of life and functional status assessment significantly predict survival of elderly patients with advanced non-small-cell lung cancer receiving chemotherapy:a prognostic analysis of the multicenter Italian lung cancer in the elderly study. J Clin Oncol. 2005;23(28):6865-72.
- 14)
- Hesketh PJ, Lilenbaum RC, Chansky K, et al. Chemotherapy in patients>or=80 with advanced non-small cell lung cancer:combined results from SWOG 0027 and LUN 6. J Thorac Oncol. 2007;2(6):494-8.
- 15)
- Quoix E, Zalcman G, Oster JP, et al. Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer:IFCT-0501 randomised, phase 3 trial. Lancet. 2011;378(9796):1079-88.
- 16)
- Okamoto I, Nokihara H, Nomura S, et al. Comparison of carboplatin plus pemetrexed followed by maintenance pemetrexed with docetaxel monotherapy in elderly patients with advanced nonsquamous non-small cell lung cancer:a phase 3 randomized clinical trial. JAMA Oncol. 2020;6(5):e196828.
- 17)
- Kogure Y, Iwasawa S, Saka H, et al. Efficacy and safety of carboplatin with nab-paclitaxel versus docetaxel in older patients with squamous non-small-cell lung cancer (CAPITAL):a randomised, multicentre, open-label, phase 3 trial. Lancet Healthy Longev. 2021;2(12):e791-800.
- 18)
- Lima AB, Macedo LT, Sasse AD. Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer:a systematic review and meta-analysis. PLoS One. 2011;6(8):e22681.
- 19)
- Soria JC, Mauguen A, Reck M, et al. Systematic review and meta-analysis of randomised, phase II/III trials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-small-cell lung cancer. Ann Oncol. 2013;24(1):20-30.
- 20)
- Sandler AB, Schiller JH, Gray R, et al. Retrospective evaluation of the clinical and radiographic risk factors associated with severe pulmonary hemorrhage in first-line advanced, unresectable non-small-cell lung cancer treated with Carboplatin and Paclitaxel plus bevacizumab. J Clin Oncol. 2009;27(9):1405-12.
- 21)
- Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006;355(24):2542-50.
- 22)
- Reck M, von Pawel J, Zatloukal P, et al. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer:results from a randomised phase III trial(AVAiL). Ann Oncol. 2010;21(9):1804-9.
- 23)
- Niho S, Kunitoh H, Nokihara H, et al. Randomized phase II study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung cancer. Lung Cancer. 2012;76(3):362-7.
- 24)
- Zhou C, Wu YL, Chen G, et al. BEYOND:A randomized, double-blind, placebo-controlled, multicenter, phase III study of first-line carboplatin/paclitaxel plus bevacizumab or placebo in Chinese patients with advanced or recurrent nonsquamous non-small-cell lung cancer. J Clin Oncol. 2015;33(19):2197-204.
- 25)
- Ramalingam SS, Dahlberg SE, Langer CJ, et al. Outcomes for elderly, advanced-stage non small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel:analysis of Eastern Cooperative Oncology Group Trial 4599. J Clin Oncol. 2008;26(1):60-5.
- 26)
- Langer CJ, Socinski MA, Patel JD, et al. Isolating the role of bevacizumab in elderly patients with previously untreated nonsquamous non-small cell lung cancer:secondary analyses of the ECOG 4599 and PointBreak trials. Am J Clin Oncol. 2016;39(5):441-7.
- 27)
- Wozniak AJ, Kosty MP, Jahanzeb M, et al. Clinical outcomes in elderly patients with advanced non-small cell lung cancer:results from ARIES, a bevacizumab observational cohort study. Clin Oncol(R Coll Radiol). 2015;27(4):187-96.
- 28)
- Laskin J, Crino L, Felip E, et al. Safety and efficacy of first-line bevacizumab plus chemotherapy in elderly patients with advanced or recurrent nonsquamous non-small cell lung cancer:safety of avastin in lung trial(MO19390). J Thorac Oncol. 2012;7(1):203-11.
- 29)
- Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase II trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol. 2004;22(11):2184-91.
- 30)
- Thatcher N, Hirsch FR, Luft AV, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line therapy in patients with stage IV squamous non-small-cell lung cancer(SQUIRE):an open-label, randomised, controlled phase 3 trial. Lancet Oncol. 2015;16(7):763-74.
- 31)
- Watanabe S, Yoshioka H, Sakai H, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line treatment for stage IV squamous non-small cell lung cancer:A phase 1b and randomized, open-label, multicenter, phase 2 trial in Japan. Lung Cancer. 2019;129:55-62.
- 32)
- Paz-Ares LG, de Marinis F, Dediu M, et al. PARAMOUNT:Final overall survival results of the phase III study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013;31(23):2895-902.
- 33)
- Barlesi F, Scherpereel A, Gorbunova V, et al. Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer:updated survival analysis of the AVAPERL(MO22089)randomized phase III trial. Ann Oncol. 2014;25(5):1044-52.
- 34)
- Seto T, Azuma K, Yamanaka T, et al. Randomized phase III study of continuation maintenance bevacizumab with or without pemetrexed in advanced nonsquamous non-small-cell lung cancer:COMPASS(WJOG5610L). J Clin Oncol. 2020;38(8):793-803.
7-5-3.二次治療以降レジメン
BQ8
一次治療耐性または進行例,PS 0-2,免疫チェックポイント阻害薬未使用例に対する二次治療において免疫チェックポイント阻害薬は勧められるか?
- PD-1阻害薬またはPD-L1阻害薬の単剤療法は有効性のエビデンスが確立している。
〔エビデンスの強さ:A〕
※ ペムブロリズマブの適応症は,(腫瘍細胞上の)PD-L1陽性の切除不能な進行・再発の非小細胞肺癌に限られる。
ドライバー遺伝子変異/転座陰性例の二次治療では,複数の第Ⅲ相試験においてDTX単剤療法と比較してPD-1/PD-L1阻害薬単剤療法が有意にOSを延長することが証明されている。いずれの試験もDTX単剤療法を対照としており,ニボルマブ単剤療法およびアテゾリズマブ単剤療法はPD-L1の発現を問わず行われ1)~4),ペムブロリズマブ単剤療法はPD-L1 TPS 1%以上の非小細胞肺癌を対象として行われた5)。
〈ニボルマブ単剤療法〉
ニボルマブ単剤療法はDTX単剤療法との比較において,第Ⅲ相試験が3編報告されている。
プラチナ製剤併用療法の治療歴を有する進行扁平上皮癌を対象としたCheckMate017試験では,ニボルマブ単剤療法は主要評価項目であるOSにおいてHR 0.59(95%CI:0.44-0.79,P<0.001,中央値:9.2カ月vs 6.0カ月)とDTX単剤療法と比較し有意な延長を示し,PD-L1発現率に基づくサブグループ解析でも,PD-L1の発現によらずニボルマブ単剤療法の有効性が示されている1)。
プラチナ製剤併用療法の治療歴を有する進行非扁平上皮癌を対象としたCheckMate057試験でも,主要評価項目であるOSにおいてHR 0.73(95%CI:0.59-0.79,P=0.002,中央値:12.2カ月vs 9.4カ月)とDTX単剤療法と比較しニボルマブ単剤療法の有意な延長が示されている2)。特にPD-L1 TPS 1%以上のサブグループにおいてはOSがHR 0.58(95%CI:0.43-0.79),PFSがHR 0.70(95%CI:0.53-0.94)と有意にOSを延長することが示されている。さらに同試験におけるQOLの比較において,ニボルマブ単剤療法群がDTX単剤療法群と比較して有意に肺癌症状の悪化を遅らせることが示された6)。
なお,CheckMate017/057試験の統合解析においてニボルマブ単剤療法群の更新されたOSはHR 0.68(95%CI:0.59-0.78),PFSはHR 0.79(95%CI:0.68-0.92)と報告されている7)。
また,海外で行われたプラチナ製剤併用療法の治療歴を有する進行非小細胞肺癌を対象としたCheckMate078試験でも,主要評価項目であるOSにおいてHR 0.68(95%CI:0.52-0.90,P=0.0006,中央値:12.0カ月vs 9.6カ月)とDTX単剤療法と比較しニボルマブ単剤療法の有意な延長が示されている3)。
前述の3試験における主な毒性は,ニボルマブ単剤療法群で倦怠感や食欲不振,DTX単剤療法群で好中球減少,倦怠感,脱毛などであり,Grade 3以上の毒性はニボルマブ単剤療法群で有意に少なかった。一方,ニボルマブ単剤療法群で肺臓炎,甲状腺機能障害,大腸炎,肝機能障害,皮疹,Ⅰ型糖尿病などの免疫関連の毒性が報告されており,免疫関連の毒性管理には注意が必要である。
〈ペムブロリズマブ単剤療法〉
プラチナ製剤併用療法を含む治療歴を有するPD-L1 TPS 1%以上の進行非小細胞肺癌を対象とした第Ⅱ-Ⅲ相試験(KEYNOTE-010試験)では,DTX単剤療法に対するペムブロリズマブ単剤療法(2mg/kg投与群と10mg/kg投与群の2群統合)のOSはHR 0.67(95%CI:0.56-0.80),PFSはHR 0.85(95%CI:0.73-0.98)であり,生存期間の延長効果が示されている5)。更新されたOSはHR 0.70(95%CI:0.61-0.80)と報告されている8)。Grade 3以上の毒性はペムブロリズマブ単剤療法2mg/kg投与群で13%,10mg/kg投与群で16%,DTX単剤療法群で35%とペムブロリズマブ単剤療法群で頻度が低く,ペムブロリズマブ単剤療法の免疫関連の毒性として甲状腺機能障害,肺臓炎,皮膚障害などが認められた5)。また,同試験におけるQOL解析においてペムブロリズマブ単剤療法群がDTX単剤療法群と比較して有意に患者のQOLと肺癌関連症状を改善させることが示された9)。
なお,PD-L1陽性の切除不能な進行・再発非小細胞肺癌に対する本邦におけるペムブロリズマブの投与量は,200mg/bodyの3週毎投与と規定されている。
〈アテゾリズマブ単剤療法〉
アテゾリズマブ単剤療法はプラチナ製剤併用療法の治療歴を有する非小細胞肺癌を対象として,DTX単剤療法と比較したランダム化第Ⅱ相試験(POPLAR試験)と第Ⅲ相試験(OAK試験)がそれぞれ報告されている4)10)。
POPLAR試験では,主要評価項目であるOSはHR 0.73(95%CI:0.53-0.99,P=0.040,中央値:12.6カ月vs 9.7カ月)とアテゾリズマブ単剤療法がDTX単剤療法と比較し有意にOSを延長した結果が示されている10)。OAK試験においても,主要評価項目であるOSはHRが0.73(95%CI:0.62-0.87,P=0.0003,中央値:13.8カ月vs 9.6カ月)とアテゾリズマブ単剤療法がDTX単剤療法と比較し有意にOSを延長した4)。また,OAK試験におけるQOLの比較において,アテゾリズマブ単剤療法群がDTX単剤療法群と比較して有意に肺癌関連症状の悪化を遅らせることが示された11)。
OAK試験における主な毒性は,アテゾリズマブ単剤療法群で倦怠感や悪心,下痢などであり,Grade 3以上の毒性(治療関連)はアテゾリズマブ単剤療法群で15%,DTX単剤療法群で43%とアテゾリズマブ単剤療法群が少なかった。一方,アテゾリズマブ単剤療法群の免疫関連の毒性として肺臓炎,肝炎,大腸炎が報告されており,毒性による投与中止例は8%(DTX単剤療法群は19%)であった。
上記の第Ⅲ相試験はいずれもPS 0-1の症例を対象として実施しており,PS 2の一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対するPD-1/PD-L1阻害薬単剤療法の有用性は現時点で不明確であるが,安全性を中心とした報告は近年散見される。一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対するニボルマブ単剤療法の前向き観察研究(CheckMate153試験)では,PS 2での使用例で全体集団と比較しGrade 3以上の毒性が増加しないことが示されている(12% vs 12%)12)。一方,海外で行われたPS 2の症例60例に対するペムブロリズマブ単剤療法の第Ⅱ相試験(PePS2試験)では,二次治療以降が36例(60%)含まれていた。登録された全体集団において,ペムブロリズマブ単剤の投与によって17例(28%)で治療延期ないしは治療中断を要する毒性が報告されている。既治療36例の生存効果は,PFS中央値4.4カ月,OS中央値10.4カ月であった13)。また,PS 2と高齢者を含んだ治療歴のある進行肺扁平上皮癌患者を対象としたニボルマブ単剤療法の第Ⅱ相試験(CheckMate171試験)の結果も報告されている14)。ニボルマブ単剤で治療を行った811例中103例がPS 2の患者であり,PS 2の患者は毒性の頻度は全体集団と変わらないものの,OS中央値は5.2カ月と全体集団(10.0カ月)に比べて予後は短い傾向であると報告されている。
以上より,一次治療耐性または進行後,ドライバー遺伝子変異/転座陰性,免疫チェックポイント阻害薬未使用例のⅣ期非小細胞肺癌に対してPD-1/PD-L1阻害薬単剤療法の有効性のエビデンスは確立しており,エビデンスの強さはAと評価される(☞2018年版CQ72a参照)。
- 1)
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med. 2015;373(2):123-35.
- 2)
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med. 2015;373(17):1627-39.
- 3)
- Wu YL, Lu S, Cheng Y, et al. Nivolumab versus docetaxel in a predominantly Chinese patient population with previously treated advanced NSCLC:CheckMate 078 randomized phase III clinical trial. J Thorac Oncol. 2019;14(5):867-75.
- 4)
- Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK):a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017;389(10066):255-65.
- 5)
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial. Lancet. 2016;387(10027):1540-50.
- 6)
- Reck M, Brahmer J, Bennett B, et al. Evaluation of health-related quality of life and symptoms in patients with advanced non-squamous non-small cell lung cancer treated with nivolumab or docetaxel in CheckMate 057. Eur J Cancer. 2018;102:23-30.
- 7)
- Borghaei H, Gettinger S, Vokes EE, et al. Five-year outcomes from the randomized, phase III trials CheckMate 017 and 057:nivolumab versus docetaxel in previously treated non-small-cell lung cancer. J Clin Oncol. 2021;39(7):723-33.
- 8)
- Herbst RS, Garon EB, Kim DW, et al. Five year survival update from KEYNOTE-010:pembrolizumab versus docetaxel for previously treated, programmed death-ligand 1-positive advanced NSCLC. J Thorac Oncol. 2021;16(10):1718-32.
- 9)
- Barlesi F, Garon EB, Kim DW, et al. Health-related quality of life in KEYNOTE-010:a phase II/III study of pembrolizumab versus docetaxel in patients with previously treated advanced, programmed death ligand 1-expressing NSCLC. J Thorac Oncol. 2019;14(5):793-801.
- 10)
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR):a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016;387(10030):1837-46.
- 11)
- Bordoni R, Ciardiello F, von Pawel J, et al. Patient-reported outcomes in OAK:a phase III study of atezolizumab versus docetaxel in advanced non-small-cell lung cancer. Clin Lung Cancer. 2018;19(5):441-9.
- 12)
- Spigel DR, McCleod M, Jotte RM, et al. Safety, efficacy, and patient-reported health-related quality of life and symptom burden with nivolumab in patients with advanced non-small cell lung cancer, including patients aged 70 years or older or with poor performance status(CheckMate 153). J Thorac Oncol. 2019;14(9):1628-39.
- 13)
- Middleton G, Brock K, Savage J, et al. Pembrolizumab in patients with non-small-cell lung cancer of performance status 2(PePS2):a single arm, phase 2 trial. Lancet Respir Med. 2020;8(9):895-904.
- 14)
- Felip E, Ardizzoni A, Ciuleanu T, et al. CheckMate 171:A phase 2 trial of nivolumab in patients with previously treated advanced squamous non-small cell lung cancer, including ECOG PS 2 and elderly populations. Eur J Cancer. 2020;127:160-72.
- レジメン
- Ⅳ期非小細胞肺癌
| EGFR遺伝子変異陽性例 | ゲフィチニブ | 250 mg/日 | 1日1回 |
|---|---|---|---|
| エルロチニブ | 150 mg/日 | 1日1回 | |
| アファチニブ | 40 mg/日 | 1日1回 | |
| オシメルチニブ | 80 mg/日 | 1日1回 | |
| ダコミチニブ | 45 mg/日 | 1日1回 | |
| ALK融合遺伝子陽性例 | クリゾチニブ | 500 mg/日 | 1日2回 |
| アレクチニブ | 600 mg/日 | 1日2回 | |
| セリチニブ | 450 mg/日 | 1日1回 | |
| ロルラチニブ | 100 mg/日 | 1日1回 | |
| ブリグチニブ | 90 mg/日,day 1-7 180 mg/日,day 8~ |
1日1回 | |
| ROS1融合遺伝子陽性例 | クリゾチニブ | 500 mg/日 | 1日2回 |
| エヌトレクチニブ | 600 mg/日 | 1日1回 | |
| BRAF遺伝子V600E変異陽性例 | ダブラフェニブ | 300 mg/日 | 1日2回 |
| トラメチニブ | 2 mg/日 | 1日1回 | |
| MET遺伝子変異陽性例 | テポチニブ | 500 mg/日 | 1日1回 |
| カプマチニブ | 800 mg/日 | 1日2回 | |
| NTRK融合遺伝子陽性例 | エヌトレクチニブ | 600 mg/日 | 1日1回 |
| ラロトレクチニブ | 200 mg/日 | 1日2回 | |
| RET融合遺伝子陽性例 | セルペルカチニブ | 320 mg/日 | 1日2回 |
| KRAS遺伝子G12C変異陽性例 | ソトラシブ | 960 mg/日 | 1日1回 |
| HER2遺伝子変異陽性 | トラスツズマブ | 5.4 mg/kg,day1 | 3週間毎 |
| デルクステカン |
| ベバシズマブ併用 | エルロチニブ | 150 mg/日 | 1日1回 |
|---|---|---|---|
| ベバシズマブ | 15 mg/kg,day 1 | 3週毎 | |
| ラムシルマブ併用 | エルロチニブ | 150 mg/日 | 1日1回 |
| ラムシルマブ | 10 mg/kg,day 1 | 2週毎 | |
| 細胞傷害性抗癌薬併用 | ゲフィチニブ | 250 mg/日 | 1日1回 |
| CBDCA | (AUC=5),day 1 | 3~4週毎 | |
| PEM* | 500 mg/m2,day 1 | ||
| ・4~6サイクル終了後,増悪を認めなければゲフィチニブ+PEM併用の維持療法を考慮する | |||
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。
| ペムブロリズマブ併用 | (非扁平上皮癌のみ) | 3週毎 | |
|---|---|---|---|
| CDDP | 75 mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5),day 1 | ||
| PEM* | 500 mg/m2,day 1 | ||
| ペムブロリズマブ | 200 mg/body,day 1 | ||
|
・4サイクル終了後,増悪を認めなければPEM+ペムブロリズマブ併用の維持療法を考慮する |
|||
| (扁平上皮癌のみ) | 3週毎 | ||
| CBDCA | (AUC=6),day 1 | ||
| PTX | 200 mg/m2,day 1 | ||
| もしくはnab-PTX | もしくは100 mg/m2,day 1,8,15 | ||
| ペムブロリズマブ | 200 mg/body,day 1 | ||
|
・4サイクル終了後,増悪を認めなければペムブロリズマブ単剤の維持療法を考慮する ・PTXを含むレジメンの場合,PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
| アテゾリズマブ併用 (非扁平上皮癌のみ) |
CBDCA | (AUC=6),day 1 | 3週毎 |
| PTX | 200 mg/m2,day 1 | ||
| ベバシズマブ | 15 mg/kg,day 1 | ||
| アテゾリズマブ | 1200 mg/body,day 1 | ||
|
・4~6サイクル終了後,増悪を認めなければベバシズマブ+アテゾリズマブ併用の維持療法を考慮する ・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
| CBDCA | (AUC=6),day 1 | 3週毎 | |
| nab-PTX | 100 mg/m2,day 1,8,15 | ||
| アテゾリズマブ | 1200 mg/body,day 1 | ||
|
・4サイクル終了後,増悪を認めなければアテゾリズマブ単剤の維持療法を考慮する | |||
| ニボルマブ+イピリムマブ併用 | (非扁平上皮癌のみ) | 6週毎 | |
| CDDP | 75 mg/m2,day 1,22 | ||
| もしくはCBDCA | もしくは(AUC=5),day 1,22 | ||
| PEM* | 500 mg/m2,day 1,22 | ||
| ニボルマブ | 360 mg/body,day 1,22 | ||
| イピリムマブ | 1 mg/kg,day 1 | ||
|
・2サイクル(6週間投与)終了後,増悪を認めなければニボルマブ+イピリムマブ併用の維持療法を考慮する |
|||
| (扁平上皮癌のみ) | 6週毎 | ||
| CBDCA | (AUC=6),day 1,22 | ||
| PTX | 200 mg/m2,day 1,22 | ||
| ニボルマブ | 360 mg/body,day 1,22 | ||
| イピリムマブ | 1 mg/kg,day 1 | ||
|
・2サイクル(6週間投与)終了後,増悪を認めなければニボルマブ+イピリムマブ併用の維持療法を考慮する |
|||
| デュルバルマブ+トレメリムマブ併用 | CBDCA | (AUC=5または6),day 1 | 3週毎 |
| nab-PTX | 100 mg/m2,day 1,8,15 | ||
| デュルバルマブ | 1500 mg/body,day 1 | ||
| トレメリムマブ | 75 mg/body,day 1 | ||
|
・4サイクル(12週間投与)終了後,増悪を認めなければデュルバルマブの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) |
|||
| (非扁平上皮癌のみ) | 3週毎 | ||
| CDDP | 75 mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5または6),day 1 | ||
| PEM* | 500 mg/m2,day 1 | ||
| デュルバルマブ | 1500 mg/body,day 1 | ||
| トレメリムマブ | 75 mg/body,day 1 | ||
|
・4サイクル(12週間投与)終了後,増悪を認めなければデュルバルマブ+PEMの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) |
|||
| (扁平上皮癌のみ) | 3週毎 | ||
| CDDP | 75 mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5または6),day 1 | ||
| GEM | 1000または1250 mg/m2,day 1,8 | ||
| デュルバルマブ | 1500 mg/body,day 1 | ||
| トレメリムマブ | 75 mg/body,day 1 | ||
|
・4サイクル(12週間投与)終了後,増悪を認めなければデュルバルマブの維持療法(4週毎)に移行する ・16週(6サイクル目)にトレメリムマブを併用する (トレメリムマブは全5回投与) |
|||
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。
| ペムブロリズマブ単剤療法 | (PD-L1 TPS 1%以上のみ) | 3週毎 | |
|---|---|---|---|
| ペムブロリズマブ | 200 mg/body,day 1 | ||
| アテゾリズマブ単剤療法 | (初回治療においては,PD-L1 TC3/IC3のみ) | 3週毎 | |
| アテゾリズマブ | 1200 mg/body,day 1 | ||
| ニボルマブ+イピリムマブ療法 | ニボルマブ | 240 mg/body,day 1,15,29 | 6週毎 |
| イピリムマブ | 1 mg/kg,day 1 | ||
| ニボルマブ単剤療法 | ニボルマブ | 240 mg/body,day 1 | 2週毎 |
| CBDCA+PTX+ベバシズマブ療法 | CBDCA | (AUC=6),day 1 | 3週毎 |
|---|---|---|---|
| PTX | 200 mg/m2,day 1 | ||
| ベバシズマブ | 15 mg/kg,day 1 | ||
|
・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う ・増悪しなければ上記を6サイクル以内で繰り返す ・プラチナ製剤併用療法の終了後,病勢増悪もしくは毒性中止までベバシズマブの単剤投与を継続する |
|||
| DTX+ラムシルマブ療法 | DTX | 60 mg/m2,day 1 | 3週毎 |
| ラムシルマブ | 10 mg/kg,day 1 | ||
| CDDP+GEM+ネシツムマブ療法 | CDDP | 75 mg/m2,day 1 | 3週毎 |
| GEM | 1250 mg/m2,day 1,8 | ||
| ネシツムマブ | 800 mg/body,day 1,8 | ||
|
・4サイクル終了後,増悪を認めなければネシツムマブの単剤投与を継続する |
|||
| CDDP+PEM療法 | CDDP | 75 mg/m2,day 1 | 3週毎 |
|---|---|---|---|
| PEM* | 500 mg/m2,day 1 | ||
|
・4サイクル終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
|||
| CDDP+DTX療法 | CDDP | 80 mg/m2,day 1 | 3週毎 |
| DTX | 60 mg/m2,day 1 | ||
| CDDP+GEM療法 | CDDP | 80 mg/m2,day 1 | 3週毎 |
| GEM | 1000 mg/m2,day 1,8 | ||
| CDDP+VNR療法 | CDDP | 80 mg/m2,day 1 | 3週毎 |
| VNR | 25 mg/m2,day 1,8 | ||
| CDDP+CPT-11療法 | CDDP | 80 mg/m2,day 1 | 4週毎 |
| CPT-11 | 60 mg/m2,day 1,8,15 | ||
| CDDP+S-1療法 | CDDP | 60 mg/m2,day 8 | 4~5週毎 |
| S-1 | 40 mg/m2,1日2回,day 1-21 | ||
※増悪しなければ上記を6サイクル以内で繰り返す
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。
| CBDCA+PTX療法 | CBDCA | (AUC=6),day 1 | 3週毎 |
|---|---|---|---|
| PTX | 200 mg/m2,day 1 | ||
|
・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
| CBDCA+GEM療法 | CBDCA | (AUC=5),day 1 | 3週毎 |
| GEM | 1000 mg/m2,day 1,8 | ||
| CBDCA+S-1療法 | CBDCA | (AUC=5),day 1 | 3週毎 |
| S-1 | 40 mg/m2,1日2回,day 1-14 | ||
| CBDCA+nab-PTX療法 | CBDCA | (AUC=6),day 1 | 3週毎 |
| nab-PTX | 100 mg/m2,day 1,8,15 | ||
| CBDCA+PEM療法 | CBDCA | (AUC=5または6),day 1 | 3週毎 |
| PEM* | 500 mg/m2,day 1 | ||
|
・4サイクル終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
|||
※増悪しなければ上記を6サイクル以内で繰り返す
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。
| NDP+DTX療法 | NDP/CDGP | 100 mg/m2,day 1 | 3週毎 |
|---|---|---|---|
| DTX | 60 mg/m2,day 1 |
※増悪しなければ上記を6サイクル以内で繰り返す
| DTX単剤療法 | DTX | 60 mg/m2,day 1 | 3週毎 |
|---|---|---|---|
| PEM単剤療法 | PEM* | 500 mg/m2,day 1 | 3週毎 |
| S-1単剤療法 | S-1 | 80-120 mg/body,1日2回,day 1-28 | 6週毎 |
| GEM単剤療法 | GEM | 1000 mg/m2,day 1,8,15 | 4週毎 |
| VNR単剤療法 | VNR | 25 mg/m2,day 1,8 | 3週毎 |
| nab-PTX単剤療法 | nab-PTX | 100 mg/m2,day 1,8,15 | 3週毎 |
*PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3サイクル毎)に1回投与する。


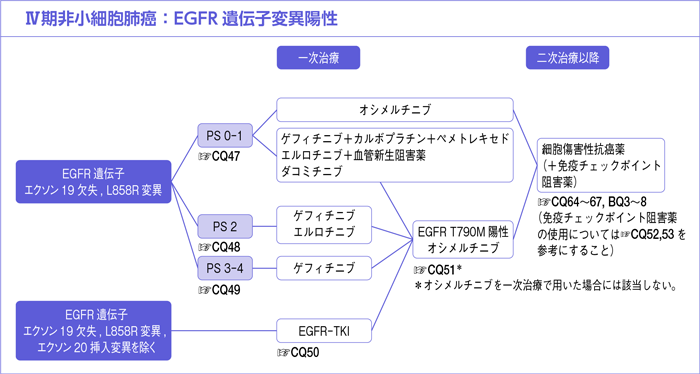
*BQ1参照。