1
Ⅳ.転移など各病態に対する治療
樹形図
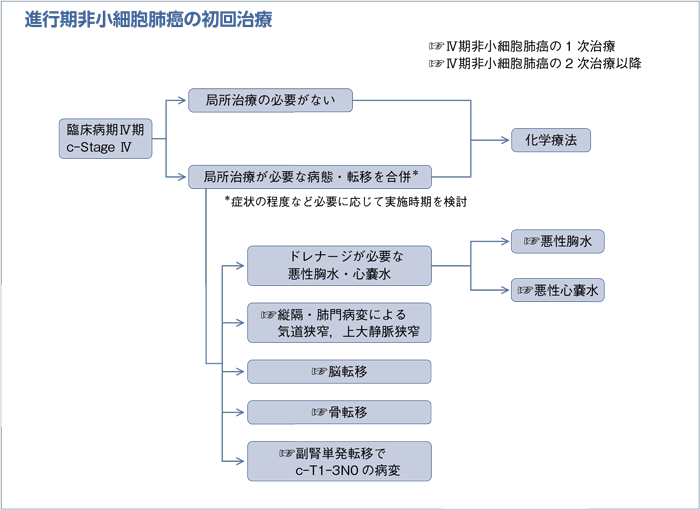
1-1.骨転移
文献検索と採択

本文中に用いた略語および用語の解説
| SRE | skeletal related event | 骨関連事象 |
|---|
- 推 奨
a.骨転移の疼痛緩和の目的において,放射線治療は行うよう勧められる。(グレードB)
b.脊髄圧迫で症状を呈している場合には,速やかに放射線治療を行うよう勧められる。(グレードB)
c.病的骨折の危険性が高い場合や脊椎転移が脊髄圧迫を生じている場合には,症状がなくても放射線治療を行うよう勧められる。(グレードB)
d.骨転移を有する症例に対して骨関連事象の発現率を軽減し,発現までの時期を延長させるために,ビスフォスフォネート製剤(ゾレドロン酸)またはデノスマブを投与するよう勧められる。(グレードB)
- a.
- 肺癌の骨転移は進行非小細胞肺癌では約30~40%に生じるとされ,生存期間の中央値は1年にも満たないとされる。本邦における259人の非小細胞肺癌でのレトロスペクティブな解析では,その経過で70人(30.4%)に骨転移が認められている。そのうち46人(65.7%)は初回Staging時で認められ,また35人(50%)は骨関連事象(skeletal related event;SRE)をその経過で認めた。特に疼痛は最も多い症状であり,肺癌の骨転移症例の約80%に認められるという報告もある1)。
未治療の骨転移合併非小細胞肺癌において可能なら全身治療としての化学療法を導入すべきであるが,骨転移に対する放射線治療の有効率(除痛効果)は50~80%と高く2),症状を有する骨転移合併例では症状緩和は重要と考えられる。したがって,症状緩和が高率に得られる放射線治療は行うよう勧められる。
疼痛緩和効果をエンドポイントに8 Gy単回照射と総線量20~30 Gyの分割照射とを比較する臨床試験が行われており,それらのシステマティックレビューでは疼痛緩和効果は8 Gy単回照射と分割照射では同等であるものの単回照射では再照射率が高いことが示されており2),照射後の長期の経過を観察した研究でも,単回照射群で再照射率が高い結果が示されている3)。そのため骨転移に対する照射方法としては,緩和治療として20 Gy/5回,30 Gy/10回などの分割照射が推奨される。PS良好で原疾患が制御されている孤立性転移など長期予後が期待される患者に限れば高線量の放射線治療が考慮される4)。一方,8 Gy単回照射は期待生存期間3カ月以内,毎日の治療が困難,原腫瘍が増悪している患者で良い適応となる。 - b.
- 脊椎転移が脊髄圧迫症状を呈する場合には,速やかに放射線治療を行うよう勧められる。除圧術や脊椎置換術などの外科的治療の併用については,少数例の検討ではあるが有用性を示す報告もあり,年齢,全身状態,予後などを考慮したうえで,症例毎に適応を検討する5)~7)。
- c.
- 過重骨で皮質の50%以上に破壊がみられるか溶骨病変が2.5 cm以上の場合には病的骨折のリスクが高く,固定と照射の適応がある8)。画像上,脊髄の圧迫があるものの症状が顕在化していない症例に放射線治療をすることにより,全例にその後の歩行能力が保持されていたとの報告もあり,重篤な神経症状を呈する前に照射することが勧められる9)。
- d.
- 乳癌および前立腺癌以外の肺癌を中心とした固形癌の骨転移患者(非小細胞肺癌:50%,小細胞肺癌:8%)を対象に,ビスフォスフォネート(BP)製剤であるゾレドロン酸とプラセボを,骨関連事象(SRE)の発症率および発症までの期間で比較したランダム化比較試験が行われた10)11)。87週目までのSRE発現割合は,ゾレドロン酸4 mg投与群が38.9%,プラセボ投与群が48.0%とゾレドロン酸投与群が有意に低かった(P=0.039)。また,発症時期を約3カ月延長させた(236日 vs 155日)。疼痛スコアや鎮痛剤の使用およびPSの変化に関しても,有意ではないものの増悪度に減弱傾向を認め,骨転移を有する症例ではゾレドロン酸の投与にて,SREの発現率を減少させることが証明された。
乳癌,前立腺癌を除く,進行癌と多発性骨髄腫患者(非小細胞肺癌:40%)を対象に,デノスマブとゾレドロン酸を,SRE発症までの期間で比較したランダム化比較第Ⅲ相試験が行われた12)。初回SRE発症までの期間は,デノスマブ群で20.6カ月,ゾレドロン酸群で16.3カ月で,非劣性が証明されたが,優越性は証明されなかった(P=0.06)。一方で,疼痛スコアの増悪や骨病変に対する放射線治療のリスクは,デノスマブ群が有意に少ない結果であった13)。以上より,骨転移を有する肺癌の症例に対しては,SREの発現率の軽減とSRE発現までの期間を延長させるために,ゾレドロン酸またはデノスマブの投与が勧められる。
BP製剤とデノスマブの重要な有害事象に顎骨壊死と腎機能障害が報告されている。顎骨壊死のリスク因子は,直近の歯科的処置やBP製剤の36カ月以上の長期投与が挙げられている14)。そのため,日常診療におけるBP製剤の長期使用では,顎骨壊死は十分に注意すべき有害事象と考えられる。デノスマブとゾレドロン酸の比較試験の統合解析においても,両薬剤で,顎骨壊死の頻度に有意差を認めず15),デノスマブも,BP製剤と同様な対応が必要である(参考資料:http://jsbmr.umin.jp/guide/pdf/bronjpositionpaper2012.pdf)。
BP製剤の腎障害は,BP製剤を使用した症例の4%に報告されている16)。一方,デノスマブは,海外第Ⅲ相試験12)において,クレアチニンクリアランス値が30 ml/min未満の重度腎疾患患者および透析の必要な末期腎不全患者は対象から除外されており,慎重投与となっている。
デノスマブで注意すべき有害事象は,低カルシウム(Ca)血症である。低Ca血症の頻度がBP製剤と比較して有意に多いという報告(ゾレドロン酸投与群5.8%,デノスマブ投与群10.8%)があり,予防のためにCa製剤,ビタミンD製剤の内服,定期的な血清Caの測定が推奨されている12)。
- 1)Tsuya A, Kurata T, Tamura K, et al. Skeletal metastases in non-small cell lung cancer: a retrospective study. Lung Cancer. 2007; 57(2): 229-32. (IV)
- 2)Chow E, Harris K, Fan G, et al. Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol. 2007; 25(11): 1423-36. (I)
- 3)Sande TA, Ruenes R, Lund JA, et al. Long-term follow-up of cancer patients receiving radiotherapy for bone metastases: results from a randomised multicentre trial. Radiother Oncol. 2009; 91(2): 261-6. (IV)
- 4)Milano MT, Katz AW, Muhs AG, et al. A prospective pilot study of curative-intent stereotactic body radiation therapy in patients with 5 or fewer oligometastatic lesions. Cancer. 2008; 112(3): 650-8. (IV)
- 5)Patchell RA, Tibbs PA, Regine WF, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial. Lancet. 2005; 366(9486): 643-8. (II)
- 6)Rades D, Huttenlocher S, Dunst J, et al. Matched pair analysis comparing surgery followed by radiotherapy and radiotherapy alone for metastatic spinal cord compression. J Clin Oncol. 2010; 28(22): 3597-604. (IV)
- 7)Chi JH, Gokasian Z, McComick P, et al. Selecting treatment for patients with malignant epidural spinal cord compression-does age matter?: results from a randomized clinical trial. Spine(Phila Pa 1976). 2009; 34(5): 431-5. (IV)
- 8)Harrington KD. New trends in the management of lower extremity metastases. Clin Orthop Relat Res. 1982;(169): 53-61. (VI)
- 9)Maranzano E, Latini P. Effectiveness of radiation therapy without surgery in metastatic spinal cord compression: final results from a prospective trial. Int J Radiat Oncol Biol Phys. 1995; 32(4): 959-67. (IV)
- 10)Rosen LS, Gordon D, Tchekmedyian NS, et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial. Cancer. 2004; 100(12): 2613-21. (II)
- 11)Rosen LS, Gordon D, Tchekmedyian S, et al. Zoledronic acid versus placebo in the treatment of skeletal metastases in patients with lung cancer and other solid tumors: a phase III, double-blind, randomized trial--the Zoledronic Acid Lung Cancer and Other Solid Tumors Study Group. J Clin Oncol. 2003; 21(16): 3150-7. (II)
- 12)Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer(excluding breast and prostate cancer)or multiple myeloma. J Clin Oncol. 2011; 29(9): 1125-32. (II)
- 13)Vadhan-Raj S, von Moos R, Fallowfield LJ, et al. Clinical benefit in patients with metastatic bone disease: results of a phase 3 study of denosumab versus zoledronic acid. Ann Oncol. 2012; 23(12): 3045-51. (II)
- 14)Migliorati CA, Siegel MA, Elting LS. Bisphosphonate-associated osteonecrosis: a long-term complication of bisphosphonate treatment. Lancet Oncol. 2006; 7(6): 508-14. (VI)
- 15)Saad F, Brown JE, Van Poznak C, et al. Incidence, risk factors, and outcomes of osteonecrosis of the jaw: integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases. Ann Oncol. 2012; 23(5): 1341-7. (IV)
- 16)Bonomi M, Nortilli R, Molino A, et al. Renal toxicity and osteonecrosis of the jaw in cancer patients treated with bisphosphonates: a long-term retrospective analysis. Med Oncol. 2010; 27(2): 224-9. (IV)
1-2.脳転移
文献検索と採択

本文中に用いた略語および用語の解説
| QOL | quality of life | 生活の質 |
|---|---|---|
| STI | stereotactic irradiation | 定位放射線照射 |
| 以下の2つに分けられる | ||
| SRS,stereotactic radiosurgery | 定位手術的照射:1回照射 | |
| SRT,stereotactic radiotherapy | 定位放射線治療:分割照射 |
- 推 奨
a.症状を有する脳転移には放射線治療を行うよう勧められる。(グレードA)
b.頭蓋外に活動性病変がない単発性脳転移では,定位手術的照射(SRS)*もしくは手術を行うよう勧められる。(グレードB)
c.多発性脳転移に対して全脳照射を行うよう勧められる。(グレードB)4個以下で腫瘍径3 cm程度までであればSRSも勧められる。(グレードB)
*定位放射線照射(STI)は,線量分割の違いにより,1回照射の場合を定位手術的照射(SRS),分割照射の場合を定位放射線治療(SRT)と定義されている。ガンマナイフはSRSに含まれる。脳幹など重要組織が近接している場合や大きい腫瘍にはSRTで治療を行うことがある。
- a.
- 肺癌は脳転移の生じる頻度が高く,脳転移によって生じた様々な神経症状はQOLを低下させる。このため,QOL改善を目的に対症的な放射線治療が施行されてきた。その結果,症状の緩解は70~90%の患者に得られ,放射線治療は対症療法として有用である1)。
Ⅳ期非小細胞肺癌に対しては全身療法として化学療法の適応であるが,化学療法の脳転移に対する奏効率は20~40%と低い2)。したがって,症状を有する脳転移例では症状の緩解が高率に得られる放射線治療を行うよう勧められる。 - b.
- 頭蓋外に活動性病変がない単発性脳転移に対する治療は,予後の改善を目的としていくつかの臨床試験が行われた。まず,大きさにかかわらず単発性脳転移の手術後に全脳照射を併用することで,脳内再発が有意に低下することがランダム化比較試験で示されたが,手術単独に比して生存期間には有意差がみられなかった3)。
また,1~3個(大きさ4 cm以下)の脳転移病変を有する固形癌患者を対象として,全脳照射+SRSと全脳照射とのランダム化比較第Ⅲ相試験が施行され4),単発性脳転移の症例に限れば全脳照射+SRSは全脳照射単独に比して全生存期間が有意に良好であった(4.9 vs 6.5カ月)。
この試験を含むメタアナリシスでも脳転移が単発であれば,全脳照射単独と比較して全脳照射+SRS群で有意に予後が良好であった5)。
一方,単発性脳転移(3 cm以下)に対するSRS単独と手術+全脳照射を比較したランダム化比較試験では,手術+全脳照射では脳内再発率が有意に低下したが,両群に生存期間の差はみられなかった6)。それ故,単発性脳転移に対してはSRSまたは手術を行うよう勧められる。全脳照射の併用については,SRSまたは手術単独と比較して脳内再発率を低下させるが,生存への寄与は明確ではない。 - c.
- 従来,多発性脳転移に対しては全脳照射が行われてきた。全脳照射の線量分割法の違いによる治療成績には明らかな差はなく,一般的には30 Gy/10回/2週や37.5 Gy/15回/3週の照射法が使われるが,期待生存期間が5~6週間と短い患者には1週間程度の短期照射も選択肢として挙げられる7)~11)。長期予後が期待できる患者には,遅発性有害反応軽減のために40 Gy/20回/4週も用いられる。
また少数の脳転移症例に対しては,SRSの有用性が報告されている。多発性脳転移2~4個(大きさ2.5 cm以下)の患者に対する全脳照射のみと全脳照射+SRS併用とのランダム化比較試験では登録27例(全脳照射のみ14例,全脳+SRS 13例)の中間解析でSRS併用で脳内再発が有意に低下し,試験が中止されたが,生存期間には有意差はみられなかった12)。
さらに,ランダム化比較試験で1~3個(大きさ4 cm以下)の脳転移病変を有する固形癌患者に対し,全脳照射に対するSRSの追加効果の有用性が検討された4)。全生存期間では,SRSによる有意な改善は認められなかった。また,この試験やコホート解析を統合したメタアナリシスでも同様の結果であった5)。
本邦では,SRS単独とSRS+全脳照射のランダム化比較試験が,1~4個(大きさ3 cm以下)の脳転移に行われた13)。全脳照射を追加することで有意に脳内再発が低下したが,生存期間への寄与は明らかではなかった。
以上から,3 cm以下で4個以下の病変に対しては,全脳照射にSRSを追加またはSRSに全脳照射を追加することで生存期間の改善は得られていない。
10個以下の病変を有する1,197症例に対するSRS単独での成績を比較し,病変が2~4個の症例と5個以上の症例では生存率に差がなかったとする結果が本邦から報告されている14)。現在,海外で5個以上症例に対する全脳照射とSRSのランダム化比較試験が行われており,多発病変に対するSRSの適応選択については今後の検討課題である。
脳腫瘍に対する放射線照射の有害事象として治療後のQOLの低下が問題となることがある。手術やSRSに全脳照射を追加することで,活動性の低下や認知機能障害が生じることを示す報告15)がある一方で,評価の方法や時期の違いの影響から差がなかったとする報告13)もある。一方,全脳照射を省くことで脳内再発によって認知機能の悪化がみられることがある。
髄膜播種に対する放射線治療(全脳照射)の有用性を検討した前向き臨床試験は存在しない。後方視的研究では,髄膜播種症例での全脳照射の有用性は認めておらず16),現状では,髄膜播種に対する全脳照射の有用性は明らかでない。
- 1)Borgelt B, Gelber R, Kramer S, et al. The palliation of brain metastases: final results of the first two studies by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 1980; 6(1): 1-9. (II)
- 2)Nieder C, Grosu AL, Astner S, et al. Integration of chemotherapy into current treatment strategies for brain metastases from solid tumors. Radiat Oncol. 2006; 1: 19. (IV)
- 3)Patchell RA, Tibbs PA, Regine WF, et al. Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA. 1998; 280(17): 1485-9. (II)
- 4)Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet. 2004; 363(9422): 1665-72. (II)
- 5)Stafinski T, Jhangri GS, Yan E, et al. Effectiveness of stereotactic radiosurgery alone or in combination with whole brain radiotherapy compared to conventional surgery and/or whole brain radiotherapy for the treatment of one or more brain metastases: a systematic review and meta-analysis. Cancer Treat Rev. 2006; 32(3): 203-13. (I)
- 6)Muacevic A, Wowra B, Siefert A, et al. Microsurgery plus whole brain irradiation versus Gamma Knife surgery alone for treatment of single metastases to the brain: a randomized controlled multicentre phase III trial. J Neurooncol. 2008; 87(3): 299-307. (II)
- 7)Coia LR. The role of radiation therapy in the treatment of brain metastases. Int J Radiat Oncol Biol Phys. 1992; 23(1): 229-38. (IV)
- 8)Coia LR, Aaronson N, Linggood R, et al. A report of the consensus workshop panel on the treatment of brain metastases. Int J Radiat Oncol Biol Phys. 1992; 23(1): 223-7. (IV)
- 9)Murray KJ, Scott C, Zachariah B, et al. Importance of the mini-mental status examination in the treatment of patients with brain metastases: a report from the Radiation Therapy Oncology Group protocol 91-04. Int J Radiat Oncol Biol Phys. 2000; 48: 59-64. (IV)
- 10)Chatani M, Teshima T, Hata K, et al. Prognostic factors in patients with brain metastases from lung carcinoma. Strahlenther Onkol. 1986; 162(3): 157-61. (II)
- 11)Haie-Meder C, Pellae-Cosset B, Laplanche A, et al. Results of a randomized clinical trial comparing two radiation schedules in the palliative treatment of brain metastases. Radiother Oncol. 1993; 26(2): 111-6. (II)
- 12)Kondziolka D, Patel A, Lunsford LD, et al. Stereotactic radiosurgery plus whole brain radiotherapy versus radiotherapy alone for patients with multiple brain metastases. Int J Radiat Oncol Biol Phys. 1999; 45(2): 427-34. (II)
- 13)Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 2006; 295(21): 2483-91. (II)
- 14)Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases(JLGK0901): a multi-institutional prospective observational study. Lancet Oncol. 2014; 15(4): 387-95. (IV)
- 15)Soffietti R, Kocher M, Abacioglu UM, et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery: quality-of-life results. J Clin Oncol. 2013; 31(1): 65-72. (II)
- 16)Morris PG, Reiner AS, Szenberg OR, et al. Leptomeningeal metastasis from non-small cell lung cancer: survival and the impact of whole brain radiotherapy. J Thorac Oncol. 2012; 7(2): 382-5. (IV)
1-3.緩和的胸部放射線治療
文献検索と採択

- 推 奨
- 縦隔・肺門病変による気道狭窄,上大静脈狭窄など胸郭内の腫瘍増大に伴う症状の緩和を目的とした胸部放射線治療は,行うよう勧められる。(グレードB)
- 1)Fairchild A, Harris K, Barnes E, et al. Palliative thoracic radiotherapy for lung cancer: a systematic review. J Clin Oncol. 2008; 26(24): 4001-11. (II)
- 2)Ma JT, Zheng JH, Han CB, et al. Meta-analysis comparing higher and lower dose radiotherapy for palliation in locally advanced lung cancer. Cancer Sci. 2014; 105(8): 1015-22. (I)
- 3)Strøm HH, Bremnes RM, Sundstrøm SH, et al. Concurrent palliative chemoradiation leads to survival and quality of life benefits in poor prognosis stage III non-small-cell lung cancer: a randomised trial by the Norwegian Lung Cancer Study Group. Br J Cancer. 2013; 109(6): 1467-75. (II)
- 4)Strøm HH, Bremnes RM, Sundstrøm SH, et al. Poor prognosis patients with inoperable locally advanced NSCLC and large tumors benefit from palliative chemoradiotherapy: a subset analysis from a randomized clinical phase III trial. J Thorac Oncol. 2014; 9(6): 825-33. (II)
レジメン:骨転移・脳転移・胸部病変
転移性骨腫瘍
| 緩和的放射線治療 | 30 Gy/10回(2週),20 Gy/5回(1週),8 Gy/1回(1日)など | ||
|---|---|---|---|
| 薬物療法 | ゾレドロン酸4 mg | 3~4週毎投与 | |
| デノスマブ120 mg | 4週毎投与 | ||
| Ca製剤 | 500 mg/日 | 連日投与 | |
| 天然型ビタミンD | 400 IU/日 | 連日投与 | |
| (デノスマブ使用においては,高Ca血症を認めないかぎり,低Ca血症予防のためCa製剤とビタミンD製剤の補充を推奨) | |||
転移性脳腫瘍
| 緩和的放射線治療 (全脳照射) |
30 Gy/10回(2週),37.5 Gy/15回(3週),40 Gy/20回(4週)など |
|---|
胸部病変
| 緩和的放射線治療 | 30 Gy/10回(2週),37.5 Gy/15回(3週),40 Gy/20回(4週)など |
|---|