Ⅱ.非小細胞肺癌(NSCLC)
7
Ⅳ期非小細胞肺癌
文献検索と採択
- 文献検索期間
-
- 2004年12月1日から2019年11月30日
- 文献検索方法
-
- キーワード:lung cancer, non-small cell lung cancer, chemotherapy
- 委員がPubMedを用いて検索し,2014年版からは順次,医学図書館協会の協力を得てより詳細な検索を行い,さらに今回,国際医学情報センターの協力により,下記の検索式で2018年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式(検索日:2019年12月7日)
-
#1 “Carcinoma, Non-Small-Cell Lung/therapy”[Majr]AND(“Carcinoma, Non-Small-Cell Lung/secondary”[Mesh]OR “Neoplasm Metastasis”[Mesh]) #2 “Carcinoma, Non-Small-Cell Lung/therapy”[Majr]AND(stage IV*[TIAB]OR stage IV-*[TIAB]OR stage III/IV*[TIAB]OR stage 4*[TIAB]OR stages IV*[TIAB]OR stages IV-*[TIAB]OR stages III/IV*[TIAB]OR stages 4*[TIAB]OR advanced[TIAB]OR metastatic*[TIAB]) #3 (Non-Small-Cell Lung Cancer*[TI]OR Nonsmall Cell Lung Cancer*[TI]OR Non Small Cell Lung Carcinoma*[TI]OR Nonsmall-Cell Lung Carcinoma*[TI]OR NSCLC[TI]OR squamous lung cancer*[TI]OR squamous lung carcinoma*[TI]OR lung adenocarcinoma*[TI])AND(stage IV*[TIAB]OR stage IV-*[TIAB]OR stage III/IV*[TIAB]OR stage 4*[TIAB]OR stages IV*[TIAB]OR stages IV-*[TIAB]OR stages III/IV*[TIAB]OR stages 4*[TIAB]OR advanced[TIAB]OR metastatic*[TIAB])NOT medline[SB] #4 #1 OR #2 OR #3 #5 #4 AND 2019/1:2019/11[DP] #6 #5 AND(JAPANESE[LA]OR ENGLISH[LA])
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で日本における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
- 原稿作成中に検索された2019年12月1日以降の文献も適宜追加した。
本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン |
|---|---|
| CDDP | シスプラチン |
| CPT-11 | イリノテカン |
| DTX | ドセタキセル |
| GEM | ゲムシタビン |
| IFM | イホスファミド |
| nab-PTX | ナブパクリタキセル |
| NDP/CDGP | ネダプラチン |
| PEM | ペメトレキセド |
| PTX | パクリタキセル |
| S-1 | テガフール・ギメラシル・オテラシルカリウム配合剤 |
| VNR | ビノレルビン |
| PD-1/PD-L1阻害薬 | ニボルマブ,ペムブロリズマブ,アテゾリズマブの総称 |
|---|---|
| プラチナ製剤 | CDDP,CBDCA,NDPの総称 |
| 第一・二世代のEGFR-TKI | ゲフィチニブ,エルロチニブ,アファチニブ,ダコミチニブの総称 |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
|---|---|---|
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| IC | tumor-infiltrating immune cells | 腫瘍浸潤免疫細胞 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 全身状態 |
| QOL | quality of life | 生活の質 |
| TC | tumor cells | 腫瘍細胞 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害薬 |
| TPS | tumor proportion score | PD-L1免疫染色による腫瘍細胞における陽性率 |
| Score | 定 義 |
|---|---|
| 0 | 全く問題なく活動できる。 発病前と同じ日常生活が制限なく行える。 |
| 1 | 肉体的に激しい活動は制限されるが,歩行可能で,軽作業や座っての作業は行うことができる。 例:軽い家事,事務作業 |
| 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。 日中の50%以上はベッド外で過ごす。 |
| 3 | 限られた自分の身の回りのことしかできない。 日中の50%以上をベッドか椅子で過ごす。 |
| 4 | 全く動けない。 自分の身の回りのことは全くできない。 完全にベッドか椅子で過ごす。 |
出典:Common Toxicity Criteria, Version2.0 Publish Date April 30, 1999
(JCOGホームページ.ガイドライン・各種基準より日本語訳を引用)
日本における高齢者の定義は70~75歳以上とされており,2010年版の肺癌診療ガイドラインでは70歳以上を高齢者と定義していた。
しかしながら,日本の臨床試験においては75歳以上の患者が除外されていることが多く,75歳以上の高齢者のデータは少ない。また,近年の70歳以上の高齢者を対象とした第三世代細胞傷害性抗癌薬単剤とプラチナ製剤併用療法を比較した2編の第Ⅲ相試験において両試験とも登録された患者の多くが75歳以上であった。
以上より,本ガイドラインでは非小細胞肺癌において「75歳以上」を高齢者と定義する。
- Switch maintenance:プラチナ製剤併用療法による導入療法後,導入療法で使用した薬剤とは別の薬剤に切り替えて投与する方法。
- Continuation maintenance:プラチナ製剤併用療法による導入療法後,プラチナ製剤と併用した薬剤を継続して投与する方法。
- 総 論
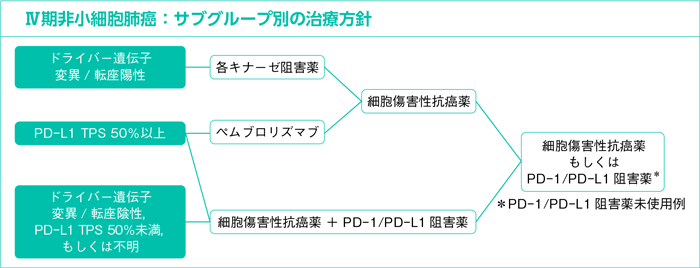
- Ⅳ期非小細胞肺癌における薬物療法の意義とサブグループ別の治療方針
樹形図
Ⅳ期非小細胞肺癌で用いられる薬物療法においては,長らく細胞傷害性抗癌薬がその中心を担ってきた。細胞傷害性抗癌薬と緩和治療を比較したメタアナリシスによって,細胞傷害性抗癌薬が有意に生存を延長させることが示されている1)。これは1年生存率にして9%(20%から29%)の改善,もしくは約1.5カ月のOS延長に相当する。第三世代細胞傷害性抗癌薬を用いた検討では,第三世代細胞傷害性抗癌薬単剤療法でも緩和治療に比して1年生存率で約7%の改善がみられたことが示されている2)。毒性については,別のメタアナリシスで進行非小細胞肺癌における細胞傷害性抗癌薬の治療関連死が1.26%であったと報告されており,その内訳は発熱性好中球減少,虚血や血栓などの心血管系の毒性,肺炎や間質性肺障害などの肺毒性であった3)。QOLに関しては,第三世代細胞傷害性抗癌薬単剤は緩和治療と比較してQOLを改善させることが報告されている4)。また,第三世代細胞傷害性抗癌薬にプラチナ製剤を追加することの意義を評価した第Ⅲ相試験では,プラチナ製剤と第三世代細胞傷害性抗癌薬の併用がOS・PFS延長を示すと同時にQOLは同等であったと報告されている5)。
一方,2000年代以降になって分子標的治療薬・免疫チェックポイント阻害薬といった新規治療が登場し,これらは細胞傷害性抗癌薬との比較によってその有効性を示している。
分子標的治療薬の多くはEGFR遺伝子変異,ALK融合遺伝子などといった癌発生の直接的な原因となるようなドライバーと称される遺伝子変異/転座に対する阻害薬である。全身状態良好で,これらドライバー遺伝子の変異/転座を有する患者に対して,それぞれのキナーゼ阻害薬を投与することでORRの増加,PFSの延長などの有効性が報告されている。EGFR遺伝子変異,ALK融合遺伝子では細胞傷害性抗癌薬と比較した第Ⅲ相試験が実施され,キナーゼ阻害薬のほうが細胞傷害性抗癌薬に比して有効であることが報告されている(CQ46)。頻度の少ないEGFRのuncommon mutation,その他のドライバー遺伝子(ROS1,BRAF,MET)変異/転座陽性例では細胞傷害性抗癌薬と比較した第Ⅲ相試験が実施されていないが,第Ⅱ相試験などではそれぞれの阻害薬によって同程度の高い有効性が報告されている(CQ55,60~62)。また多くの分子標的治療薬は一般的に細胞傷害性抗癌薬よりも毒性が軽度であることが多く,少数例の検討ながらPS不良例における前向き試験での有効性が報告されている点も重要である(CQ47)。なお,キナーゼ阻害薬の適応となるドライバー遺伝子変異/転座陽性例は腺癌症例に多く認められるが,扁平上皮癌症例やその他の組織型においても認められることがある。ドライバー遺伝子変異/転座陽性の扁平上皮癌を有する患者に対するキナーゼ阻害薬の治療成績はエビデンスに乏しく,さらに非扁平上皮癌症例と比較すると劣る傾向にある。しかしながら奏効例の報告もみられるため,いずれかのタイミングでキナーゼ阻害薬の投与を検討すべきである。
2015年以降,本邦で使用可能となった免疫チェックポイント阻害薬は,細胞傷害性抗癌薬や分子標的治療薬と異なる作用機序を有する新規薬で,腫瘍免疫における負の調節因子であるPD-1などの免疫チェックポイント分子を標的とした抗体薬である。PS 0-1でEGFR遺伝子変異,ALK融合遺伝子を有さない,PD-L1 TPSが50%以上の非小細胞肺癌を対象としたPD-1阻害薬(ペムブロリズマブ)とプラチナ製剤併用療法の第Ⅲ相試験(KEYNOTE-024試験)では,ペムブロリズマブ群においてORR,PFS,OSの有意な改善が示され,毒性も忍容可能であった(CQ64)。さらに,進行非小細胞肺癌を対象として細胞傷害性抗癌薬(プラチナ製剤併用療法)にPD-1/PD-L1阻害薬の上乗せを評価した複数の第Ⅲ相試験(CQ69)が報告されており,PD-1/PD-L1阻害薬の上乗せの高い有効性が示されている。
以上,全身状態良好なⅣ期非小細胞肺癌患者に対しては薬物療法(細胞傷害性抗癌薬,分子標的治療薬,免疫チェックポイント阻害薬)が緩和治療に比してOSを延長し,QOLも改善することが示されている。治療方針の決定に際して,分子標的治療薬では腫瘍におけるドライバー遺伝子の変異/転座の有無を,ペムブロリズマブではPD-L1の発現状態を確認する必要があり,これらの薬剤を適切なタイミングで使用するためには組織,病期診断と並行して目の前の患者が,1)ドライバー遺伝子変異/転座陽性例,2)ドライバー遺伝子変異/転座陰性のPD-L1 TPS 50%以上,3)それ以外,のいずれのサブグループに属するのかを診断することが重要である。以下に各サブグループにおける治療方針を述べる。
1)ドライバー遺伝子変異/転座陽性例:CQ46~63
ドライバー遺伝子変異/転座陽性例では前述したようにそれぞれのキナーゼ阻害薬によってORR,PFSの改善が報告されている。なおこれらの第Ⅲ相試験では,プラチナ製剤併用療法の後治療としてキナーゼ阻害薬へのクロスオーバーが高率に行われたために,OSの有意な差は示されていない。EGFR遺伝子変異陽性例の大規模研究において,一次から三次治療のエルロチニブ単剤のPFSに有意差を認めないことが報告されており6),キナーゼ阻害薬と細胞傷害性抗癌薬の投与順序に関して,現時点で明確な結論はない。しかしながら,米国で行われた前向き観察研究では,733例を対象に10遺伝子について解析し,466例(64%)にドライバー遺伝子変異/転座を認めたが,ドライバー遺伝子変異/転座があり,それを標的とした治療薬を使用した260例のOS中央値は3.5年であったのに対し,ドライバー遺伝子変異/転座があったにもかかわらず,それを標的とした治療をしていない患者のOS中央値は2.4年であった(propensity score-adjusted hazard ratio:0.69,95%CI:0.53-0.9,P=0.006)7)。
以上より,ドライバー遺伝子変異/転座陽性例に対してキナーゼ阻害薬の投与機会を逸しないことは重要であり,細胞傷害性抗癌薬よりも優先して投与することを推奨する。なお,本ガイドラインにおけるドライバー遺伝子変異/転座は,現時点で治療標的となる薬剤が承認されている以下の遺伝子異常(EGFR遺伝子変異,ALK融合遺伝子,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異)と定義する。増悪後の二次治療としては全身状態に応じて細胞傷害性抗癌薬が勧められる(CQ66~68)。ドライバー遺伝子変異/転座陽性例に対する免疫チェックポイント阻害薬についてはCQ50,51を参照のこと。
2)ドライバー遺伝子変異/転座陰性のPD-L1 TPS 50%以上:CQ64,65
PD-1/PD-L1阻害薬の高い臨床効果が期待できるサブグループであり,初回治療としてペムブロリズマブ単剤療法を行うよう勧められる。また,細胞傷害性抗癌薬(プラチナ製剤併用療法)+PD-1/PD-L1阻害薬治療も勧められる。上記の治療増悪後の二次治療としては,全身状態に応じて細胞傷害性抗癌薬を行うよう勧められる。なお,ドライバー遺伝子変異/転座陽性例は前項1)に準じる。
3)ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明:CQ66~78
このサブグループに対する一次治療として,分子標的治療薬や免疫チェックポイント阻害薬が細胞傷害性抗癌薬よりも有効であることは示されていない。一方で,プラチナ製剤併用療法+PD-1/PD-L1阻害薬治療は,プラチナ製剤併用療法のみと比較し有意な生存延長効果を示しており,プラチナ製剤併用療法の対象で,かつPD-1/PD-L1阻害薬の上乗せが可能な症例はこれらの多剤併用療法が勧められる。
- 1)
- Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010; (5): CD007309.
- 2)
- Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer: a meta-analysis. J Thorac Oncol. 2007; 2(9): 845-53.
- 3)
- Fujiwara Y, Hotta K, Di Maio M, et al. Time trend in treatment-related deaths of patients with advanced non-small-cell lung cancer enrolled into phase Ⅲ trials of systemic treatment. Ann Oncol. 2011; 22(2): 376-82.
- 4)
- Anderson H, Hopwood P, Stephens RJ, et al. Gemcitabine plus best supportive care(BSC)vs BSC in inoperable non-small cell lung cancer--a randomized trial with quality of life as the primary outcome. UK NSCLC Gemcitabine Group. Non-Small Cell Lung Cancer. Br J Cancer. 2000; 83(4): 447-53.
- 5)
- Sederholm C, Hillerdal G, Lamberg K, et al. Phase Ⅲ trial of gemcitabine plus carboplatin versus single-agent gemcitabine in the treatment of locally advanced or metastatic non-small-cell lung cancer: the Swedish Lung Cancer Study Group. J Clin Oncol. 2005; 23(33): 8380-8.
- 6)
- Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67.
- 7)
- Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014; 311(19): 1998-2006.
- 7-1
- ドライバー遺伝子変異/転座陽性
樹形図
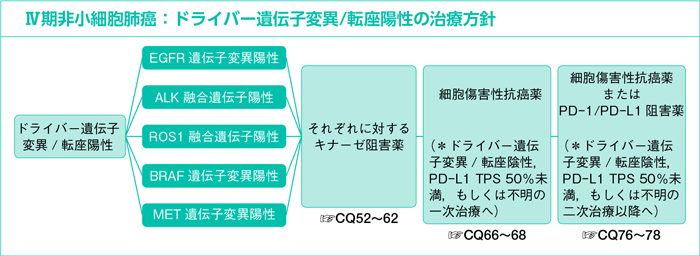
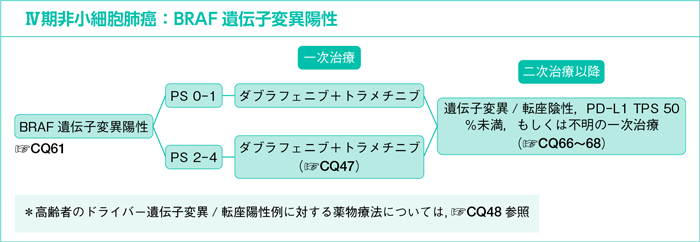
7-1-1.遺伝子変異/転座陽性の治療方針
CQ46.
全身状態良好(PS 0-1)なドライバー遺伝子変異/転座陽性例に対する最適な一次治療は何か?
- 推 奨
- ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET)変異/転座を有するPS 0-1の患者に,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
非小細胞肺癌におけるEGFR遺伝子変異,ALK融合遺伝子,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異は癌発生の直接的な原因となるような遺伝子変異/転座であり,本ガイドラインではこれらの遺伝子をドライバー遺伝子と総称する。全身状態良好で,これらドライバー遺伝子の変異/転座を有する患者に対して,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬によるORRの増加,PFSの延長などの有効性が報告されている。EGFR遺伝子変異,ALK融合遺伝子では細胞傷害性抗癌薬との比較試験が実施され,キナーゼ阻害薬のほうが有効性が明らかに高いことが報告されている1)~8)。EGFRのuncommon mutation(CQ55),ROS1融合遺伝子(CQ60),BRAF遺伝子変異(CQ61),MET遺伝子変異(CQ62)は,患者数が少ないために細胞傷害性抗癌薬との第Ⅲ相試験は実施されていないが,第Ⅱ相試験や第Ⅲ相試験のサブセットではそれぞれの遺伝子変異/転座に応じたキナーゼ阻害薬によって高い有効性を示している9)~15)。米国で行われた前向き観察研究では,733例を対象に10遺伝子について解析し,466例(64%)にドライバー遺伝子変異/転座を認めたが,ドライバー遺伝子変異/転座があり,それを標的としたキナーゼ阻害薬を使用した260例のOS中央値は3.5年であったのに対し,ドライバー遺伝子変異/転座があったにもかかわらず,それを標的とした治療をしていない患者のOS中央値は2.4年であった(propensity score-adjusted HR 0.69,95%CI:0.53-0.9,P=0.006)16)。ドライバー遺伝子変異/転座に対する免疫チェックポイント阻害薬のデータは乏しいが,現時点でキナーゼ阻害薬の効果を上回るものではない(CQ51)。
なお,これらの試験では後治療としてクロスオーバーが認められていることから,OSの差は示されておらず優先順位を付けることはできない。EGFR遺伝子変異陽性例の大規模研究において,一次から三次治療のエルロチニブ単剤のPFSに有意差を認めないことが報告されており17),EGFR-TKI単剤と細胞傷害性抗癌薬の投与順序に関しては,現時点で明確な結論はない。ALK融合遺伝子陽性に対するALK-TKI(クリゾチニブ)単剤と細胞傷害性抗癌薬を比較した第Ⅲ相試験では,長期OSデータの生存曲線においてALK-TKI群が上回っているものの有意差は示されなかった(HR 0.760,95%CI:0.548-1.053)18)。毒性についてはキナーゼ阻害薬で軽い傾向にあるものの,薬剤により毒性のプロファイルおよび程度が異なる。
以上より,ドライバー遺伝子変異/転座を有するPS 0-1の患者には,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬が勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (27/27) |
0% | 0% | 0% | 0% |
CQ47.
PS 2-4のドライバー遺伝子変異/転座陽性例に対する最適な一次治療は何か?
- 推 奨
-
- a.
- ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET)変異/転座を有するPS 2の患者に,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:96%〕
-
- b.
- ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET)変異/転座を有するPS 3-4の患者に,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:93%〕
-
a.EGFR遺伝子変異陽性やALK融合遺伝子陽性の患者を対象とした細胞傷害性抗癌薬との比較試験にもPS 2の患者が5~10%程度含まれており,PS 0-1と同等の有効性が示されている3)4)7)8)。また,EGFR遺伝子変異陽性の患者に対するゲフィチニブや,ALK融合遺伝子陽性の患者に対するアレクチニブはPS不良例に対する有効性が報告されている19)20)。
PS 2のEGFRのuncommon mutation,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異陽性例に関するデータは患者数が少ないために限られているが,EGFRやALKの結果を鑑みて,キナーゼ阻害薬による治療を行うよう推奨される。
以上より,ドライバー遺伝子変異/転座を有するPS 2の患者には,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 96% (27/28) |
4% (1/28) |
0% | 0% | 0% |
-
b.PS 3-4のEGFR遺伝子変異陽性の患者を対象としたゲフィチニブや,ALK融合遺伝子陽性の患者を対象としたアレクチニブはPS不良例に対する有効性が報告されており,患者数はそれぞれ22例,6例と少ないが,安全性について大きな問題は認められなかった19)20)。なお,ゲフィチニブの検討ではORRが66%,79%の患者でPSの改善を認めており,アレクチニブの検討では6例中のすべての症例でPSの改善を認めている。
PS 3-4のROS1融合遺伝子,EGFRのuncommon mutation,BRAF遺伝子変異,MET遺伝子変異陽性例に関するデータはPS 2よりもさらに限られていたり,データがないものもあるが,PS 2と同様に有効性が期待され得る。一方,キナーゼ阻害薬によって有害事象の頻度やプロファイルは様々であり,全身状態良好例においてさえも高い頻度で休薬・減量を必要とする薬剤が存在するため,PS 3-4で用いる場合はより一層の注意が必要である。
以上より,ドライバー遺伝子変異/転座を有するPS 3-4の患者には,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 7% (2/28) |
93% (26/28) |
0% | 0% | 0% |
CQ48.
75歳以上のドライバー遺伝子変異/転座陽性例に対する最適な一次治療は何か?
- 推 奨
- ドライバー遺伝子(EGFR,ALK,ROS1,BRAF,MET)変異/転座を有する75歳以上の患者に,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:96%〕
75歳以上のEGFR遺伝子変異陽性進行非小細胞肺癌を対象とした国内でのゲフィチニブ単剤の第Ⅱ相試験(NEJ003試験)において,ORR 74%,PFS中央値12.3カ月と若年者と同等の有効性と安全性が報告されている21)。エルロチニブ単剤については国内での第Ⅱ相試験(JO22903試験)において,75歳超と75歳以下で同等の有効性が示されている22)。
EGFRのuncommon mutation,ALK融合遺伝子,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異に関して,75歳以上に対する有効性を示したサブグループのデータはないが,一般にキナーゼ阻害薬は毒性が細胞傷害性抗癌薬と比べて軽いため,高齢者に対しても比較的安全に使用できると想定される。EGFR-TKIの研究結果を鑑みて,ALK融合遺伝子,ROS1融合遺伝子,BRAF遺伝子変異,MET遺伝子変異に対しては75歳以上でもキナーゼ阻害薬を行うことを考慮し得る。
以上より,ドライバー遺伝子変異/転座を有する75歳以上の患者には,それぞれの遺伝子変異/転座を標的とするキナーゼ阻害薬が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。ただし,薬剤による毒性には若年者より一層の注意が必要である。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 96% (27/28) |
4% (1/28) |
0% | 0% | 0% |
CQ49.
ドライバー遺伝子変異/転座陽性例に細胞傷害性抗癌薬は勧められるか?
- 推 奨
- ドライバー遺伝子変異/転座陽性例の患者においても,ドライバー遺伝子変異/転座のない患者で推奨される細胞傷害性抗癌薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
ドライバー遺伝子変異/転座のある患者におけるキードラッグはキナーゼ阻害薬であるが,これまでに行われた第Ⅲ相試験では,多くの症例がキナーゼ阻害薬の前後で細胞傷害性抗癌薬の投与を受けている。後解析ではあるが,これらの第Ⅲ相試験にて細胞傷害性抗癌薬を投与されている患者の予後が良い傾向にあり23)24),本邦の大規模観察研究においても同様の傾向が認められている25)。ドライバー遺伝子変異/転座陽性例のみを対象として細胞傷害性抗癌薬とベストサポーティブケアを比較した試験は存在しないが,ドライバー遺伝子変異/転座陽性例は陰性例と比較して細胞傷害性抗癌薬の効果が明らかに劣ることを示唆するデータはないため,ドライバー遺伝子変異/転座不明例やドライバー遺伝子変異/転座陽性例を含む非小細胞肺癌患者を対象とした過去の細胞傷害性抗癌薬のエビデンスは本対象に適応できると考える(CQ66~68参照。ただし細胞傷害性抗癌薬と免疫チェックポイント阻害薬の併用についてはCQ50参照)。
以上より,ドライバー遺伝子変異/転座のある患者においても,いずれかのタイミングで細胞傷害性抗癌薬を行うことが勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (28/28) |
0% | 0% | 0% | 0% |
CQ50.
ドライバー遺伝子変異/転座陽性例に細胞傷害性抗癌薬と免疫チェックポイント阻害薬の併用は勧められるか?
- 推 奨
- ドライバー遺伝子変異/転座陽性の患者にプラチナ製剤併用療法と免疫チェックポイント阻害薬の併用療法を行うよう勧めるだけの根拠が明確ではない。
〔推奨度決定不能〕
一次治療における非扁平上皮非小細胞肺癌に対する,CBDCA+PTX+ベバシズマブ+アテゾリズマブ療法とCBDCA+PTX+ベバシズマブ療法を比較した第Ⅲ相試験(IMpower150試験)のEGFR遺伝子変異陽性のサブグループ解析において,OS中央値 未到達vs 18.7カ月(HR 0.61,95%CI:0.29-1.28),PFS中央値10.2カ月vs 6.9カ月(HR 0.61,95%CI:0.36-1.03)とアテゾリズマブ併用群が良好な傾向を示した26)。しかし,このサブグループ解析はプロトコールであらかじめ予定されていた解析ではなく,EFGR遺伝子変異の有無が割付調整因子に設定されていないなど解釈には注意が必要である。また,非扁平上皮非小細胞肺癌に対するCBDCA+nab-PTX+アテゾリズマブ療法とCBDCA+nab-PTX療法を比較した第Ⅲ相試験(IMpower130試験)のEGFR遺伝子変異もしくはALK融合遺伝子陽性のサブグループ解析において,PFS中央値7.0カ月vs 6.0カ月(HR 0.75,95%CI:0.36-1.54),OS中央値14.4カ月vs 10.0カ月(HR 0.98,95%CI:0.41-2.31)であった27)。いずれも探索的なサブグループ解析のみであり,現時点では,ドライバー遺伝子変異/転座陽性例にプラチナ製剤併用療法と免疫チェックポイント阻害薬の併用療法を勧めるだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 32% (9/28) |
64% (18/28) |
4% (1/28) |
0% |
CQ51.
ドライバー遺伝子変異/転座陽性例に免疫チェックポイント阻害薬単独療法は勧められるか?
- 推 奨
- ドライバー遺伝子変異/転座陽性例の患者に免疫チェックポイント阻害薬単独療法を勧めるだけの根拠が明確ではない。
〔推奨度決定不能〕
非小細胞肺癌の一次治療において,免疫チェックポイント阻害薬の有効性を評価したほとんどの第Ⅲ相試験では,EGFR遺伝子変異陽性,ALK融合遺伝子陽性の患者は主要評価項目の対象集団から除外されていた。二次治療において,免疫チェックポイント阻害薬(ニボルマブ,ペムブロリズマブ,アテゾリズマブ)とDTXの第Ⅱ/Ⅲ相試験を統合解析した報告の中で,EGFR遺伝子変異陽性例における免疫チェックポイント阻害薬のDTXに対するOSはHR 1.11(95%CI:0.80-1.53,P=0.54)であり,免疫チェックポイント阻害薬は全体集団では有効性が示されているもののEGFR遺伝子変異陽性例において優れているという結果は示されていない28)。単施設の報告では,EGFR遺伝子変異陽性もしくはALK融合遺伝子陽性例における免疫チェックポイント阻害薬のORRは3.6%と低かった29)。このため,ドライバー遺伝子変異/転座陽性の患者に対する免疫チェックポイント阻害薬の効果は,ドライバー遺伝子変異/転座陰性の患者と比べて低い可能性がある。なお,これらの報告は対象となった症例数の少ないサブグループの結果であることに加え,EGFR以外のドライバー遺伝子変異/転座陽性例の報告は後方視的研究に限られる。
以上より,ドライバー遺伝子変異/転座陽性例における免疫チェックポイント阻害薬の投与の可否を判断するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 23% (5/22) |
73% (16/22) |
0% | 5% (1/22) |
- 1)
- Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8.
- 2)
- Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8.
- 3)
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42.
- 4)
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46.
- 5)
- Sequist LV, Yang JC, Yamamoto N, et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013; 31(27): 3327-34.
- 6)
- Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22.
- 7)
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77.
- 8)
- Wu YL, Lu S, Lu Y, et al. Results of PROFILE 1029, a phase Ⅲ comparison of first-line crizotinib versus chemotherapy in East Asian patients with ALK-positive advanced non-small cell lung cancer. J Thorac Oncol. 2018; 13(10): 1539-48.
- 9)
- Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8.
- 10)
- Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 371(21): 1963-71.
- 11)
- Wu YL, Yang JC, Kim DW, et al. Phase Ⅱ study of crizotinib in East Asian patients with ROS1-positive advanced non-small-cell lung cancer. J Clin Oncol. 2018; 36(14): 1405-11.
- 12)
- Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016; 17(7): 984-93.
- 13)
- Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017; 18(10): 1307-16.
- 14)
- Paik PK, Felip E, Veillon R, et al. Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med. 2020; 383(10): 931-43. Epub 2020 May 29.
- 15)
- Wolf J, Seto T, Han JY, et al. Capmatinib(INC280)in MET Δ ex14-mutated advanced non-small cell lung cancer(NSCLC): Efficacy data from the phase Ⅱ GEOMETRY mono-1 study. J Clin Oncol. 2019; 37(15 suppl): abstr 9004.
- 16)
- Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014; 311(19): 1998-2006.
- 17)
- Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67.
- 18)
- Solomon BJ, Kim DW, Wu YL, et al. Final overall survival analysis from a study comparing first-line crizotinib versus chemotherapy in ALK-mutation-positive non-small-cell lung cancer. J Clin Oncol. 2018; 36(22): 2251-8.
- 19)
- Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400.
- 20)
- Iwama E, Goto Y, Murakami H, et al. Alectinib for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017; 12(7): 1161-6.
- 21)
- Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations: NEJ 003 study. J Thorac Oncol. 2012; 7(9): 1417-22.
- 22)
- Goto K, Nishio M, Yamamoto N, et al. A prospective, phase Ⅱ, open-label study(JO22903)of first-line erlotinib in Japanese patients with epidermal growth factor receptor(EGFR)mutation-positive advanced non-small-cell lung cancer(NSCLC). Lung Cancer. 2013; 82(1): 109-14.
- 23)
- Yoshioka H, Shimokawa M, Seto T, et al. Final overall survival results of WJTOG3405, a randomized phase Ⅲ trial comparing gefitinib versus cisplatin with docetaxel as the first-line treatment for patients with stage ⅢB/Ⅳ or postoperative recurrent EGFR mutation-positive non-small-cell lung cancer. Ann Oncol. 2019; 30(12): 1978-84.
- 24)
- Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase Ⅲ trial comparing gefitinib with carboplatin-paclitaxel for chemo-naive non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002). Ann Oncol. 2013; 24(1): 54-9.
- 25)
- Inoue A, Yoshida K, Morita S, et al. Characteristics and overall survival of EGFR mutation-positive non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors: a retrospective analysis for 1660 Japanese patients. Jpn J Clin Oncol. 2016; 46(5): 462-7.
- 26)
- Reck M, Mok TSK, Nishio M, et al. Atezolizumab plus bevacizumab and chemotherapy in non-small-cell lung cancer(IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open-label phase 3 trial. Lancet Respir Med. 2019; 7(5): 387-401.
- 27)
- West H, McCleod M, Hussein M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20(7): 924-37.
- 28)
- Lee CK, Man J, Lord S, et al. Clinical and molecular characteristics associated with survival among patients treated with checkpoint inhibitors for advanced non-small cell lung carcinoma: a systematic review and meta-analysis. JAMA Oncol. 2018; 4(2): 210-6.
- 29)
- Gainor JF, Shaw AT, Sequist LV, et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis. Clin Cancer Res. 2016; 22(18): 4585-93.
7-1-2.EGFR遺伝子変異陽性
EGFR遺伝子変異陽性の一次治療:エクソン19欠失またはL858R変異陽性
CQ52.
PS 0-1の場合,一次治療としてどの治療法が勧められるか?*
- 推 奨
-
- a.
- オシメルチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:93%〕
-
- b.
- ゲフィチニブ+カルボプラチン+ペメトレキセドを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:79%〕
-
- c.
- エルロチニブ+血管新生阻害薬を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:86%〕
-
- d.
- ダコミチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:86%〕
-
- e.
- ゲフィチニブ,エルロチニブ,アファチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:75%〕
EGFR遺伝子変異の約90%を占めるエクソン19の欠失変異とエクソン21のL858R変異は,EGFR-TKIの感受性を高める。進行非小細胞肺癌を対象にしたEGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブ)とプラチナ製剤併用療法の第Ⅲ相試験におけるEGFR遺伝子変異の患者はエクソン19の欠失変異とL858R変異に限定されているか1)~3),大部分を占めていた4)~6)。すべての試験において一貫してEGFR-TKIのプラチナ製剤併用療法に対するPFSの有意な延長が報告され,QOL指標の一部が改善することも示されている7)8)。
-
a.EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性,PS 0-1のⅣ期非小細胞肺癌患者を対象として,オシメルチニブ単剤と第一世代EGFR-TKI単剤(ゲフィチニブまたはエルロチニブ)を比較する第Ⅲ相試験(FLAURA試験)が行われ,主要評価項目であるPFSはHR 0.46(18.9カ月vs 10.2カ月,95%CI:0.37-0.57,P<0.001)と有意に延長することが示され9),OSに関してもHR 0.80(38.6カ月vs 31.8カ月,95.05%CI:0.64-1.00,P=0.046)と有意に延長することが示された10)。なお,PFSはサブグループ別の差異を認めなかったが,OSのサブグループ解析では,アジア人やL858R変異の集団において,それぞれのOS-HRが1.00(95%CI:0.75-1.32),1.00(95%CI:0.71-1.40)という結果であった。また毒性においても,第一世代EGFR-TKI単剤では下痢57%,ざ瘡様皮疹48%,AST上昇25%,間質性肺疾患2%に対し,オシメルチニブでは下痢58%,ざ瘡様皮疹25%,AST上昇9%,間質性肺疾患4%であり,皮疹,肝機能障害に関してはオシメルチニブのほうが軽い傾向がみられた。
以上より,治療効果と毒性のバランスを考慮し,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはオシメルチニブを行うよう推奨する。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (26/28) |
7% (2/28) |
0% | 0% | 0% |
-
b.ゲフィチニブ+CBDCA+PEM併用療法とゲフィチニブ単剤療法の第Ⅲ相試験(NEJ009試験)で,主要評価項目の1つであるPFSはHR 0.490(20.9カ月vs 11.9カ月,95%CI:0.39-0.62,P<0.01)であったが,PFS2*においてはHR 0.99(20.9カ月vs 20.7カ月,95%CI:0.78-1.25,P=0.90)と両群間で有意差を認めなかった。OSの解析においては,HR 0.722(50.9カ月vs 38.8カ月)という結果であった。毒性については,併用群でGrade 3以上の血液毒性の頻度が高く,好中球減少(31.2% vs 0.6%),貧血(21.2% vs 2.3%),血小板減少(17.1% vs 0%)であった11)(*PFS2は,ゲフィチニブ単剤療法群において,ゲフィチニブでPDになった後の次治療でPDになるまでの期間と,ゲフィチニブ+CBDCA+PEM併用療法でPDになるまでの期間の比較)。なお,海外で実施された同じデザインの第Ⅲ相試験では,主要評価項目であるPFSはHR 0.51(16カ月vs 8カ月,95%CI:0.39-0.66,P<0.001)であり,OSにおいてもHR 0.45(未到達vs 17カ月,95%CI:0.31-0.65,P<0.001)と併用群において有意な延長がみられた。毒性については,Grade 3以上の毒性が併用群で高く(51% vs 25%),血液毒性,腎障害,低カリウム血症の頻度が高かった12)。
以上より,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはゲフィチニブ+CBDCA+PEMを行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 18% (5/28) |
79% (22/28) |
0% | 0% | 4% (1/28) |
-
c.エルロチニブと血管新生阻害薬の併用療法については,複数の試験が行われている。
エルロチニブ+ベバシズマブの併用療法とエルロチニブ単剤のランダム化第Ⅱ相試験は2編報告されている。本邦で行われたJO25567試験では,主要評価項目であるPFSがHR 0.54(16.0カ月vs 9.7カ月,95%CI:0.36-0.79,P=0.0015)と有意差が認められ,OSではHR 0.81(47.0カ月vs 47.4カ月,95%CI:0.53-1.23)であった13)14)。一方,米国で行われたランダム化第Ⅱ相試験では,主要評価項目であるPFSはHR 0.81(17.9カ月vs 13.5カ月,95%CI:0.50-1.31,P=0.39)と有意な延長が示されず,OSではHR 1.41(32.4カ月vs 50.6カ月,95%CI:0.72-2.81)と上乗せ効果が乏しい傾向がみられた15)。その後,同じデザインで行われた本邦の第Ⅲ相試験(NEJ026試験)では,主要評価項目であるPFSはHR 0.605(16.9カ月vs 13.3カ月,95%CI:0.417-0.877,P=0.01573)とエルロチニブ単剤に対しPFSを有意に延長することが示された16)が,OSはHR 1.00(95%CI:0.68-1.48)であった17)。また毒性については,併用群でベバシズマブ関連の有害事象が認められた(Grade 3以上の高血圧が9%,蛋白尿が32%,出血性事象が26%など)16)。
エルロチニブ+ラムシルマブ併用療法とエルロチニブ+プラセボ療法を比較した第Ⅲ相試験(RELAY試験)では,主要評価項目であるPFSがHR 0.59(19.4カ月vs 12.4カ月,95%CI:0.46-0.79,P<0.0001)と有意に延長することが示された。毒性については,ラムシルマブ群で特有の有害事象が認められており(Grade 3以上の高血圧が24%),その他Grade 3以上の下痢(7% vs 1%),ざ瘡様皮疹(15% vs 9%)が認められた18)。
以上より,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはエルロチニブ+血管新生阻害薬を行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/28) |
86% (24/28) |
4% (1/28) |
4% (1/28) |
4% (1/28) |
*2020年10月時点で,EGFR遺伝子変異陽性に対するラムシルマブは,本邦で保険償還されていない。承認後の使用に際しては,添付文書の記載をよく確認すること。
-
d.EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ダコミチニブ単剤とゲフィチニブ単剤を比較する第Ⅲ相試験(ARCHER1050試験)が行われ,主要評価項目であるPFSはHR 0.59(14.7カ月vs 9.2カ月,95%CI:0.47-0.74,P<0.0001)と,ダコミチニブ単剤はゲフィチニブ単剤に対しPFSを有意に延長することが示された19)。副次評価項目であるOSは,HR 0.760(34.1カ月vs 26.8カ月,95%CI:0.582-0.993)という結果であった20)。しかし,ゲフィチニブでは下痢56%,爪囲炎20%,ざ瘡様皮疹29%に対し,ダコミチニブでは下痢87%,爪囲炎62%,ざ瘡様皮疹49%であり,毒性においてはダコミチニブが強かった。
以上より,効果と毒性のバランスを考慮し,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としてはダコミチニブを行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 86% (24/28) |
11% (3/28) |
0% | 4% (1/28) |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 14% (4/28) |
75% (21/28) |
4% (1/28) |
7% (2/28) |
0% |
CQ53.
PS 2の場合,一次治療としてどの治療法が勧められるか?
- 推 奨
-
- a.
- EGFR-TKI(ゲフィチニブ,エルロチニブのいずれか)を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:86%〕
-
- b.
- ゲフィチニブ+カルボプラチン+ペメトレキセドを行うよう勧めるだけの根拠が明確ではない。
〔推奨度決定不能〕
-
a.EGFR遺伝子変異陽性の進行非小細胞肺癌を対象としたエルロチニブとプラチナ製剤併用療法の2つの第Ⅲ相試験において,PS 2は各々7%,14%含まれておりPS 0-1と同等の有効性が示されている2)3)。また,ゲフィチニブはPS不良例に対する有効性が報告されている23)24)。アファチニブ,ダコミチニブに関しては,PS 2に対する安全性と有効性の検討は十分ではない5)6)11)。オシメルチニブについても,PS 2に対する有効性の検討は十分ではないが,ゲフィチニブやエルロチニブと比較しても間質性肺疾患以外の毒性は軽度であり,使用を考慮し得る9)。
以上より,PS 2の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としては,毒性を考慮したうえで,ゲフィチニブまたはエルロチニブのいずれかのEGFR-TKIが勧められる。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 86% (24/28) |
14% (4/28) |
0% | 0% | 0% |
-
b.海外で実施されたゲフィチニブ+CBDCA+PEM併用療法とゲフィチニブ単剤療法の第Ⅲ相試験において,PS 2は21~22%含まれており,探索的な解析においてPFSのHRは0.57(95%CI:0.33-0.98)で,併用群において良い傾向が示された12)。一方で,Grade 3以上の毒性の頻度は,併用群で58%,単剤群で28%であり,併用群で毒性の頻度が有意に高いことが報告されている25)。なお,前述した試験は海外の単施設で実施されたものであり,バイアスリスクが高く結果に影響を与えている可能性があり,本試験の結果を本邦の日常診療に反映することが可能か小委員会の中でも意見が分かれた。
協議の結果,PS 2の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療において,ゲフィチニブ+CBDCA+PEM併用療法の投与の可否を判断するだけの根拠が明確ではないと判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 46% (13/28) |
39% (11/28) |
14% (4/28) |
0% |
CQ54.
PS 3-4の場合,一次治療としてどのEGFR-TKIが勧められるか?
- 推 奨
- ゲフィチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:75%〕
EGFR遺伝子高感受性変異陽性でPS 3-4が大多数を占める予後不良群を対象としてゲフィチニブの投与を評価する第Ⅱ相試験(NEJ001試験)が行われ,約80%の患者でPSが改善し,ORR 66%,OS中央値17.8カ月,PFS中央値6.5カ月と極めて良好な治療効果が得られた23)。一方,PS不良,男性,喫煙歴,既存の間質性肺炎,正常肺領域が少ない患者,心疾患を合併した患者などで間質性肺障害発症のリスクが高いことが報告されており26)27),慎重な検討も必要である。なお,ガイドライン検討委員会薬物療法及び集学的治療小委員会では,特にPS 4に対する投与の是非について議論がなされた。このような集団においては益の評価項目としてPSや症状の改善は重要であり,EGFR-TKIによってこれらの改善が期待されるものであるのかを十分吟味する必要がある。
以上より,PS 3-4の場合,EGFR遺伝子変異(エクソン19欠失またはL858R変異)陽性例の一次治療としては,ゲフィチニブが勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 75% (18/24) |
25% (6/24) |
0% | 0% | 0% |
EGFR遺伝子変異陽性の一次治療:エクソン18-21変異(エクソン19欠失・L858R変異を除く)
CQ55.
PS 0-1の場合,一次治療としてどのEGFR-TKIが勧められるか?
- 推 奨
-
- a.
- エクソン18-21の遺伝子変異(エクソン19欠失・L858R変異・エクソン20の挿入変異・T790M変異以外)にはEGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブ,オシメルチニブ)による治療を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:78%〕
-
- b.
- エクソン20の挿入変異にはEGFR-TKIを行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:70%〕
-
- c.
- EGFR-TKI未治療のT790M変異にオシメルチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:67%〕
*EGFR遺伝子変異の種類,検査法などの詳細については「肺癌患者におけるEGFR遺伝変異検査の手引き」(日本肺癌学会)を参照
*Uncommon mutationがある場合は,エクソン19の欠失とL858R変異が同時にあったとしても,uncommon mutationに分類する。
-
a.EGFR遺伝子変異の約90%をエクソン19の欠失変異,エクソン21のL858R変異が占める。その他の遺伝子変異はuncommon mutationと称され,エクソン18-21にわたり(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)が報告されている28)。これらの変異でもEGFR-TKIの感受性を有する変異はあるが,ORRはやや劣ると報告されている29)。また,過去の第Ⅲ相試験の多くは,これらの変異が除外されている1)~3)か,含まれたとしても全体の1割程度にすぎない4)~6)。
T790Mとエクソン20の挿入変異以外のuncommon mutationでは,EGFR-TKIの効果が報告されている。ゲフィチニブ,エルロチニブの後方視的検討では,ORRは48.4%,PFS中央値は5.0カ月29),アファチニブの3つの前向き試験のプール解析では,ORRは71.1%,PFS中央値は10.7カ月と報告されている30)。また,海外で実施されたuncommon mutationに対するオシメルチニブの第Ⅱ相試験(KCSG-LU15-09試験)では,ORRは50%(95%CI:33-67%),PFS中央値は8.2カ月であった31)。ただし,それぞれの報告でuncommon mutationの頻度や効果が異なっていることから,これらの結果をもとに各EGFR-TKIを比較することは根拠に乏しいと考えられる。
以上より,エクソン18-21の遺伝子変異(エクソン19欠失・L858R変異・エクソン20の挿入変異・T790M変異以外)陽性例に対しては,ゲフィチニブ,エルロチニブ,アファチニブ,オシメルチニブのいずれかのEGFR-TKIが勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 22% (6/27) |
78% (21/27) |
0% | 0% | 0% |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 4% (1/27) |
0% | 26% (7/27) |
70% (19/27) |
-
c.EGFR-TKIによる治療の前にT790M変異陽性の患者の報告は少なく,前述のFLAURA試験でもT790M変異を認めたのは556例中5例のみであった。なお,オシメルチニブの第Ⅰ相試験では未治療のT790M変異陽性の患者7例中6例で部分奏効を認めている33)。EGFR-TKI未治療のT790M変異に対するデータは限られているが,既治療のT790M変異陽性に対するオシメルチニブの効果は第Ⅲ相試験でも示されており,未治療例においても効果が期待できると考えられる。
以上より,EGFR-TKI未治療のT790M変異陽性例に対しては,オシメルチニブが勧められる。エビデンスの強さはD,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/27) |
67% (18/27) |
29% (8/27) |
0% | 0% |
EGFR遺伝子変異陽性の二次治療以降
CQ56.
一次治療EGFR-TKI*耐性または増悪後のT790M変異陽性例に対する最適な二次治療は何か?
- 推 奨
- 一次治療EGFR-TKI*耐性または増悪後のT790M変異陽性例に対するオシメルチニブによる治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
*オシメルチニブを一次治療で用いた場合には当該CQには当てはまらない。
オシメルチニブは,活性型EGFR遺伝子変異と耐性変異であるEGFR T790M変異の両方を阻害する第三世代EGFR-TKIである。第一・二世代のEGFR-TKIによる治療の後にT790M変異陽性となった患者を対象にオシメルチニブとプラチナ製剤併用療法(CDDPまたはCBDCA+PEM療法)を比較した第Ⅲ相試験(AURA3試験)が報告された34)。主要評価項目であるPFSの中央値は,オシメルチニブ群が10.1カ月,プラチナ製剤併用療法群が4.4カ月(HR 0.30,95%CI:0.23-0.41,P<0.001)であった。Grade 3以上の毒性の頻度もオシメルチニブ群が低かった(6% vs 34%)。
以上より,一次治療EGFR-TKI耐性または増悪後のT790M変異陽性例に対しては,オシメルチニブが勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (26/26) |
0% | 0% | 0% | 0% |
- 1)
- Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8.
- 2)
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42.
- 3)
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46.
- 4)
- Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8.
- 5)
- Sequist LV, Yang JC, Yamamoto N, et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013; 31(27): 3327-34.
- 6)
- Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22.
- 7)
- Oizumi S, Kobayashi K, Inoue A, et al. Quality of life with gefitinib in patients with EGFR-mutated non-small cell lung cancer: quality of life analysis of North East Japan Study Group 002 Trial. Oncologist. 2012; 17(6): 863-70.
- 8)
- Wu YL, Hirsh V, Sequist LV, et al. Does EGFR mutation type influence patient-reported outcomes in patients with advanced EGFR mutation-positive non-small-cell lung cancer? Analysis of two large, phase Ⅲ studies comparing afatinib with chemotherapy(LUX-Lung 3 and LUX-Lung 6). Patient. 2018; 11(1): 131-41.
- 9)
- Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018; 378(2): 113-25.
- 10)
- Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med. 2020; 382(1): 41-50. Epub 2019 Nov 21.
- 11)
- Hosomi Y, Morita S, Sugawara S, et al. Gefitinib alone versus gefitinib plus chemotherapy for non-small-cell lung cancer with mutated epidermal growth factor receptor: NEJ009 Study. J Clin Oncol. 2020; 38(2): 115-23. Epub 2019 Nov 4.
- 12)
- Noronha V, Patil VM, Joshi A, et al. Gefitinib versus gefitinib plus pemetrexed and carboplatin chemotherapy in EGFR-Mutated Lung Cancer. J Clin Oncol. 2020; 38(2): 124-36. Epub 2019 Aug 14.
- 13)
- Seto T, Kato T, Nishio M, et al. Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations(JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol. 2014; 15(11): 1236-44.
- 14)
- Yamamoto N, Seto T, Nishio M, et al. Erlotinib plus bevacizumab(EB)versus erlotinib alone(E)as first-line treatment for advanced EGFR mutation-positive non-squamous non-small-cell lung cancer(NSCLC): Survival follow-up results of JO25567. J Clin Oncol 36, 2018(suppl; abstr 9007).
- 15)
- Stinchcombe TE, Jänne PA, Wang X, et al. Effect of erlotinib plus bevacizumab vs erlotinib alone on progression-free survival in patients with advanced EGFR-mutant non-small cell lung cancer: a phase 2 randomized clinical trial. JAMA Oncol. 2019; 5(10): 1448-55.
- 16)
- Saito H, Fukuhara T, Furuya N, et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer(NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol. 2019; 20(5): 625-35.
- 17)
- Maemondo M, Fukuhara T, Saito H, et al. NEJ026: Final overall survival analysis of bevacizumab plus erlotinib treatment for NSCLC patients harboring activating EGFR-mutations. J Clin Oncol. 2020; 38(15 suppl): abstr 9506.
- 18)
- Nakagawa K, Garon EB, Seto T, et al. Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer(RELAY): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019; 20(12): 1655-69. Epub 2019 Oct 4.
- 19)
- Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer(ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol. 2017; 18(11): 1454-66.
- 20)
- Mok TS, Cheng Y, Zhou X, et al. Improvement in overall survival in a randomized study that compared dacomitinib with gefitinib in patients with advanced non-small-cell lung cancer and EGFR-activating mutations. J Clin Oncol. 2018; 36(22): 2244-50.
- 21)
- Yang JJ, Zhou Q, Yan HH, et al. A phase Ⅲ randomised controlled trial of erlotinib vs gefitinib in advanced non-small cell lung cancer with EGFR mutations. Br J Cancer. 2017; 116(5): 568-74.
- 22)
- Park K, Tan EH, O'Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer(LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016; 17(5): 577-89.
- 23)
- Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400.
- 24)
- Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations: NEJ 003 study. J Thorac Oncol. 2012; 7(9): 1417-22.
- 25)
- Prabhash K, Noronha V, Patil V, et al. P1.01-88 PS 2 patients with advanced EGFR Mutant NSCLC: subset analysis of a Phase Ⅲ randomized trial comparing gefitinib to gefitinib with chemotherapy. J Thorac Oncol. 2019; 14(10): suppl. S395.
- 26)
- Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer: a cohort and nested case-control study. Am J Respir Crit Care Med. 2008; 177(12): 1348-57.
- 27)
- Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006; 24(16): 2549-56.
- 28)
- Beau-Faller M, Prim N, Ruppert AM, et al. Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol. 2014; 25(1): 126-31.
- 29)
- Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on“uncommon”epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res. 2011; 17(11): 3812-21.
- 30)
- Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8.
- 31)
- Cho JH, Lim SH, An HJ, et al. Osimertinib for patients with non-small-cell lung cancer harboring uncommon EGFR mutations: a multicenter, open-label, phase Ⅱ trial(KCSG-LU15-09). J Clin Oncol. 2020; 38(5): 488-95. Epub 2019 Dec 11.
- 32)
- Yasuda H, Kobayashi S, Costa DB. EGFR exon 20 insertion mutations in non-small-cell lung cancer: preclinical data and clinical implications. Lancet Oncol. 2012; 13(1): e23-31.
- 33)
- Ramalingam SS, Yang JC, Lee CK, et al. Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol. 2018; 36(9): 841-9.
- 34)
- Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med. 2017; 376(7): 629-40.
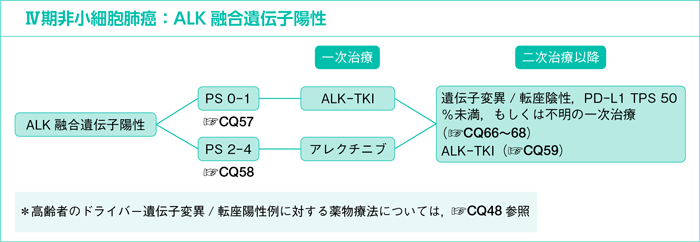
7-1-3.ALK融合遺伝子陽性
ALK融合遺伝子陽性の一次治療
CQ57.
PS 0-1の場合,一次治療としてどのALK-TKIが勧められるか?*
- 推 奨
-
- a.
- アレクチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- クリゾチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:96%〕
-
- c.
- セリチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:96%〕
*aとb,cはCQにおける対照(comparisons)が異なっており,エビデンスの強さの評価において異なる基準 を用いている(システマティックレビュー表を参照)。
ALK融合遺伝子陽性の患者に対してALK-TKIとプラチナ製剤併用療法を比較した第Ⅲ相試験では,すべての試験において一貫してALK-TKIのプラチナ製剤併用療法に対するPFSの有意な延長が報告され,QOL指標の一部においてALK-TKIのほうがプラチナ製剤併用療法より優れることが示されている1)~3)。なお,ALK-TKI同士を比較した試験でOSの有意な延長効果を示した薬剤は現時点ではない。
-
a.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,アレクチニブとクリゾチニブを比較した第Ⅲ相試験が3編報告されている。国内で実施された試験(J-ALEX試験)ではPFSのHRが0.38(25.9カ月vs 10.2カ月,95%CI:0.26-0.55,P<0.0001)と,PFSを有意に延長することが示された4)。その後に,米国で行われた試験(ALEX試験)において,PFSのHRが0.47(未到達vs 11.1カ月,95%CI:0.34-0.65,P<0.001),アジアで行われた試験(ALESIA試験)において,PFSのHRが0.22(未到達vs 11.1カ月,95%CI:0.13-0.38,P<0.0001)と,同じくPFSを有意に延長することが示されている5)6)。またGrade 3以上の有害事象は,J-ALEX試験においてアレクチニブで32%,クリゾチニブで57%とアレクチニブのほうが低頻度であった7)。アレクチニブの主な毒性は,味覚障害,筋肉痛,皮疹であり,また他のキナーゼ阻害薬と同様に間質性肺炎に注意が必要である。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはアレクチニブを行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (27/27) |
0% | 0% | 0% | 0% |
-
b.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,クリゾチニブとプラチナ製剤併用療法を比較した2つの第Ⅲ相試験が行われ,PROFILE1014試験ではPFSのHR 0.45(10.9カ月vs 7.0カ月,95%CI:0.35-0.60,P<0.0001),PROFILE1029試験ではPFSのHR 0.402(11.1カ月vs 6.8カ月,95%CI:0.286-0.565,P<0.001)であり,ともにクリゾチニブのプラチナ製剤併用療法に対する有意な延長が報告されている1)3)。クリゾチニブの主な毒性は,視覚障害,下痢や悪心などの消化器毒性,肝機能障害が挙げられる。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはクリゾチニブを行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 96% (26/27) |
0% | 0% | 4% (1/27) |
-
c.ALK融合遺伝子陽性,PS 0-1のⅣ期非小細胞肺癌を対象として,セリチニブとプラチナ製剤併用療法を比較した第Ⅲ相試験(ASCEND-4試験)が行われ,主要評価項目であるPFSはHR 0.55(16.6カ月vs 8.1カ月,95%CI:0.42-0.73,P<0.0001)であり,セリチニブのプラチナ製剤併用療法に対する有意な延長が認められた。しかしGrade 3以上の有害事象は,セリチニブで65%,プラチナ製剤併用療法で49%とセリチニブのほうが高頻度であった。セリチニブの主な毒性は,下痢,悪心,嘔吐などの消化器毒性,肝機能障害,食思不振が認められている2)。
以上より,治療効果と毒性のバランスを考慮し,ALK融合遺伝子陽性例の一次治療としてはセリチニブを行うよう提案する。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 96% (26/27) |
0% | 0% | 4% (1/27) |
CQ58.
PS 2-4の場合,一次治療としてどのALK-TKIが勧められるか?
- 推 奨
- アレクチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
ALK融合遺伝子陽性の患者に対するアレクチニブは,PS不良例に対する有効性が報告されている8)。本邦において,ALK融合遺伝子陽性のPS不良患者を対象として,アレクチニブの有効性および安全性を評価した第Ⅱ相試験(LOGiK1401試験)が行われた。患者数はPS 2:12例,PS 3:5例,PS 4:1例であるが,安全性に大きな問題はなかった。主要評価項目であるORRは72.2%,PFS中央値は10.1カ月であり,さらに83.3%の患者でPSの改善を認めた。同試験のアップデートでは,PFS中央値が16.2カ月,OS中央値は30.3カ月であったと追加報告されている9)。
以上より,PS 2-4の場合,ALK融合遺伝子陽性例の一次治療としては,アレクチニブが勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (27/27) |
0% | 0% | 0% | 0% |
ALK融合遺伝子陽性の二次治療以降
CQ59.
一次治療ALK-TKI耐性または増悪後のPS 0-2に対する最適なALK-TKIは何か?*
- 推 奨
-
- a.
- アレクチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:77%〕
-
- b.
- ロルラチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:59%〕
-
- c.
- ブリグチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:55%〕
-
- d.
- セリチニブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:85%〕
*一次治療で用いたALK-TKIと異なる薬剤の推奨を示す。
-
a.クリゾチニブ耐性後のALK融合遺伝子陽性進行非小細胞肺癌を対象とし,アレクチニブを投与する第Ⅱ相試験が行われ,ORR 48~50%,PFS中央値8.1~8.9カ月の良好な成績が報告されている10)11)。本邦で行われたクリゾチニブ既治療の23例に対しアレクチニブを投与した試験では,ORR 65%,PFS中央値は12.9カ月であった12)。また,クリゾチニブならびにプラチナ製剤併用療法施行後の症例に対し,アレクチニブと標準化学療法を比較する第Ⅲ相試験(ALUR試験)が行われ,主要評価項目であるPFSはHR 0.15(9.6カ月vs 1.4カ月,95%CI:0.08-0.29,P<0.001)であり,細胞傷害性抗癌薬(DTX単剤またはPEM単剤)に対し,PFSを有意に延長することが示された13)。
以上より,一次治療ALK-TKI耐性または増悪後のPS 0-2の患者には,初回ALK-TKIがクリゾチニブの場合,アレクチニブによる治療が勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 77% (20/26) |
19% (5/26) |
0% | 4% (1/26) |
0% |
-
b.ALK融合遺伝子陽性例を対象としたロルラチニブの第Ⅱ相試験が行われ,クリゾチニブ治療後に増悪した症例(59例)においては,ORR 69.5%,PFS中央値は未到達(95%CI:12.5カ月-未到達),クリゾチニブ以外のALK-TKI治療後に増悪した症例(28例)においては,ORR 32.1%,PFS中央値は5.5カ月,2レジメン以上のALK-TKI治療後に増悪した症例(111例)においては,ORR 38.7%,PFS中央値は6.9カ月,とそれぞれ成績が示されている。主な毒性は,高コレステロール血症,高トリグリセリド血症,浮腫であり,重篤な有害事象として認知機能障害(1%)が報告されている14)。
以上より,一次治療ALK-TKI耐性または増悪後のPS 0-2の患者には,ロルラチニブによる治療が勧められる。エビデンスの強さはC,また総合的評価では行うことを弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 59% (16/27) |
41% (11/27) |
0% | 0% | 0% |
-
c.クリゾチニブ耐性後のALK融合遺伝子陽性例を対象としたブリグチニブの第Ⅱ相試験(ALTA試験)が行われ,ブリグチニブ90mg/日を1週間投与後に180mg/日に増量する群においてORR 54%,PFS中央値12.9カ月の成績が示された。主な毒性は,下痢,悪心,嘔吐などの消化器毒性,高血圧,クレアチンキナーゼ上昇,皮疹,間質性肺炎であった15)。さらに,ブリグチニブの投与によってQOL指標の一部が改善することが示されている16)。
以上より,一次治療ALK-TKI耐性または増悪後のPS 0-2の患者には,初回ALK-TKIがクリゾチニブの場合,ブリグチニブによる治療が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 41% (11/27) |
55% (15/27) |
4% (1/27) |
0% | 0% |
*2020年10月時点で,ブリグチニブは本邦で保険償還されていない。承認後の使用に際しては,添付文書の記載をよく確認すること。
-
d.クリゾチニブならびにプラチナ製剤併用療法後に増悪したALK融合遺伝子陽性例を対象としたセリチニブの第Ⅱ相試験(ASCEND-2試験)が行われ,ORR 38.6%,PFS中央値5.7カ月の成績が示されている17)。また同様の症例を対象に,セリチニブと標準化学療法を比較した第Ⅲ相試験(ASCEND-5試験)においては,主要評価項目であるPFSのHR 0.49(5.4カ月vs 1.6カ月,95%CI:0.36-0.67,P<0.001)であり,細胞傷害性抗癌薬(DTX単剤またはPEM単剤)に対しPFSを有意に延長することが示された18)。さらに,前治療でアレクチニブ使用歴のある20症例に対するセリチニブの第Ⅱ相試験(ASCEND-9試験)が本邦で行われ,ORR 25%,PFS中央値3.7カ月であった19)。
以上より,一次治療ALK-TKI耐性または増悪後のPS 0-2の患者には,セリチニブによる治療が勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 7% (2/27) |
85% (23/27) |
4% (1/27) |
4% (1/27) |
0% |
- 1)
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77.
- 2)
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer(ASCEND-4): a randomised, open-label, phase 3 study. Lancet. 2017; 389(10072): 917-29.
- 3)
- Wu YL, Lu S, Lu Y, et al. Results of PROFILE 1029, a phase Ⅲ comparison of first-line crizotinib versus chemotherapy in East Asian patients with ALK-positive advanced non-small cell lung cancer. J Thorac Oncol. 2018; 13(10): 1539-48.
- 4)
- Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer(J-ALEX): an open-label, randomised phase 3 trial. Lancet. 2017; 390(10089): 29-39.
- 5)
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med. 2017; 377(9): 829-38.
- 6)
- Zhou C, Kim SW, Reungwetwattana T, et al. Alectinib versus crizotinib in untreated Asian patients with anaplastic lymphoma kinase-positive non-small-cell lung cancer(ALESIA): a randomised phase 3 study. Lancet Respir Med. 2019; 7(5): 437-46.
- 7)
- Takiguchi Y, Hida T, Nokihara H, et al. Updated efficacy and safety of the j-alex study comparing alectinib(ALC)with crizotinib(CRZ)in ALK-inhibitor naïve ALK fusion positive non-small cell lung cancer(ALK+NSCLC). J Clin Oncol. 2017; 35(15 suppl 9064).
- 8)
- Iwama E, Goto Y, Murakami H, et al. Alectinib for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017; 12(7): 1161-6.
- 9)
- Iwama E, Goto Y, Murakami H, et al. Survival analysis for patients with ALK rearrangement-positive non-small cell lung cancer and a poor performance status treated with alectinib: updated results of Lung Oncology Group in Kyushu 1401. Oncologist. 2020; 25(4): 306-e618. Epub 2019 Oct 30.
- 10)
- Ou SH, Ahn JS, De Petris L, et al. Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer: a phase Ⅱ global study. J Clin Oncol. 2016; 34(7): 661-8.
- 11)
- Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol. 2016; 17(2): 234-42.
- 12)
- Hida T, Nakagawa K, Seto T, et al. Pharmacologic study(JP28927)of alectinib in Japanese patients with ALK+ non-small-cell lung cancer with or without prior crizotinib therapy. Cancer Sci. 2016; 107(11): 1642-6.
- 13)
- Novello S, Mazières J, Oh IJ, et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase(ALK)-positive non-small-cell lung cancer: results from the phase Ⅲ ALUR study. Ann Oncol. 2018; 29(6): 1409-16.
- 14)
- Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol. 2018; 19(12): 1654-67.
- 15)
- Kim DW, Tiseo M, Ahn MJ, et al. Brigatinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small-cell lung cancer: a randomized, multicenter phase Ⅱ trial. J Clin Oncol. 2017; 35(22): 2490-8.
- 16)
- Lenderking WR, Lin H, Speck RM, et al. Patient-reported outcomes and quality of life in advanced ALK+ non-small-cell lung cancer trial of brigatinib(ALTA). Future Oncol. 2019; 15(24): 2841-55.
- 17)
- Crinò L, Ahn MJ, De Marinis F, et al. Multicenter phase Ⅱ study of whole-body and intracranial activity with ceritinib in patients with ALK-rearranged non-small-cell lung cancer previously treated with chemotherapy and crizotinib: results from ASCEND-2. J Clin Oncol. 2016; 34(24): 2866-73.
- 18)
- Shaw AT, Kim TM, Crinò L, et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib(ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2017; 18(7): 874-86.
- 19)
- Hida T, Seto T, Horinouchi H, et al. Phase Ⅱ study of ceritinib in alectinib-pretreated patients with anaplastic lymphoma kinase-rearranged metastatic non-small-cell lung cancer in Japan: ASCEND-9. Cancer Sci. 2018; 109(9): 2863-72.
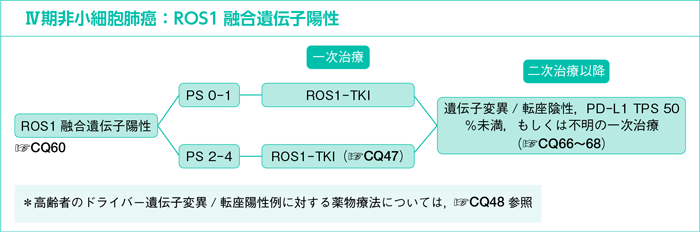
7-1-4.ROS1融合遺伝子陽性
CQ60.
ROS1融合遺伝子陽性にROS1-TKIは勧められるか?
- 推 奨
-
- a.
- クリゾチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:92%〕
-
- b.
- エヌトレクチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:67%〕
-
a.ROS1融合遺伝子陽性の非小細胞肺癌ではクリゾチニブの効果が複数報告されている。米国を中心とした試験では50例が参加し,ORRは72%,PFS中央値19.2カ月1),追加報告(53例)でのOS中央値は51.4カ月であった2)。本邦を含む東アジアで実施された試験では,127例が登録され,ORR 71.7%,PFS中央値15.9カ月であった3)。その他,同じデザインで行われた第Ⅱ相試験3編4)~6)を含めた5試験の統合解析はORR 67%(95%CI:58-75%)であり,いずれの試験においても一貫して良好な成績が示されている。
以上より,ROS1融合遺伝子陽性例に対しては,クリゾチニブが勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 92% (22/24) |
8% (2/24) |
0% | 0% | 0% |
-
b.ROS1融合遺伝子陽性の非小細胞肺癌に対して,エヌトレクチニブを評価した2つの第Ⅰ相試験(ALKA-372-001試験,STARTRK-1試験),および第Ⅱ相試験(STARTRK-2試験)の統合解析が報告された。全体で53例のROS1融合遺伝子陽性例が登録され,主要評価項目であるORRは77%,PFS中央値は19.0カ月であった7)。エヌトレクチニブの主な毒性は,味覚障害,便秘,下痢などの消化器毒性,倦怠感,浮腫,クレアチニン上昇,ヘモグロビン低下が挙げられる。なお,今回の統合解析においてクリゾチニブ既治療例は含まれておらず,クリゾチニブ耐性後のエヌトレクチニブの効果は明らかでない。
以上より,ROS1融合遺伝子陽性例に対しては,エヌトレクチニブが勧められる。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 67% (16/24) |
33% (8/24) |
0% | 0% | 0% |
- 1)
- Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 371(21): 1963-71.
- 2)
- Shaw AT, Riely GJ, Bang YJ, et al. Crizotinib in ROS1-rearranged advanced non-small-cell lung cancer(NSCLC): updated results, including overall survival, from PROFILE 1001. Ann Oncol. 2019; 30(7): 1121-6.
- 3)
- Wu YL, Yang JC, Kim DW, et al. Phase Ⅱ study of crizotinib in East Asian patients with ROS1-positive advanced non-small-cell lung cancer. J Clin Oncol. 2018; 36(14): 1405-11.
- 4)
- Michels S, Massutí B, Schildhaus HU, et al. Safety and efficacy of crizotinib in patients with advanced or metastatic ROS1-rearranged lung cancer(EUCROSS): a european phase Ⅱ clinical trial. J Thorac Oncol. 2019; 14(7): 1266-76.
- 5)
- Landi L, Chiari R, Tiseo M, et al. Crizotinib in MET-deregulated or ROS1-rearranged pretreated non-small cell lung cancer(METROS): a phase Ⅱ, prospective, multicenter, two-arms trial. Clin Cancer Res. 2019; 25(24): 7312-9. Epub 2019 Aug 15.
- 6)
- Moro-Sibilot D, Cozic N, Pérol M, et al. Crizotinib in c-MET- or ROS1-positive NSCLC: results of the AcSé phase Ⅱ trial. Ann Oncol. 2019; 30(12): 1985-91.
- 7)
- Drilon A, Siena S, Dziadziuszko R, et al. Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020; 21(2): 261-70. Epub 2019 Dec 11.
7-1-5.BRAF遺伝子変異陽性
CQ61.
BRAF遺伝子変異陽性にダブラフェニブ+トラメチニブは勧められるか?
- 推 奨
- ダブラフェニブ+トラメチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:69%〕
BRAF遺伝子変異陽性の非小細胞肺癌ではダブラフェニブ単剤や,ダブラフェニブ+トラメチニブ併用療法の効果が複数報告されている。Ⅳ期非小細胞肺癌のBRAF V600E遺伝子変異陽性の既治療例57例を対象とした,ダブラフェニブとトラメチニブの併用療法の第Ⅱ相試験が行われ,主要評価項目のORRは66.7%,PFS中央値は9.7カ月であった1)。Ⅳ期非小細胞肺癌のBRAF V600E遺伝子変異陽性の未治療例36例を対象とした,ダブラフェニブとトラメチニブの併用療法の第Ⅱ相試験では,主要評価項目のORRは64%,PFS中央値は10.9カ月であった2)。ただし,両試験に登録された日本人の症例数が限られている。ダブラフェニブとトラメチニブの併用療法では,主な毒性として発熱,肝機能障害,心駆出率減少が認められている。
以上より,BRAF遺伝子変異陽性例に対しては,ダブラフェニブ+トラメチニブが勧められる。エビデンスの強さはC,総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 58% (15/26) |
42% (11/26) |
0% | 0% | 0% |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 69% (18/26) |
31% (8/26) |
0% | 0% | 0% |
- 1)
- Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016; 17(7): 984-93.
- 2)
- Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol. 2017; 18(10): 1307-16.
7-1-6.MET遺伝子変異陽性
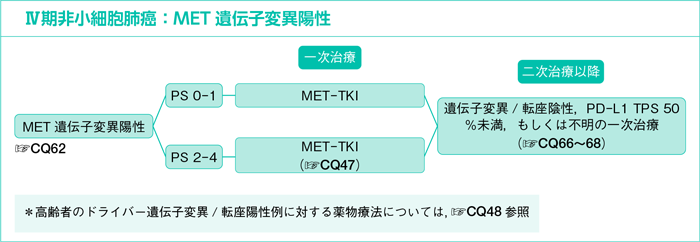
CQ62.
MET遺伝子変異陽性にMET-TKIは勧められるか?
- 推 奨
- MET-TKI(テポチニブ,カプマチニブ)を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:92%〕
MET遺伝子変異(エクソン14スキッピング変異)陽性の非小細胞肺癌を対象として,テポチニブの第Ⅱ相試験(VISION試験)が行われた。主要評価項目はORRであった。有効性評価が可能であった146例のORRは44.5%,そのうち観察期間が9カ月以上得られたコホート(99例)におけるORRは46%,PFS中央値は8.5カ月,OS中央値は17.1カ月であった。テポチニブの主な毒性は,末梢浮腫,悪心,下痢,クレアチニン上昇が認められている。なお,テポチニブの投与によってQOL指標の一部が改善することが示されている1)。
また,同じくMET遺伝子変異(エクソン14スキッピング変異)陽性の非小細胞肺癌を対象として,カプマチニブの第Ⅱ相試験(GEOMETRY mono-1試験)が行われた。主要評価項目はORRであった。二~三次治療例コホート(69例)におけるORRは40.6%,PFS中央値は5.42カ月であり,初回治療例コホート(28例)におけるORRは67.9%,PFS中央値は9.69カ月であった。カプマチニブの主な毒性は,末梢浮腫,倦怠感,悪心嘔吐,クレアチニン上昇が認められている2)。
以上より,MET遺伝子変異陽性例に対しては,テポチニブ・カプマチニブが勧められる。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 92% (23/25) |
8% (2/25) |
0% | 0% | 0% |
- 1)
- Paik PK, Felip E, Veillon R, et al. Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med. 2020; 383(10): 931-43. Epub 2020 May 29.
- 2)
- Wolf J, Seto T, Han JY, et al. Capmatinib(INC280)in MET Δ ex14-mutated advanced non-small cell lung cancer(NSCLC): Efficacy data from the phase Ⅱ GEOMETRY mono-1 study. J Clin Oncol. 2019; 37(15 suppl): abstr 9004.
7-1-7.NTRK融合遺伝子陽性
CQ63.
NTRK融合遺伝子陽性*にエヌトレクチニブは勧められるか?
- 推 奨
- エヌトレクチニブを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:D,合意率:66%〕
*主にがん遺伝子パネル検査で検索されるため,実施可能な施設は限られる(2020年10月時点)。
NTRK融合遺伝子陽性の固形癌に対して,エヌトレクチニブを評価する試験が癌腫横断的に行われた。2つの第Ⅰ相試験(ALKA-372-001試験,STARTRK-1試験)では,有効性評価が可能な症例のうちNTRK融合遺伝子陽性例の3例中1例にNSCLCが含まれており,奏効が得られている1)。前述した第Ⅰ相試験および第Ⅱ相試験(STARTRK-2試験)の統合解析では,全体で54例のNTRK融合遺伝子陽性固形癌が登録され,主要評価項目であるORRは57%,PFS中央値は11カ月であった2)。そのうちNSCLCは10例(19%)含まれており,ORRは70%,PFS中央値は14.9カ月であった3)。ただし,前述した臨床試験における日本人の登録症例数は限られている。エヌトレクチニブの主な毒性は,味覚障害,便秘,下痢などの消化器毒性,倦怠感,浮腫,クレアチニン上昇,ヘモグロビン低下が挙げられる。
以上より,NTRK融合遺伝子陽性例に対しては,エヌトレクチニブが勧められる。エビデンスの強さはD,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 66% (19/29) |
34% (10/29) |
0% | 0% | 0% |
- 1)
- Drilon A, Siena S, Ou SI, et al. Safety and antitumor activity of the multitargeted pan-TRK, ROS1, and ALK inhibitor entrectinib: combined results from two phase Ⅰ trials(ALKA-372-001 and STARTRK-1). Cancer Discov. 2017; 7(4): 400-9.
- 2)
- Doebele RC, Drilon A, Paz-Ares L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol. 2020; 21(2): 271-82. Epub 2019 Dec 11.
- 3)
- Paz-Ares L, Doebele RC, Farago AF, et al. Entrectinib in NTRK fusion-positive non-small cell lung cancer(NSCLC): integrated analysis of patients(pts)enrolled in STARTRK-2, STARTRK-1 and ALKA-372-001. Annals of Oncology. 2019; 30(suppl 2): ii48-49.
- 7-2
- PD-L1 TPS 50%以上
樹形図
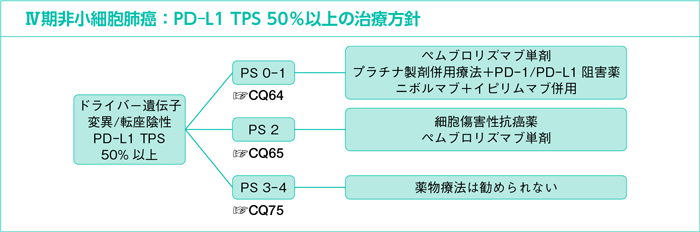
CQ64.
全身状態良好(PS 0-1)なPD-L1 TPS 50%以上に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- ペムブロリズマブ単剤を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:93%〕
-
- b.
- プラチナ製剤併用療法+PD-1/PD-L1阻害薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:85%〕
-
- c.
- ニボルマブ+イピリムマブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:70%〕
-
a.EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 50%以上のPS 0-1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-024試験)が行われた1)。中間解析において,主要評価項目であるPFSはHR 0.50(10.3カ月vs 6.0カ月,95%CI:0.37-0.68,P<0.001),OSは更新された報告において,HR 0.63(30.0カ月vs 14.2カ月,95%CI:0.47-0.86,P=0.002)であり2),ペムブロリズマブ単剤はプラチナ製剤併用療法に対しPFS,OSを有意に延長することが示された。また,ORRは44.8% vs 27.8%であり,ペムブロリズマブ単剤が有意に優れていた。主な毒性は,ペムブロリズマブ群で下痢や倦怠感,発熱,プラチナ製剤併用療法群で貧血,悪心,倦怠感などであり,Grade 3以上の毒性はペムブロリズマブ群で有意に少なかった(26.6% vs 53.3%)。一方,ペムブロリズマブ群で甲状腺機能障害,肺臓炎,皮疹,大腸炎などの免疫関連の毒性が報告されGrade 3以上は9.7%と報告されており,それらの毒性管理には注意が必要である。またQOLにおいて,ペムブロリズマブ群がプラチナ製剤併用療法に比べて有意に肺癌による症状が悪化するまでの期間を遅らせることが報告されている3)。
さらに,前述した試験と同様のデザインで,PD-L1 TPS 1%以上を対象として,ペムブロリズマブ単剤とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-042試験)が行われた4)。PD-L1 TPS 50%以上のサブグループにおける解析では,主要評価項目であるOSはHR 0.69(20.0カ月vs 12.2カ月,95%CI:0.56-0.85,P=0.0003)とペムブロリズマブ単剤はプラチナ製剤併用療法に対しOSを有意に延長することが示され,また,PFSはHR 0.81(7.1カ月vs 6.4カ月,95%CI:0.67-0.99)であり,PFSも延長することが示された。また,ORRは39% vs 32%であった。主な毒性は,前述するKEYNOTE-024試験と同様であり,これらの毒性管理には注意が必要である。
なお,75歳以上の症例において,有効性,安全性に関する報告は少ない。ペムブロリズマブ単剤を検証した第Ⅲ相試験における75歳以上の症例の統合解析では,ペムブロリズマブ単剤が細胞傷害性抗癌薬に比べてGrade 3以上の毒性の頻度が低いことが報告されている(24.2% vs 61.0%)5)。ただし,75歳以上と75歳未満のGrade 3以上の毒性頻度はそれぞれ24.2%,16.9%と高齢者で高い傾向にあり,毒性管理には十分な注意が必要である。
以上より,PD-L1 TPS 50%以上のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してペムブロリズマブ単剤療法を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (25/27) |
7% (2/27) |
0% | 0% | 0% |
-
b-1.非扁平上皮癌
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-189試験)が行われた6)。中間解析において,主要評価項目であるPFSおよびOSは,それぞれHR 0.52(8.8カ月vs 4.9カ月,95%CI:0.43-0.64,P<0.0001),HR 0.49(未到達vs 11.3カ月,95%CI:0.38-0.64,P<0.0001)であり,CDDP+PEM療法もしくはCBDCA+PEM療法に対するペムブロリズマブの上乗せはPFS,OSを有意に延長することが示された。また,PD-L1 TPS 50%以上のサブグループ解析においても,PFSはHR 0.36(9.4カ月vs 4.7カ月,95%CI:0.25-0.52),OSはHR 0.42(未到達vs 10.0カ月,95%CI:0.26-0.68)と有意に生存を延長した。主な毒性は,ペムブロリズマブ併用群で悪心,貧血,倦怠感,便秘などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は同等であった(67.2% vs 65.8%)。ただし,ペムブロリズマブ併用群で急性腎障害が5.2%にみられることに加え,Grade 3以上の免疫関連の毒性が8.9%と報告され,そのうち肺臓炎により3例の治療関連死が報告されており,それらの毒性管理には注意が必要である。
PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower150試験)が行われ,CBDCA/PTX/ベバシズマブ+アテゾリズマブ併用療法(B群)とCBDCA/PTX/ベバシズマブ療法(C群)の比較結果が報告された7)。主要評価項目はEGFR遺伝子変異/ALK融合遺伝子陰性集団におけるPFSおよびOSであった。C群に対するB群のPFSは,HR 0.62(8.3カ月vs 6.8カ月,95%CI:0.52-0.74,P<0.001),OSはHR 0.78(19.2カ月vs 14.7カ月,95%CI:0.64-0.96,P=0.02)であり,プラチナ製剤+ベバシズマブ併用療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された。また,PD-L1発現が「TC3 or IC3」のサブグループ解析においても,PFSはHR 0.39(12.6カ月vs 6.8カ月,95%CI:0.25-0.60),OSはHR 0.70(25.2カ月vs 15.0カ月,95%CI:0.43-1.13)と,PD-L1高発現症例において良好な結果を示した。主な毒性は,アテゾリズマブ併用群で食欲低下,末梢神経障害,悪心,倦怠感などであり,Grade 3以上の毒性はプラチナ製剤+ベバシズマブ併用療法群と比較し頻度は高い傾向を認めた(58.5% vs 50.0%)。また免疫関連の毒性として,アテゾリズマブ併用群で皮疹,肝機能障害,甲状腺機能障害,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
また同様の患者集団を対象として,CBDCA+nab-PTXにアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower130試験)では,主要評価項目としてEGFR遺伝子変異/ALK融合遺伝子陰性集団におけるPFSおよびOSが比較検証された8)。CBDCA+nab-PTX療法に対するアテゾリズマブの上乗せはPFS HR 0.64(7.0カ月vs 5.5カ月,95%CI:0.54-0.77,P<0.001),OS HR 0.79(18.6カ月vs 13.9カ月,95%CI:0.64-0.98,P=0.033)とPFS,OSを有意に延長することが示された。また,PD-L1発現が「TC3 or IC3」のサブグループ解析においても,PFSはHR 0.51(6.4カ月vs 4.6カ月,95%CI:0.34-0.77),OSはHR 0.84(17.3カ月vs 16.9カ月,95%CI:0.51-1.39)と,PD-L1高発現症例において良好な結果を示した。主な毒性は,アテゾリズマブ併用群で好中球減少や貧血などの骨髄抑制,食欲低下,悪心,倦怠感,下痢などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は高い傾向を認めた(81% vs 71%)。また免疫関連の毒性として,アテゾリズマブ併用群では甲状腺機能障害(15%),肝機能障害(10%)を主に認め,さらに皮疹,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
〔前述の2試験では,腫瘍細胞(tumor cells;TC)に加え,腫瘍浸潤免疫細胞(tumor-infiltrating immune cells;IC)のPD-L1発現をそれぞれ0~3の4段階で測定し評価している。〕
-
b-2.扁平上皮癌
PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-407試験)が行われた9)。559例が1:1でランダム化され,主要評価項目であるPFSの332例のイベントが確認された時点の中間解析が報告された。PFSはHR 0.56(6.4カ月vs 4.8カ月,95%CI:0.45-0.70,P<0.0001)と,CBDCA+PTX療法もしくはCBDCA+nab-PTX療法に対するペムブロリズマブの上乗せはPFSを有意に延長することが示された。もう1つの主要評価項目であるOSは,観察期間中央値が7.8カ月と不十分な観察期間ではあるがHR 0.64(15.9カ月vs 11.3カ月,95%CI:0.49-0.85,P=0.0008)と,OSもまた有意に延長することが示された。PD-L1 TPS 50%以上のサブグループ解析においても,PFSはHR 0.37(8.0カ月vs 4.2カ月,95%CI:0.24-0.58),OSはHR 0.64(未到達vs未到達,95%CI:0.37-1.10)と良好な傾向がみられた。主な毒性は,ペムブロリズマブ併用群で貧血,食欲低下,好中球減少などであり,Grade 3以上の毒性はプラチナ製剤群と比較し頻度は同等であった(69.8% vs 68.2%)。ただし,治療関連死亡はペムブロリズマブ併用群で高い傾向を認めた(3.6% vs 2.1%)。また,同試験においてペムブロリズマブ併用群でQOLの維持もしくは改善が示された10)。
一方,CBDCA+PTX療法もしくはCBDCA+nab-PTX療法にアテゾリズマブを追加した第Ⅲ相試験(IMpower131試験)においては,PFSは有意に延長したがOSでは有意な延長を認めなかった11)(2020年10月時点で保険償還されていない)。
なお75歳以上の症例においては,前述する主な第Ⅲ相試験においてある一定数が登録されているが,高齢者に限った安全性のデータは示されていないため,これらの併用療法の投与には慎重を期すべきである。
以上より,PD-L1 TPS 50%以上のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してプラチナ製剤併用療法+PD-1/PD-L1阻害薬を行うよう勧められる。ただし,ペムブロリズマブ単剤と比較したデータはなく,プラチナ製剤併用療法+PD-1/PD-L1阻害薬がペムブロリズマブ単剤より優れているかどうかは明らかでない。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 85% (23/27) |
15% (4/27) |
0% | 0% | 0% |
-
なお,プラチナ製剤併用療法+PD-1/PD-L1阻害薬の治療レジメンの詳細については,項末を参照のこと。
-
c.EGFR遺伝子変異やALK融合遺伝子のないPD-L1 TPS 1%以上,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブ併用,ニボルマブ単剤とプラチナ製剤併用療法を3群比較する第Ⅲ相試験(CheckMate227Part 1試験)が行われた12)。PD-L1 TPS 50%以上のサブグループにおけるニボルマブ+イピリムマブ併用群とプラチナ製剤併用療法群の比較解析において,OSはHR 0.70(21.2カ月vs 14.0カ月,95%CI:0.55-0.90),PFSはHR 0.62(6.7カ月vs 5.6カ月,95%CI:0.49-0.79)であり,ニボルマブ+イピリムマブ併用はプラチナ製剤併用療法に対しPFS,OSを延長することが示された。また,ORRは44.4% vs 35.4%であり,ニボルマブ+イピリムマブ併用が優れていた。Grade 3以上の毒性の頻度はどちらも同程度であった(32.8% vs 36.0%)。ニボルマブ+イピリムマブ併用群で内分泌障害,肺臓炎,皮疹,胃腸障害などの免疫関連の毒性の増加が報告されており,それらの毒性管理には注意が必要である。また治療関連死については,ニボルマブ+イピリムマブ併用群とプラチナ製剤併用療法群でそれぞれ1.4%,1.1%にみられた。
以上より,PD-L1 TPS 50%以上のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してニボルマブ+イピリムマブ併用を行うよう勧められる。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 26% (7/27) |
70% (10/27) |
4% (1/27) |
0% | 0% |
*2020年10月時点で,ニボルマブ+イピリムマブ併用は本邦で保険償還されていない。承認後の使用に際しては,添付文書の記載をよく確認すること。
CQ65.
PS 2のPD-L1 TPS 50%以上に対する一次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- 細胞傷害性抗癌薬を行うよう推奨もしくは提案する。
〔単剤/推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
〔カルボプラチン併用療法/推奨の強さ:2,エビデンスの強さ:B,合意率:100%〕
-
- b.
- ペムブロリズマブ単剤を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:85%〕
-
- c.
- プラチナ製剤併用療法+PD-1/PD-L1阻害薬を行うよう推奨するだけの根拠が明確ではない。
〔推奨度決定不能〕
-
a.CQ68参照
-
b.KEYNOTE-024試験では,適格基準としてPS 0-1を満たす患者のみが登録されており1),PS 2のⅣ期非小細胞肺癌の一次治療でペムブロリズマブ単剤療法を投与した際の臨床成績,安全性は不明である。そのため,ペムブロリズマブ単剤療法を一次治療において推奨するだけの根拠が明確ではない。一方でPS 2に対する細胞傷害性抗癌薬のエビデンスも十分とはいえず,有効性は限定的で毒性も懸念される。ガイドライン検討委員会薬物療法及び集学的治療小委員会では,PD-1/PD-L1阻害薬は細胞傷害性抗癌薬と比較して重篤な毒性の頻度が低いことから,益と害のバランスを考慮し治療選択肢として加えてよいという意見が多くみられた。
以上より,PS 2のPD-L1 TPS 50%以上のⅣ期非小細胞肺癌に対し投与の是非を慎重に検討したうえで,一次治療においてペムブロリズマブ単剤療法の投与を行うことをエキスパートオピニオンとして提案する。エビデンスの強さはD,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 85% (22/26) |
15% (4/26) |
0% | 0% |
-
c.プラチナ製剤併用療法に対しPD-1/PD-L1阻害薬の上乗せを評価した4つの第Ⅲ相試験6)~9)では,適格基準としてPS 0-1を満たす患者のみが登録されており,PS 2のⅣ期非小細胞肺癌の一次治療でプラチナ製剤併用療法+PD-1/PD-L1阻害薬を投与した際の臨床成績および安全性は不明である。また,PS 2症例は細胞傷害性抗癌薬の毒性も懸念される患者群であり,さらにPD-1/PD-L1阻害薬を上乗せすることについては安全性における懸念を払拭できない。
以上より,PS 2のPD-L1 TPS 50%以上のⅣ期非小細胞肺癌に対し一次治療においてプラチナ製剤併用療法+PD-1/PD-L1阻害薬を推奨するだけの根拠が明確ではなく,推奨度決定不能とした。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 69% (18/26) |
27% (7/26) |
4% (1/26) |
- 1)
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med. 2016; 375(19): 1823-33.
- 2)
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced non-small-cell lung cancer with PD-L1 tumor proportion score of 50% or greater. J Clin Oncol. 2019; 37(7): 537-46.
- 3)
- Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC(KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017; 18(12): 1600-9.
- 4)
- Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet. 2019; 393(10183): 1819-30.
- 5)
- Nosaki K, Saka H, Hosomi Y, et al. Safety and efficacy of pembrolizumab monotherapy in elderly patients with PD-L1-positive advanced non-small-cell lung cancer: Pooled analysis from the KEYNOTE-010, KEYNOTE-024, and KEYNOTE-042 studies. Lung Cancer. 2019; 135: 188-95.
- 6)
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med. 2018; 378(22): 2078-92.
- 7)
- Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med. 2018; 378(24): 2288-301.
- 8)
- West H, McCleod M, Hussein M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20(7): 924-37.
- 9)
- Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018; 379(21): 2040-51.
- 10)
- Mazieres J, Kowalski D, Luft A, et al. Health-related quality of life with carboplatin-paclitaxel or nab-paclitaxel with or without pembrolizumab in patients with metastatic squamous non-small-cell lung cancer. J Clin Oncol. 2020; 38(3): 271-80. Epub 2019 Nov 21.
- 11)
- Jotte R, Cappuzzo F, Vynnychenko I, et al. Atezolizumab in combination with carboplatin and nab-paclitaxel in advanced squamous NSCLC(IMpower131): results from a randomized phase Ⅲ trial. J Thorac Oncol. 2020; 15(8): 1351-60. Epub 2020 Apr 14.
- 12)
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med. 2019; 381(21): 2020-31.
- 7-3
- ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明
樹形図
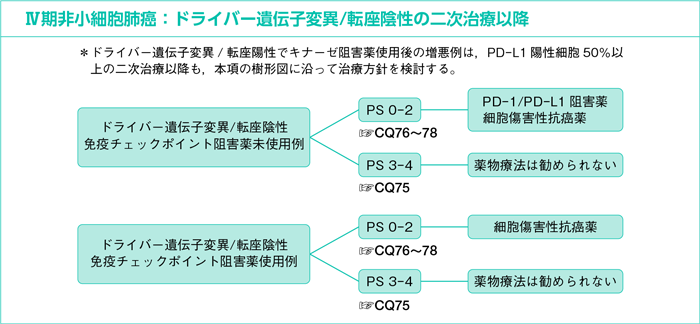
7-3-1.ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明の一次治療
CQ66.
ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明のPS 0-1,75歳未満に対する一次治療において細胞傷害性抗癌薬は勧められるか?
- 推 奨
- プラチナ製剤と第三世代以降の細胞傷害性抗癌薬併用を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:93%〕
*PEMは非扁平上皮癌への投与が推奨される。
*ネダプラチン(NDP/CDGP)は扁平上皮癌への投与が推奨される。
メタアナリシスによってプラチナ製剤(CDDPもしくはCBDCA)を含む治療が緩和治療に対して有意にOSの延長に寄与していることが示されている1)。また,プラチナ製剤併用の薬剤を第二世代と第三世代細胞傷害性抗癌薬で比較したメタアナリシスにおいて,後者がORRで12%,1年生存率で6%優ると報告されている2)。本邦では,4種類の第三世代細胞傷害性抗癌薬とプラチナ製剤併用の第Ⅲ相試験(FACS試験)の結果が報告されており,いずれの効果も同等であった3)。
新規薬剤においても,複数の第Ⅲ相試験によって有効性が示されているが,いくつかの薬剤は特定の組織型に対してのみ有効性が示されている。PEMはそのような薬剤の1つであり,非扁平上皮癌に対して用いられる。CDDP+PEMとCDDP+GEMの第Ⅲ相試験(JMDB試験)が行われ,全体では同等の効果であったが組織型による差が認められ,非扁平上皮癌においてはCDDP+PEM群でOSの有意な延長(11.8カ月vs 10.4カ月,HR 0.81,95%CI:0.70-0.94,P=0.005)を認めた一方で,扁平上皮癌においてはCDDP+PEM群でPFS(4.4カ月vs 5.5カ月,HR 1.36,95%CI:1.12-1.65,P=0.002),OS(9.4カ月vs 10.8カ月,HR 1.23,95%CI:1.00-1.51,P=0.05)ともに劣っていた4)。サブグループ解析ではあるが,有効性ならびに毒性の観点から非扁平上皮癌に対するCDDP+PEMは至適レジメンの1つである。また,CBDCA+PEMはOSを主要評価項目とした比較試験がないものの,患者が自覚する毒性がCDDPよりも軽度であることから実地臨床では頻用されている。CBDCA+PEMとCBDCA+GEM,CBDCA+DTXやCBDCA+PTX+ベバシズマブとの比較試験では,OSや主要評価項目であった有害事象などで優越性を示せていない5)~7)。しかしながら,CBDCA+PTX+ベバシズマブと比較しても生存曲線に大きな差はなく7),ベバシズマブを併用した試験ではCBDCA+PTX+ベバシズマブよりPFSが上回る傾向にある8)。以上より,CBDCA+PEMを行うことは許容される。
扁平上皮癌に対しては,ネダプラチン(NDP/CDGP)+DTXとCDDP+DTXの比較第Ⅲ相試験(WJOG5208L試験)が本邦で実施され,OSの有意な延長が認められた(13.6カ月vs 11.4カ月,HR 0.81,95%CI:0.65-1.02,P=0.037)。毒性はプロファイルが異なり,NDP/CDGP群では白血球減少,好中球減少,血小板減少が多く,CDDP群では悪心,倦怠感,低ナトリウム血症,低カリウム血症が多かった。本邦において第三世代以降の細胞傷害性抗癌薬併用で唯一の優越性が示された有望なレジメンである9)。
その他,S-1の有効性を評価した2編の第Ⅲ相試験(LETS試験,CATS試験)では,CBDCA+S-1はCBDCA+PTXに対して,CDDP+S-1はCDDP+DTXに対して非劣性が示された10)11)。ヒト血清アルブミンとPTXを結合させたナノ粒子製剤であるnab-PTXとCBDCAの併用療法はCBDCA+PTXとの第Ⅲ相試験において,有意にORRの上昇を認めた(33.0% vs 25.0%)12)。これらのレジメンは組織型にかかわらず使用可能である。
以上より,75歳未満,PS 0-1症例に対して,プラチナ製剤と第三世代以降の細胞傷害性抗癌薬併用を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。各レジメンに固有の毒性プロファイルが報告されており,これらも踏まえて選択するべきと考えられる。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 93% (25/27) |
7% (2/27) |
0% | 0% | 0% |
CQ67.
ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明のPS 0-1,75歳以上に対する一次治療において細胞傷害性抗癌薬は勧められるか?
- 推 奨
-
〈非扁平上皮癌〉
- a.
- カルボプラチン併用療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:85%〕
-
- b.
- 第三世代細胞傷害性抗癌薬単剤を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:85%〕
-
〈扁平上皮癌〉
- c.
- 第三世代細胞傷害性抗癌薬単剤を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:63%〕
-
- d.
- カルボプラチン併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:78%〕
*PEMは非扁平上皮癌への投与が推奨される。
一次薬物療法の第Ⅲ相試験と術後補助療法を対象とした検討では,65歳以上と以下で治療効果の差は認めず,暦年齢よりも日常生活自立度が予後に関係していた13)。また,80歳以上でもPS 0-1と良好なものは80歳以下と比べて,OSにおいて80歳以上で7カ月,80歳未満で11カ月(P=0.20)とOSに有意な差がなく,毒性についても明らかな差を認めなかったと報告されている14)。以上より,暦年齢のみで薬物療法の対象外とするべきではない。
非扁平上皮癌
-
a.高齢者を対象とした第三世代細胞傷害性抗癌薬単剤とプラチナ製剤併用を比較した第Ⅲ相試験が2編報告され,両試験とも登録された患者の多くが75歳以上であった。本邦では第Ⅲ相試験(JCOG0803/WJOG4307L試験)が行われ,weekly CDDP+DTXとDTX単剤が比較された。この試験では,中間解析において併用療法が単剤療法の成績を上回らないことが示され(OS 13.3カ月vs 14.8カ月,HR 1.18,95%CI:0.83-1.69),試験中止となった15)。この試験のサブグループ解析では,腺癌でもOSの延長(HR 1.24,95%CI:0.78-1.97)は示されなかった。その後さらに本邦において,75歳以上,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象とした第Ⅲ相試験(JCOG1210/WJOG7813L試験)が行われ16),CBDCA+PEM(PEMの維持療法あり)とDTXの比較結果が報告された。主要評価項目はCBDCA+PEM群のDTX群に対するOS(非劣性)であり,OSのHRは0.850(18.7カ月vs 15.5カ月,95%CI:0.684-1.056)であったことから非劣性が証明された。しかしながら,CBDCA+PEM群のDTX群に対する優越性は示されなかった。またPFSにおいては,HR 0.739(95%CI:0.609-0.896,P<0.01)とCBDCA+PEM群で有意に延長させることが示された。Grade 3以上の毒性は,CBDCA+PEM群で血小板減少と貧血が多く,DTX群で好中球減少と発熱性好中球減少が多かった。治療関連死は各群2例ずつで頻度は1%以下であった。さらに海外で行われた第Ⅲ相試験(IFCT0501試験)では,CBDCA+weekly PTXとGEM単剤もしくはVNR単剤の比較が行われ,併用群でPFSの有意な延長(6.0カ月vs 2.8カ月,HR 0.51,95%CI:0.42-0.62,P<0.0001),OSの有意な延長(10.3カ月vs 6.2カ月,HR 0.64,95%CI:0.52-0.78,P<0.0001)が示された17)。この試験のサブグループ解析では,腺癌においてもOSの有意な延長(HR 0.73,95%CI:0.55-0.99)が示されている。しかし,この試験においては併用群における治療関連死が4.4%と高いなどの問題点が指摘されている。
以上より,PS 0-1,75歳以上の非扁平上皮癌症例に対しては,CBDCA併用療法を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 85% (23/27) |
15% (4/27) |
0% | 0% | 0% |
-
b.高齢者においては,緩和治療に対してVNR単剤が有意にOSを延長し薬物療法が有効であること,VNR単剤と比較してGEM単剤が同様の有効性を示していることが確認されている18)19)。その後,本邦で行われた第Ⅲ相試験(WJTOG9904試験)において,DTX単剤はVNR単剤に対して,PFSで5.5カ月vs 3.1カ月(HR 0.61,95%CI:0.45-0.82,P<0.001)と有意な延長を認め,OSで有意差は認めなかったものの14.3カ月vs 9.9カ月(HR 0.78,95%CI:0.56-1.09,P=0.138)と良好な成績を示した20)。
以上より,PS 0-1,75歳以上の非扁平上皮癌症例に対して,DTXをはじめとした第三世代細胞傷害性抗癌薬単剤を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 15% (4/27) |
85% (23/27) |
0% | 0% | 0% |
-
扁平上皮癌
c.前述のbを参照。
以上より,PS 0-1,75歳以上の扁平上皮癌症例に対して,DTXをはじめとした第三世代細胞傷害性抗癌薬単剤を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 63% (17/27) |
37% (10/27) |
0% | 0% | 0% |
-
d.高齢者を対象とした第三世代細胞傷害性抗癌薬単剤とプラチナ製剤併用を比較した第Ⅲ相試験が2編報告され,両試験とも登録された患者の多くが75歳以上であった。本邦では第Ⅲ相試験(JCOG0803/WJOG4307L試験)が行われ,weekly CDDP+DTXとDTX単剤が比較された。この試験では,中間解析において併用療法が単剤療法の成績を上回らないことが示され(OS 13.3カ月vs 14.8カ月,HR 1.18,95%CI:0.83-1.69),試験中止となった15)。この試験のサブグループ解析では,扁平上皮癌でもOSの延長(HR 0.92,95%CI:0.49-1.72)は示されなかった。また,第Ⅲ相試験(IFCT0501試験)では,CBDCA+weekly PTXとGEM単剤もしくはVNR単剤の比較が行われ,併用療法でPFSの有意な延長(6.0カ月vs 2.8カ月,HR 0.51,95%CI:0.42-0.62,P<0.0001),OSの有意な延長(10.3カ月vs 6.2カ月,HR 0.64,95%CI:0.52-0.78,P<0.0001)が示された17)。この試験のサブグループ解析では,扁平上皮癌(非腺癌の組織型含む)においてもOSの有意な延長(HR 0.52,95%CI:0.39-0.69)が示されている。しかしながらこの成績は,高齢者に対して本邦で行われた単剤療法の成績を大きく上回っているとはいえず,併用群における治療関連死が4.4%と高いなどの問題点として指摘されている。また,投与量も本邦における標準的なものとは異なっており,データの解釈には注意を要する。
以上より,PS 0-1,75歳以上の扁平上皮癌症例に対して,CBDCA併用療法は選択肢の1つと考えられる。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 22% (6/27) |
78% (21/27) |
0% | 0% | 0% |
CQ68.
ドライバー遺伝子変異/転座陰性,PD-L1 TPS 50%未満,もしくは不明のPS 2に対する一次治療において細胞傷害性抗癌薬は勧められるか?
- 推 奨
-
- a.
- 第三世代細胞傷害性抗癌薬単剤を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- プラチナ製剤併用療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:100%〕
*PEMは非扁平上皮癌への投与が推奨される。
PS 2は多様な集団であり,標準治療は定まっていない。しかし,薬物療法と緩和治療を比較したメタアナリシスのサブグループにおいて,PSにかかわらず薬物療法によるOSの延長が認められている〔PS 2以上の場合,薬物療法によって1年生存率にして6%(8%から14%)の改善〕1)。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (27/27) |
0% | 0% | 0% | 0% |
-
b.PTX単剤とCBDCA+PTXとを比較した第Ⅲ相試験(CALGB9730試験)においてPS 2のサブグループが報告されており,CBDCA+PTXはPTX単剤に対して1年生存率で優位に上回っていた(18% vs 10%,HR 0.60,95%CI:0.40-0.91)22)。PS 2に対するCBDCA+PTXとCDDP+GEMとを比較した試験(ECOG1599試験)では,OSは各6.2カ月,6.9カ月と報告され,毒性に関しても忍容可能と考えられた23)。また,CBDCA+GEMとGEM単剤の比較試験が行われ,有意差が認められなかったものの,併用群でOSが6.7カ月vs 4.8カ月(P=0.49),PFSが4.1カ月vs 3.0カ月(P=0.36)の延長傾向が示された24)。さらに,PS 2症例を対象としたCBDCA+PEMとPEM単剤の第Ⅲ相試験が報告されている。この試験では第Ⅲ相試験としては登録数が205例と小規模で,扁平上皮癌を含む患者を対象としているなど問題があるが,併用群でPFSの有意な延長(5.8カ月vs 2.8カ月,HR 0.46,95%CI:0.35-0.63,P<0.001),OSの有意な延長(9.3カ月vs 5.3カ月,HR 0.62,95%CI:0.46-0.83,P=0.001)が示されている。毒性に関しては,併用群で貧血や好中球減少が高く,3.9%の治療関連死が認められた25)。
以上より,毒性が忍容可能と思われるPS 2症例に対してはプラチナ製剤併用療法を考慮してもよいと考えられる。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。ただし,PS 2症例に関するエビデンスは限られており,そのほとんどはCBDCA併用レジメン,もしくは通常より減量した用量が用いられていることに注意が必要である。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (27/27) |
0% | 0% | 0% |
CQ69.
プラチナ製剤併用療法を受ける場合にPD-1/PD-L1阻害薬の上乗せは勧められるか?
- 推 奨
-
- a.
- PS 0-1症例に対して,プラチナ製剤併用療法にPD-1/PD-L1阻害薬を併用するよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:78%〕
-
- b.
- PS 2症例に対して,プラチナ製剤併用療法+PD-1/PD-L1阻害薬を行うよう推奨するだけの根拠が明確ではない。
〔推奨度決定不能〕
-
a-1.非扁平上皮癌
EGFR遺伝子変異やALK融合遺伝子のない,PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-189試験)が行われた26)。中間解析において,主要評価項目であるPFSおよびOSは,それぞれHR 0.52(8.8カ月vs 4.9カ月,95%CI:0.43-0.64,P<0.0001),HR 0.49(未到達vs 11.3カ月,95%CI:0.38-0.64,P<0.0001)であり,CDDP+PEMもしくはCBDCA+PEMに対するペムブロリズマブの上乗せはPFS,OSを有意に延長することが示された。また,PD-L1 TPS別のサブグループ解析においても,PD-L1 TPS 1~49%のPFSはHR 0.55(95%CI:0.37-0.81),OSはHR 0.55(95%CI:0.34-0.90),PD-L1 TPS 1%未満のPFSはHR 0.75(95%CI:0.53-1.05),OSはHR 0.59(95%CI:0.38-0.92)と,いずれの集団においてもOSは有意に延長した。主な毒性は,ペムブロリズマブ併用群で悪心,貧血,倦怠感,便秘などであり,Grade 3以上の毒性はプラチナ製剤群と比較し頻度は同等であった(67.2% vs 65.8%)。ただし,ペムブロリズマブ併用群で急性腎障害が5.2%にみられることに加え,Grade 3以上の免疫関連毒性が8.9%と報告され,そのうち肺臓炎により3例の治療関連死が報告されており,それらの毒性管理には注意が必要である。
PS 0-1のⅣ期非小細胞肺癌(非扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower150試験)が行われ,CBDCA/PTX/ベバシズマブ+アテゾリズマブ併用療法(B群)とCBDCA/PTX/ベバシズマブ療法(C群)の比較結果が報告された27)。主要評価項目はドライバー遺伝子変異/転座陰性集団におけるPFSおよびOSであった。C群に対するB群のPFSは,HR 0.62(8.3カ月vs 6.8カ月,95%CI:0.52-0.74,P<0.001),OSはHR 0.78(19.2カ月vs 14.7カ月,95%CI:0.64-0.96,P=0.02)であり,プラチナ製剤+ベバシズマブ併用療法に対するアテゾリズマブの上乗せはPFS,OSを有意に延長することが示された。また,PD-L1発現別のサブグループ解析において,「TC1/2 or IC1/2」のPFSはHR 0.56(95%CI:0.41-0.77),OSはHR 0.80(95%CI:0.55-1.15),「TC0 and IC0」のPFSはHR 0.77(95%CI:0.61-0.99),OSはHR 0.82(95%CI:0.62-1.08)と,PD-L1が低発現および発現がみられない症例においても良好な結果を示した。主な毒性は,アテゾリズマブ併用群で食欲低下,末梢神経障害,悪心,倦怠感などであり,Grade 3以上の毒性はプラチナ製剤+ベバシズマブ併用療法群と比較し頻度は高い傾向を認めた(58.5% vs 50.0%)。また免疫関連の毒性として,アテゾリズマブ併用群で皮疹,肝機能障害,甲状腺機能障害,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
また同様の患者集団を対象として,CBDCA+nab-PTXにアテゾリズマブを追加することの有効性を評価した第Ⅲ相試験(IMpower130試験)では,主要評価項目としてドライバー遺伝子変異/転座陰性集団におけるPFSおよびOSが比較検証された28)。CBDCA+nab-PTXに対するアテゾリズマブの上乗せはPFS HR 0.64(7.0カ月vs 5.5カ月,95%CI:0.54-0.77,P<0.001),OS HR 0.79(18.6カ月vs 13.9カ月,95%CI:0.64-0.98,P=0.033)とPFS,OSを有意に延長することが示された。また,PD-L1発現別のサブグループ解析において,「TC1/2 or IC1/2」のPFSはHR 0.61(95%CI:0.43-0.85),OSはHR 0.70(95%CI:0.45-1.08),「TC0 and IC0」のPFSはHR 0.72(95%CI:0.56-0.91),OSはHR 0.81(95%CI:0.61-1.08)と,PD-L1が低発現および発現がみられない症例においても良好な結果を示した。主な毒性は,アテゾリズマブ併用群で好中球減少や貧血などの骨髄抑制,食欲低下,悪心,倦怠感,下痢などであり,Grade 3以上の毒性はプラチナ製剤併用療法群と比較し頻度は高い傾向を認めた(81% vs 71%)。また免疫関連の毒性として,これらの試験のアテゾリズマブ併用群では甲状腺機能障害(15%),肝機能障害(10%)を主に認め,さらに皮疹,肺臓炎,大腸炎などが報告されており,免疫関連の毒性管理には注意が必要である。
前述の2試験では,腫瘍細胞(tumor cells;TC)に加え,腫瘍浸潤免疫細胞(tumor-infiltrating immune cells;IC)のPD-L1発現をそれぞれ0~3の4段階で測定し評価している。
-
a-2.扁平上皮癌
PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法に対しペムブロリズマブを追加することの有効性を評価した第Ⅲ相試験(KEYNOTE-407試験)が行われた29)。559例が1:1でランダム化され,主要評価項目であるPFSの332例のイベントが確認された時点の中間解析が報告された。PFSはHR 0.56(6.4カ月vs 4.8カ月,95%CI:0.45-0.70,P<0.0001)と,CBDCA+PTXもしくはCBDCA+nab-PTXに対するペムブロリズマブの上乗せはPFSを有意に延長することが示された。もう1つの主要評価項目であるOSは,観察期間中央値が7.8カ月と不十分な観察期間ではあるがHR 0.64(15.9カ月vs 11.3カ月,95%CI:0.49-0.85,P=0.0008)と,OSもまた有意に延長することが示された。PD-L1 TPS別のサブグループ解析においても,PD-L1 TPS 1~49%のPFSはHR 0.56(95%CI:0.39-0.80),OSはHR 0.57(95%CI:0.57-0.90),PD-L1 TPS 1%未満のPFSはHR 0.68(95%CI:0.47-0.98),OSはHR 0.61(95%CI:0.38-0.98)と,いずれの集団においても良好な傾向がみられた。主な毒性は,ペムブロリズマブ併用群で貧血,食思不振,好中球減少,悪心などであり,Grade 3以上の毒性はプラチナ製剤群と比較し頻度は同等であった(69.8% vs 68.2%)。ただし,治療関連死亡はペムブロリズマブ併用群で高い傾向を認めた(3.6% vs 2.1%)。また,同試験においてペムブロリズマブ併用群でQOLの維持もしくは改善が示された30)。
一方,CBDCA+PTXもしくはCBDCA+nab-PTXにアテゾリズマブを追加した第Ⅲ相試験(IMpower131試験)においては,PFSは有意に延長したがOSでは有意な延長を認めなかった31)(2020年10月時点で保険償還されていない)。
75歳以上の症例においては,前述の主な第Ⅲ相試験においてある一定数が登録されているが,高齢者に限った安全性のデータは示されていないため,これらの併用療法の投与には慎重を期すべきである。
以上より,PD-L1 TPS 50%未満,もしくは不明のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対してプラチナ製剤併用療法+PD-1/PD-L1阻害薬を行うよう勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 78% (21/27) |
22% (6/27) |
0% | 0% | 0% |
-
なお,プラチナ製剤併用療法+PD-1/PD-L1阻害薬の治療レジメンの詳細については項末を参照のこと。
-
b.プラチナ製剤併用療法に対しPD-1/PD-L1阻害薬の上乗せを評価した4つの第Ⅲ相試験26)~29)では,適格基準としてPS 0-1を満たす患者のみが登録されており,PS 2のⅣ期非小細胞肺癌の一次治療でプラチナ製剤併用療法+PD-1/PD-L1阻害薬を投与した際の臨床成績および安全性は不明である。また,PS 2に対しては細胞傷害性抗癌薬の毒性も懸念されており,さらにPD-1/PD-L1阻害薬を上乗せする治療法は安全性において看過できない可能性がある。
以上より,PS 2のPD-L1 TPS 50%未満,もしくは不明のⅣ期非小細胞肺癌に対し一次治療においてプラチナ製剤併用療法+PD-1/PD-L1阻害薬を推奨するだけの根拠が明確ではなく,推奨度決定不能とした。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 74% (20/27) |
22% (6/27) |
4% (1/27) |
CQ70.
ドライバー遺伝子変異/転座陰性,PD-L1 TPS 1~49%,PS 0-1に対する一次治療において免疫チェックポイント阻害薬は勧められるか?
- 推 奨
-
- a.
- ペムブロリズマブ単剤を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:89%〕
-
- b.
- ニボルマブ+イピリムマブを行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:67%〕
-
a.EGFR遺伝子変異やALK融合遺伝子のない,PD-L1 TPS 1%以上のPS 0-1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤とプラチナ製剤併用療法を比較する第Ⅲ相試験(KEYNOTE-042試験)が行われた32)。探索的評価項目であるPD-L1 TPS 1~49%のサブグループ解析において,OSはHR 0.92(13.4カ月vs 12.1カ月,95%CI:0.77-1.11)であり,その生存曲線はクロスしていた。また,PD-L1 TPS 1~49%のPFSは報告されていない。毒性においては前述するKEYNOTE-024試験の有害事象と同様であり,これらの毒性管理には注意が必要である。
なお75歳以上の症例においては,前述する試験のみのサブグループ解析や前向きなデータともに報告はなく,有効性に関しては明らかになっていない。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対して,プラチナ製剤併用療法やプラチナ製剤併用療法+PD-1/PD-L1阻害薬との検討の中で,益と害のバランスを鑑みてペムブロリズマブ単剤療法を考慮してもよい。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/27) |
89% (24/27) |
4% (1/27) |
4% (1/27) |
0% |
-
b.EGFR遺伝子変異やALK融合遺伝子のないPD-L1 TPS 1%以上,PS 0-1のⅣ期非小細胞肺癌患者を対象として,ニボルマブ+イピリムマブ併用,ニボルマブ単剤とプラチナ製剤併用療法を3群比較する第Ⅲ相試験(CheckMate227Part 1試験)が行われた33)。PD-L1 TPS 1~49%のサブグループ解析において,OSはHR 0.94(15.1カ月vs 15.1カ月,95%CI:0.75-1.18)であった。なお,PD-L1 TPS 1~49%のORRやPFSは報告されていない。Grade 3以上の毒性は,ニボルマブ+イピリムマブ併用群とプラチナ製剤併用療法群において頻度は同程度であった(32.8% vs 36.0%)。一方,ニボルマブ+イピリムマブ併用群で内分泌障害,肺臓炎,皮疹,胃腸障害などの免疫関連の毒性が報告されており,それらの毒性管理には注意が必要である。また治療関連死については,ニボルマブ+イピリムマブ併用群とプラチナ製剤併用療法群でそれぞれ1.4%,1.1%にみられた。
なお75歳以上の症例においては,前述する試験のみのサブグループ解析や前向きなデータともに報告はなく有効性に関しては明らかになっていない。
以上より,PD-L1 TPS 1~49%のⅣ期非小細胞肺癌(ドライバー遺伝子変異/転座陰性),PS 0-1症例に対して,プラチナ製剤併用療法やプラチナ製剤併用療法+PD-1/PD-L1阻害薬との検討の中で,リスク・ベネフィットを鑑みてニボルマブ+イピリムマブ併用を考慮してもよい。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 7% (2/27) |
67% (18/27) |
22% (6/27) |
4% (1/27) |
0% |
*2020年10月時点で,ニボルマブ+イピリムマブは本邦で保険償還されていない。承認後の使用に際しては,添付文書の記載をよく確認すること。
CQ71.
プラチナ製剤併用療法を受ける場合の推奨される投与期間は?
- 推 奨
- プラチナ製剤併用療法のプラチナ製剤投与期間を6サイクル以下とするよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
第三世代細胞傷害性抗癌薬とプラチナ製剤との併用について,3サイクルもしくは4サイクルを6サイクルと比較した試験によると,いずれにおいても1年生存率やOSは同等で毒性は前者が軽いと報告された34)35)。前述の2編の試験を含む,6サイクルとそれ以下のサイクルを比較した試験の個票データを利用したメタアナリシスでは,6サイクル群で有意なPFSの延長を認めたがOSは同等であった36)。
一方,近年行われた第Ⅲ相試験では,一次治療におけるプラチナ製剤の投与サイクル数を4もしくは6サイクルと規定しているものがほとんどであり,CDDP+PEMとCDDP+GEMを比較した第Ⅲ相試験(JMDB試験)では,プラチナ製剤併用療法の投与中央値はどちらも5サイクルであった4)。
以上より,プラチナ製剤併用療法の投与期間は4~6サイクルとするよう勧められる。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。効果および毒性の観点から,6サイクルを超えるプラチナ製剤の投与は推奨されない。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (26/26) |
0% | 0% | 0% | 0% |
CQ72.
プラチナ製剤併用療法を受ける場合にベバシズマブの上乗せは勧められるか?
- 推 奨
-
- a.
- ベバシズマブの適応となる75歳未満,PS 0-1症例に対して,プラチナ製剤併用療法にベバシズマブを併用するよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:73%〕
-
- b.
- 75歳以上の症例に対して,ベバシズマブを併用しないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:96%〕
-
- c.
- PS 2症例に対して,ベバシズマブを併用しないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:92%〕
*ベバシズマブは扁平上皮癌への投与は行わない。
-
a.メタアナリシスでは,プラチナ製剤併用療法にベバシズマブを追加することでORRの上昇,PFSの延長が示されており,OSについても延長が認められたとする報告がある37)38)。一方で,ベバシズマブの併用でGrade 3以上の毒性(蛋白尿,高血圧,出血性イベント,好中球減少,発熱性好中球減少,治療関連死)の有意な増加が報告されている37)~39)。
出血リスクに関しては,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血,コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており,ベバシズマブの投与に際してはその適応を十分に検討する必要がある39)。
CBDCA+PTXにベバシズマブを追加することの有効性を評価した第Ⅲ相試験(ECOG4599試験)では,ベバシズマブ併用群でORRの上昇,PFSの有意な延長(6.2カ月vs 4.5カ月,HR 0.66,95%CI:0.57-0.77,P<0.001)ならびにOSの有意な延長(12.3カ月vs 10.3カ月,HR 0.79,95%CI:0.67-0.92,P=0.003)を認めた40)。一方,CDDP+GEMにベバシズマブを追加した第Ⅲ相試験(AVAiL試験)においては,PFSは有意に延長したがOSでは有意な延長を認めなかった41)。本邦ではCBDCA+PTXにベバシズマブを追加するランダム化第Ⅱ相試験(JO19907試験)が行われ,併用群においてORRの上昇(60.7% vs 31.0%,P=0.0013),PFSの延長(6.9カ月vs 5.9カ月,HR 0.61,95%CI:0.42-0.89,P=0.0090)を認め,新たな毒性を認めなかったが,OSについては有意な延長を認めなかった(22.8カ月vs 23.4カ月,HR 0.99,95%CI:0.65-1.50,P=0.9526)42)。中国において同じレジメンを比較した第Ⅲ相試験(BEYOND試験)では,ベバシズマブを一次治療以後も継続することが可能なデザインであったが,PFSの有意な延長(9.2カ月vs 6.5カ月,HR 0.40,95%CI:0.29-0.54,P<0.001)と,OSの有意な延長(24.3カ月vs 17.7カ月,HR 0.68,95%CI:0.50-0.93,P=0.0154)が認められた43)。
以上より,ベバシズマブの適応となる75歳未満,PS 0-1症例に対してプラチナ製剤併用療法を用いる際にはベバシズマブを追加することが勧められる。エビデンスの強さはA,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 27% (7/26) |
73% (19/26) |
0% | 0% | 0% |
ベバシズマブの投与については,その薬剤の特性からプラチナ製剤併用療法の終了後,病勢進行もしくは毒性中止まで投与を継続する方法が一般的である40)~43)。
-
b.75歳以上
高齢者におけるプラチナ製剤併用療法+ベバシズマブについて,ECOG4599試験におけるサブグループ解析で70歳以上の高齢者では効果の上乗せは認められず,若年に比してGrade 3以上の好中球減少,出血,蛋白尿が多かったとされている44)。その後に報告されたECOG4599試験とPointBreak試験を統合したサブグループ解析では,OSおよびPFSにおいて75歳以上で特にベバシズマブの上乗せ効果に乏しい傾向がみられた45)。米国におけるベバシズマブ併用療法の後方視的研究(ARIES)では,65歳未満と65歳以上,および75歳未満と75歳以上のサブグループ解析でどちらも有効性は同等であったが,毒性の面において高齢者群でGrade 3以上の動脈血栓塞栓症が増える傾向にあり,75歳以上ではさらに高かった(65歳未満1.5%,65歳以上2.9%,75歳以上3.5%)46)。また,欧州を中心に施行されたベバシズマブ併用療法のコホート研究(SAiL試験)では,70歳未満と70歳以上で有効性は同等であったが,高齢者群でGrade 3以上の出血の有害事象が増える傾向がみられた(70歳未満3.5%,70歳以上5.3%)47)。ただし,後者に示す2試験はいずれも非ランダム化試験でありエビデンスは低い。
本邦においては75歳以上の高齢者におけるベバシズマブ併用療法の十分なデータはなく,有効性や安全性は確認されていない。
以上より,高齢者に対するベバシズマブ併用を行うよう勧めるだけの根拠が明確ではなく,現時点では行わないよう勧められる。エビデンスの強さはC,また総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 4% (1/26) |
96% (25/26) |
0% |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 4% (1/26) |
92% (24/26) |
4% (1/26) |
*CBDCA+PTX+ベバシズマブの第Ⅱ相試験においてGrade 3以上の肺出血が9.1%に認められ,扁平上皮癌では4/13例(31%)で重篤な肺出血をきたした48)。その後,出血リスクに関する検討が行われ,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられた39)。以上より,ベバシズマブは扁平上皮癌に対して用いない。
CQ73.
プラチナ製剤併用療法を受ける場合にネシツムマブの上乗せは勧められるか?
- 推 奨
- 扁平上皮癌のPS 0-1症例に対して,シスプラチン+ゲムシタビンにネシツムマブを併用するよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:96%〕
PS 0-2のⅣ期非小細胞肺癌(扁平上皮癌)患者を対象として,プラチナ製剤併用療法(CDDP+GEM)に対しネシツムマブを追加することの有効性を評価した第Ⅲ相試験(SQUIRE試験)が行われた49)。主要評価項目であるOSはHR 0.84(11.5カ月vs 9.9カ月,95%CI:0.74-0.96,P=0.01)と,プラチナ製剤併用療法に対するネシツムマブの上乗せはOSを有意に延長することが示された。またPFSにおいても,HR 0.85(5.7カ月vs 5.5カ月,95%CI:0.74-0.98,P=0.006)と,有意に延長することが示された。さらに,PS 0-1のサブグループ解析においても,OSはHR 0.85(95%CI:0.72-1.01),PFSはHR 0.86(95%CI:0.73-1.02)と良好な傾向がみられた。また,PS 0-1のⅣ期非小細胞肺癌(扁平上皮癌)の日本人患者を対象として,プラチナ製剤併用療法(CDDP+GEM)に対しネシツムマブを追加することの有効性を評価したランダム化第Ⅱ相試験(JFCM試験)が行われた50)。主要評価項目であるORRは,ネシツムマブ併用群で有意に高い(51.1% vs 20.9%)ことが示された。さらにOSおよびPFSは,それぞれHR 0.66(14.9カ月vs 10.8カ月,95%CI:0.47-0.93,P=0.0161),HR 0.56(4.2カ月vs 4.0カ月,95%CI:0.41-0.78,P=0.0004)であり,ネシツムマブの上乗せによりOS,PFSを有意に延長させることが示された。
75歳以上の症例においては,前述する2つの試験49)50)においてある一定数が登録されているが,サブグループ解析の成績は示されていない。PS 2症例においては,SQUIRE試験のサブグループ解析でOSはHR 0.78(95%CI:0.51-1.21),PFSはHR 0.79(95%CI:0.50-1.24)と全体集団に劣らない傾向が示されている一方で,PS 2の日本人症例に対する投与経験はなく,有効性および安全性は不明である。
主な毒性は,ネシツムマブ併用群で骨髄抑制,食思不振,倦怠感に加えてネシツムマブに特徴的な皮疹,低マグネシウム血症などであり,Grade 3~4の毒性が併用群で高い傾向であった。本邦で行われた第Ⅱ相試験では,発熱性好中球減少症の頻度がプラチナ製剤群と比較し高かった(12% vs 3%)。また,SQUIRE試験における治療関連死亡は3% vs 2%であった。
以上より,Ⅳ期非小細胞肺癌(扁平上皮癌),PS 0-1症例に対してプラチナ製剤併用療法にネシツムマブを追加することが勧められる。ただし,プラチナ製剤併用療法+PD-1/PD-L1阻害薬と比較したデータはなく,プラチナ製剤併用療法+ネシツムマブがプラチナ製剤併用療法+PD-1/PD-L1阻害薬より優れているかどうかは明らかでない。エビデンスの強さはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 4% (1/28) |
96% (27/28) |
0% | 0% | 0% |
ネシツムマブの投与については,前述した試験によるとプラチナ製剤併用療法の終了後,病勢進行もしくは毒性中止まで投与を継続する方法がとられている。また,プラチナ製剤併用療法+ネシツムマブの治療レジメンは前述した試験で用いられたCDDP+GEMが推奨され,安全性の観点からそれ以外の細胞傷害性抗癌薬とネシツムマブの併用は勧められない。詳細については,項末のレジメンを参照のこと。
CQ74.
プラチナ製剤併用療法を受ける場合に維持療法は勧められるか?
- 推 奨
-
〈非扁平上皮癌〉
- a.
- シスプラチン+ペメトレキセド併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してペメトレキセドによるcontinuation maintenanceを行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
-
〈扁平上皮癌〉
- b.
- プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してswitch maintenance,continuation maintenanceを行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
-
a.CDDP+PEM併用療法後のPEMを用いたcontinuation maintenanceの第Ⅲ相試験(PARAMOUNT試験)で,PFSの有意な延長(4.1カ月vs 2.8カ月,HR 0.62,95%CI:0.50-0.73,P<0.0001),OSの有意な延長(13.9カ月vs 11.0カ月,HR 0.78,95%CI:0.64-0.96,P=0.0195)が示された51)。QOLの低下は認めず,維持療法群において毒性の増強はみられたものの許容範囲内であった。ベバシズマブの併用に関しては,CDDP+PEM+ベバシズマブ併用療法後にPEM+ベバシズマブ群とベバシズマブ単独群の第Ⅲ相試験(AVAPERL試験)が行われ,前者でPFSの有意な延長(7.4カ月vs 3.7カ月,HR 0.48,95%CI:0.44-0.75,P<0.0001)を認めたが,OSの有意な延長は認めなかった52)。
以上より,CDDP+PEM併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対するPEMのcontinuation maintenanceは行うよう勧められる。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (26/26) |
0% | 0% | 0% | 0% |
-
b.プラチナ製剤併用療法後のPEM,エルロチニブを用いたswitch maintenanceの第Ⅲ相試験でPFS,OSの延長が示されたが,扁平上皮癌のサブグループにおいてはOSにおける有意差が消失していた53)54)。さらに,早期からエルロチニブ維持療法を行う群とPD後にエルロチニブ療法を行う群を比較した第Ⅲ相試験(IUNO試験)が行われたが,前述の試験と同様に扁平上皮癌のサブグループにおいてもOSの延長は示されなかった(9.7カ月vs 9.5カ月,HR 1.00,95%CI:0.74-1.35)55)。
以上より,扁平上皮癌に対するswitch maintenanceは推奨するだけの根拠に乏しい。また,continuation maintenanceについても扁平上皮癌に対する有効性は示されていない。維持療法において毒性が増強する点も考慮すると,プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な扁平上皮癌に対してswitch maintenance,continuation maintenanceともに行わないよう勧められる。エビデンスの強さはC,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 0% | 0% | 100% (25/25) |
CQ75.
PS 3-4の患者(ドライバー遺伝子変異/転座陰性もしくは不明,PD-L1 TPSは問わない)に薬物療法は勧められるか?
- 推 奨
- 薬物療法を行わないよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:D,合意率:100%〕
PS 3-4症例(ドライバー遺伝子変異/転座陰性もしくは不明,PD-L1 TPSは問わない)に対する細胞傷害性抗癌薬は,一般に適応がない。PD-1/PD-L1阻害薬はPS良好例(PS 0-1)を中心に臨床試験が行われているため,PS不良例のエビデンスは乏しく,安全性も不明であることから細胞傷害性抗癌薬と同様にPS 3-4についてのPD-1/PD-L1阻害薬も推奨されない。エルロチニブについて,PS不良や合併症のため細胞傷害性抗癌薬の適応とならない進行非小細胞肺癌に対してエルロチニブ単剤と緩和治療の第Ⅲ相試験(TOPICAL試験)が行われた56)。患者背景として,年齢中央値77歳,PS 3が30%を占め,EGFR遺伝子変異については陰性,不明がそれぞれ52%,46%であった。組織型では,扁平上皮癌と非扁平上皮癌が各40%,60%含まれていた。この試験において,主要評価項目であるOSの延長は認められなかった(エルロチニブ単剤3.7カ月vsプラセボ群3.6カ月,HR 0.94,95%CI:0.81-1.10,P=0.46)。
以上より,PS 3-4の患者(ドライバー遺伝子変異/転座陰性もしくは不明,PD-L1発現は問わない)に対する薬物療法は行わないよう推奨される。エビデンスの強さはD,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 0% | 0% | 100% (25/25) |
- 1)
- Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010 May 12; (5): CD007309.
- 2)
- Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer: a meta-analysis. J Thorac Oncol. 2007; 2(9): 845-53.
- 3)
- Ohe Y, Ohashi Y, Kubota K, et al. Randomized phase Ⅲ study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan. Ann Oncol. 2007; 18(2): 317-23.
- 4)
- Scagliotti GV, Parikh P, von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008; 26(21): 3543-51.
- 5)
- Grönberg BH, Bremnes RM, Flötten O, et al. Phase Ⅲ study by the Norwegian lung cancer study group: pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol. 2009; 27(19): 3217-24.
- 6)
- Rodrigues-Pereira J, Kim JH, Magallanes M, et al. A randomized phase 3 trial comparing pemetrexed/carboplatin and docetaxel/carboplatin as first-line treatment for advanced, nonsquamous non-small cell lung cancer. J Thorac Oncol. 2011; 6(11): 1907-14.
- 7)
- Zinner RG, Obasaju CK, Spigel DR, et al. PRONOUNCE: randomized, open-label, phase Ⅲ study of first-line pemetrexed+carboplatin followed by maintenance pemetrexed versus paclitaxel+carboplatin+bevacizumab followed by maintenance bevacizumab in patients ith advanced nonsquamous non-small-cell lung cancer. J Thorac Oncol. 2015; 10(1): 134-42.
- 8)
- Patel JD, Socinski MA, Garon EB, et al. PointBreak: a randomized phase Ⅲ study of pemetrexed plus carboplatin and bevacizumab followed by maintenance pemetrexed and bevacizumab versus paclitaxel plus carboplatin and bevacizumab followed by maintenance bevacizumab in patients with stage ⅢB or Ⅳ nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(34): 4349-57.
- 9)
- Shukuya T, Yamanaka T, Seto T, et al. Nedaplatin plus docetaxel versus cisplatin plus docetaxel for advanced or relapsed squamous cell carcinoma of the lung(WJOG5208L): a randomised, open-label, phase 3 trial. Lancet Oncol. 2015; 16(16): 1630-8.
- 10)
- Okamoto I, Yoshioka H, Morita S, et al. Phase Ⅲ trial comparing oral S-1 plus carboplatin with paclitaxel plus carboplatin in chemotherapy-naive patients with advanced non-small-cell lung cancer: results of a west Japan oncology group study. J Clin Oncol. 2010; 28(36): 5240-6.
- 11)
- Kubota K, Sakai H, Katakami N, et al. A randomized phase Ⅲ trial of oral S-1 plus cisplatin versus docetaxel plus cisplatin in Japanese patients with advanced non-small-cell lung cancer: TCOG0701 CATS trial. Ann Oncol. 2015; 26(7): 1401-8.
- 12)
- Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase Ⅲ trial. J Clin Oncol. 2012; 30(17): 2055-62.
- 13)
- Maione P, Perrone F, Gallo C, et al. Pretreatment quality of life and functional status assessment significantly predict survival of elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the multicenter Italian lung cancer in the elderly study. J Clin Oncol. 2005; 23(28): 6865-72.
- 14)
- Hesketh PJ, Lilenbaum RC, Chansky K, et al. Chemotherapy in patients>or=80 with advanced non-small cell lung cancer: combined results from SWOG 0027 and LUN 6. J Thorac Oncol. 2007; 2(6): 494-8.
- 15)
- Abe T, Takeda K, Ohe Y, et al. Randomized phase Ⅲ trial comparing weekly docetaxel plus cisplatin versus docetaxel monotherapy every 3 weeks in elderly patients with advanced non-small-cell lung cancer: the intergroup trial JCOG0803/WJOG4307L. J Clin Oncol. 2015; 33(6): 575-81.
- 16)
- Okamoto I, Nokihara H, Nomura S, et al. Comparison of carboplatin plus pemetrexed followed by maintenance pemetrexed with docetaxel monotherapy in elderly patients with advanced nonsquamous non-small cell lung cancer: a phase 3 randomized clinical trial. JAMA Oncol. 2020; 6(5): e196828. Epub 2020 May 14.
- 17)
- Quoix E, Zalcman G, Oster JP, et al. Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet. 2011; 378(9796): 1079-88.
- 18)
- The Elderly Lung Cancer Vinorelbine Italian Study Group. Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. J Natl Cancer Inst. 1999; 91(1): 66-72.
- 19)
- Gridelli C, Perrone F, Gallo C, et al. Chemotherapy for elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study(MILES)phase Ⅲ randomized trial. J Natl Cancer Inst. 2003; 95(5): 362-72.
- 20)
- Kudoh S, Takeda K, Nakagawa K, et al. Phase Ⅲ study of docetaxel compared with vinorelbine in elderly patients with advanced non-small-cell lung cancer: results of the West Japan Thoracic Oncology Group Trial(WJTOG 9904). J Clin Oncol. 2006; 24(22): 3657-63.
- 21)
- Gridelli C, Ardizzoni A, Le Chevalier T, et al. Treatment of advanced non-small-cell lung cancer patients with ECOG performance status 2: results of an European Experts Panel. Ann Oncol. 2004; 15(3): 419-26.
- 22)
- Lilenbaum RC, Herndon JE 2nd, List MA, et al. Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B(study 9730). J Clin Oncol. 2005; 23(1): 190-6.
- 23)
- Langer C, Li S, Schiller J, et al. Randomized phase Ⅱ trial of paclitaxel plus carboplatin or gemcitabine plus cisplatin in Eastern Cooperative Oncology Group performance status 2 non-small-cell lung cancer patients: ECOG 1599. J Clin Oncol. 2007; 25(4): 418-23.
- 24)
- Kosmidis PA, Dimopoulos MA, Syrigos K, et al. Gemcitabine versus gemcitabine-carboplatin for patients with advanced non-small cell lung cancer and a performance status of 2: a prospective randomized phase Ⅱ study of the Hellenic Cooperative Oncology Group. J Thorac Oncol. 2007; 2(2): 135-40.
- 25)
- Zukin M, Barrios CH, Pereira JR, et al. Randomized phase Ⅲ trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol. 2013; 31(23): 2849-53.
- 26)
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018; 378(22): 2078-92.
- 27)
- Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med. 2018; 378(24): 2288-301.
- 28)
- West H, McCleod M, Hussein M, et al. Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer(IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20(7): 924-37.
- 29)
- Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med. 2018; 379(21): 2040-51.
- 30)
- Mazieres J, Kowalski D, Luft A, et al. Health-related quality of life with carboplatin-paclitaxel or nab-paclitaxel with or without pembrolizumab in patients with metastatic squamous non-small-cell lung cancer. J Clin Oncol. 2020; 38(3): 271-80. Epub 2019 Nov 21.
- 31)
- Jotte R, Cappuzzo F, Vynnychenko I, et al. Atezolizumab in combination with carboplatin and nab-paclitaxel in advanced squamous NSCLC(IMpower131): results from a randomized phase Ⅲ trial. J Thorac Oncol. 2020; 15(8): 1351-60. Epub 2020 Apr 14.
- 32)
- Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet. 2019; 393(10183): 1819-30.
- 33)
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med. 2019; 381(21): 2020-31.
- 34)
- von Plessen C, Bergman B, Andresen O, et al. Palliative chemotherapy beyond three courses conveys no survival or consistent quality-of-life benefits in advanced non-small-cell lung cancer. Br J Cancer. 2006; 95(8): 966-73.
- 35)
- Park JO, Kim SW, Ahn JS, et al. Phase Ⅲ trial of two versus four additional cycles in patients who are nonprogressive after two cycles of platinum-based chemotherapy in non small-cell lung cancer. J Clin Oncol. 2007; 25(33): 5233-9.
- 36)
- Rossi A, Chiodini P, Sun JM, et al. Six versus fewer planned cycles of first-line platinum-based chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2014; 15(11): 1254-62.
- 37)
- Lima AB, Macedo LT, Sasse AD. Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer: a systematic review and meta-analysis. PLoS One. 2011; 6(8): e22681.
- 38)
- Soria JC, Mauguen A, Reck M, et al. Systematic review and meta-analysis of randomised, phase Ⅱ/Ⅲ trials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-small-cell lung cancer. Ann Oncol. 2013; 24(1): 20-30.
- 39)
- Sandler AB, Schiller JH, Gray R, et al. Retrospective evaluation of the clinical and radiographic risk factors associated with severe pulmonary hemorrhage in first-line advanced, unresectable non-small-cell lung cancer treated with Carboplatin and Paclitaxel plus bevacizumab. J Clin Oncol. 2009; 27(9): 1405-12.
- 40)
- Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006; 355(24): 2542-50.
- 41)
- Reck M, von Pawel J, Zatloukal P, et al. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase Ⅲ trial(AVAiL). Ann Oncol. 2010; 21(9): 1804-9.
- 42)
- Niho S, Kunitoh H, Nokihara H, et al. Randomized phase Ⅱ study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung cancer. Lung Cancer. 2012; 76(3): 362-7.
- 43)
- Zhou C, Wu YL, Chen G, et al. BEYOND: A randomized, double-blind, placebo-controlled, multicenter, phase Ⅲ study of first-line carboplatin/paclitaxel plus bevacizumab or placebo in Chinese patients with advanced or recurrent nonsquamous non-small-cell lung cancer. J Clin Oncol. 2015; 33(19): 2197-204.
- 44)
- Ramalingam SS, Dahlberg SE, Langer CJ, et al. Outcomes for elderly, advanced-stage non small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel: analysis of Eastern Cooperative Oncology Group Trial 4599. J Clin Oncol. 2008; 26(1): 60-5.
- 45)
- Langer CJ, Socinski MA, Patel JD, et al. Isolating the role of bevacizumab in elderly patients with previously untreated nonsquamous non-small cell lung cancer: secondary analyses of the ECOG 4599 and PointBreak trials. Am J Clin Oncol. 2016; 39(5): 441-7.
- 46)
- Wozniak AJ, Kosty MP, Jahanzeb M, et al. Clinical outcomes in elderly patients with advanced non-small cell lung cancer: results from ARIES, a bevacizumab observational cohort study. Clin Oncol(R Coll Radiol). 2015; 27(4): 187-96.
- 47)
- Laskin J, Crino L, Felip E, et al. Safety and efficacy of first-line bevacizumab plus chemotherapy in elderly patients with advanced or recurrent nonsquamous non-small cell lung cancer: safety of avastin in lung trial(MO19390). J Thorac Oncol. 2012; 7(1): 203-11.
- 48)
- Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase Ⅱ trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol. 2004; 22(11): 2184-91.
- 49)
- Thatcher N, Hirsch FR, Luft AV, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line therapy in patients with stage Ⅳ squamous non-small-cell lung cancer(SQUIRE): an open-label, randomised, controlled phase 3 trial. Lancet Oncol. 2015; 16(7): 763-74.
- 50)
- Watanabe S, Yoshioka H, Sakai H, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line treatment for stage Ⅳ squamous non-small cell lung cancer: A phase 1b and randomized, open-label, multicenter, phase 2 trial in Japan. Lung Cancer. 2019; 129: 55-62.
- 51)
- Paz-Ares LG, de Marinis F, Dediu M, et al. PARAMOUNT: Final overall survival results of the phase Ⅲ study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(23): 2895-902.
- 52)
- Barlesi F, Scherpereel A, Gorbunova V, et al. Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL(MO22089)randomized phase Ⅲ trial. Ann Oncol. 2014; 25(5): 1044-52.
- 53)
- Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet. 2009; 374(9699): 1432-40.
- 54)
- Cappuzzo F, Ciuleanu T, Stelmakh L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol. 2010; 11(6): 521-9.
- 55)
- Cicènas S, Geater SL, Petrov P, et al. Maintenance erlotinib versus erlotinib at disease progression in patients with advanced non-small-cell lung cancer who have not progressed following platinum-based chemotherapy(IUNO study). Lung Cancer. 2016; 102: 30-7.
- 56)
- Lee SM, Khan I, Upadhyay S, et al. First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy(TOPICAL): a double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2012; 13(11): 1161-70.
7-3-2.ドライバー遺伝子変異/転座陰性の二次治療以降
CQ76.
一次治療耐性または進行例,PS 0-2,免疫チェックポイント阻害薬未使用例に対する二次治療において薬物療法は勧められるか?
- 推 奨
-
- a.
- PD-1阻害薬またはPD-L1阻害薬を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
-
- b.
- 細胞傷害性抗癌薬を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:A,合意率:96%〕
*ペムブロリズマブの適応症は,(腫瘍細胞上の)PD-L1陽性の切除不能な進行・再発の非小細胞肺癌に限られる。
*PEMは非扁平上皮癌への投与が推奨される。
-
a.ドライバー遺伝子変異/転座陰性例の二次治療では,複数の第Ⅲ相試験においてDTX単剤療法と比較してPD-1/PD-L1阻害薬が有意にOSを延長することが証明されている。いずれの試験もDTX単剤を対照としており,ニボルマブおよびアテゾリズマブはPD-L1の発現を問わず行われ1)~4),ペムブロリズマブはPD-L1 TPS 1%以上の非小細胞肺癌を対象として行われた5)。
上記の第Ⅲ相試験はいずれもPS 0-1の症例を対象として実施しており,PS 2の一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対するPD-1/PD-L1阻害薬の有用性は効果,安全性ともに現時点で不明である。そのため,PS 2に対してPD-1/PD-L1阻害薬の使用を推奨するだけの根拠は十分ではない。しかしながら,一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対するニボルマブの前向き観察研究(CheckMate153試験)では,PS 2での使用例で全体集団と比較しGrade 3以上の毒性が増加しないことが示されている(12% vs 12%)6)。
以上より,一次治療耐性または進行後,ドライバー遺伝子変異/転座陰性,免疫チェックポイント阻害薬未使用例のⅣ期非小細胞肺癌に対してはPD-1/PD-L1阻害薬を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (23/23) |
0% | 0% | 0% | 0% |
-
〈ニボルマブ〉
ニボルマブはDTXとの比較において,第Ⅲ相試験が3編報告されている。
プラチナ製剤併用療法の治療歴を有する進行扁平上皮癌を対象としたCheckMate017試験では,ニボルマブは主要評価項目であるOSにおいてHR 0.59(9.2カ月vs 6.0カ月,95%CI:0.44-0.79,P<0.001)とDTX単剤と比較し有意な延長を示し,PD-L1発現率に基づくサブグループ解析でも,PD-L1の発現によらずニボルマブの有効性が示されている1)。
プラチナ製剤併用療法の治療歴を有する進行非扁平上皮癌を対象としたCheckMate057試験でも,主要評価項目であるOSにおいてHR 0.73(12.2カ月vs 9.4カ月,95%CI:0.59-0.79,P=0.002)とDTX単剤と比較しニボルマブの有意な延長が示されている2)。特にPD-L1 TPS 1%以上のサブグループにおいてはOSがHR 0.58(95%CI:0.43-0.79),PFSがHR 0.70(95%CI:0.53-0.94)と有意にOSを延長することが示されている。さらに同試験におけるQOLの比較において,ニボルマブ群がDTX群と比較して有意に肺癌症状の悪化を遅らせることが示された7)。
なお,CheckMate017/057試験の統合解析においてニボルマブ群の4年生存率が14%と報告されている8)。
また,海外で行われたプラチナ製剤併用療法の治療歴を有する進行非小細胞肺癌を対象としたCheckMate078試験でも,主要評価項目であるOSにおいてHR 0.68(12.0カ月vs 9.6カ月,95%CI:0.52-0.90,P=0.0006)とDTXと比較しニボルマブの有意な延長が示されている3)。
前述の3試験における主な毒性は,ニボルマブ群で倦怠感や食欲低下,DTX群で好中球減少,倦怠感,脱毛などであり,Grade 3以上の毒性はニボルマブ群で有意に少なかった。一方,ニボルマブ群で肺臓炎,甲状腺機能障害,大腸炎,肝機能障害,皮疹,Ⅰ型糖尿病などの免疫関連の毒性が報告されており,免疫関連の毒性管理には注意が必要である。
ニボルマブの投与にあたっては,厚生労働省による最適使用推進ガイドラインも参照のこと9)。
-
〈ペムブロリズマブ〉
プラチナ併用療法を含む治療歴を有するPD-L1 TPS 1%以上の進行非小細胞肺癌を対象とした第Ⅱ-Ⅲ相試験(KEYNOTE-010試験)では,DTX単剤に対するペムブロリズマブ(2mg/kg群と10mg/kg群の2群統合)のOSはHR 0.67(95%CI:0.56-0.80),PFSはHR 0.85(95%CI:0.73-0.98)であり,生存期間の延長効果が示されている5)。Grade 3以上の毒性はペムブロリズマブ2mg/kg群で13%,10mg/kg群で16%,DTX群で35%とペムブロリズマブ群で頻度が低く,ペムブロリズマブの免疫関連の毒性として甲状腺機能障害,肺臓炎,皮膚障害などが認められた。また,同試験におけるQOL解析においてペムブロリズマブ群がDTX群と比較して有意に患者のQOLと肺癌関連症状を改善させることが示された10)。
なお,PD-L1陽性の切除不能な進行・再発非小細胞肺癌に対する本邦におけるペムブロリズマブの投与量は,添付文書により200mg/bodyの3週毎投与と規定されている。
-
〈アテゾリズマブ〉
アテゾリズマブはプラチナ併用療法の治療歴を有する非小細胞肺癌を対象として,DTX単剤と比較したランダム化第Ⅱ相試験(POPLAR試験)と第Ⅲ相試験(OAK試験)がそれぞれ報告されている4)11)。
POPLAR試験では,主要評価項目であるOSはHR 0.73(12.6カ月vs 9.7カ月,95%CI:0.53-0.99,P=0.040)とアテゾリズマブがDTX単剤と比較し有意にOSを延長した結果が示されている11)。OAK試験においても,主要評価項目であるOSはHRが0.73(13.8カ月vs 9.6カ月,95%CI:0.62-0.87,P=0.0003)とアテゾリズマブがDTX単剤と比較し有意にOSを延長した4)。また,OAK試験におけるQOLの比較において,アテゾリズマブ群がDTX群と比較して有意に肺癌関連症状の悪化を遅らせることが示された12)。
OAK試験における主な毒性は,アテゾリズマブ群で倦怠感や悪心,下痢などであり,Grade 3以上の毒性(治療関連)はアテゾリズマブ群で15%,DTX群で43%とアテゾリズマブ群が少なかった。一方,アテゾリズマブ群の免疫関連の毒性として肺臓炎,肝炎,大腸炎が報告されており,毒性による投与中止例は8%(DTX群は19%)であった。
アテゾリズマブの投与にあたっては,厚生労働省による最適使用推進ガイドラインも参照のこと13)。
-
b.PD-1/PD-L1阻害薬と細胞傷害性抗癌薬(DTX)単剤を比較した前述の5つのランダム化比較試験1)~5)11)において,一部の試験でPFSおよびOSの生存曲線が交差するなど,細胞傷害性抗癌薬のほうが臨床的に有意義であった可能性のある症例が存在する。また,DTX単剤よりも生存延長効果に勝るDTX+ラムシルマブ併用療法とPD-1/PD-L1阻害薬とを比較した臨床試験は存在しない。
以上より,一次治療耐性または進行後,ドライバー遺伝子変異/転座陰性,免疫チェックポイント阻害薬未使用例のⅣ期非小細胞肺癌に対して細胞傷害性抗癌薬を行うよう提案する。エビデンスの強さはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 96% (22/23) |
4% (1/23) |
0% | 0% |
CQ77.
PS 0-2に対して二次治療以降で推奨される細胞傷害性抗癌薬は何か?
- 推 奨
- ドセタキセル±ラムシルマブ,ペメトレキセド単剤,S-1単剤を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
*PEMは非扁平上皮癌への投与に限定。
-
〈ドセタキセル単剤〉
プラチナ製剤を含む薬物療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤の第Ⅲ相試験が2編報告されている。1つはDTX(100mg/m2 or 75mg/m2)vs VNR or IFMの比較試験(TAX320試験)でOSでは有意差を認めないもののDTX 75mg/m2群で対照群と比較してORR,26週PFS率,1年生存率の有意な改善を認めた14)。また,DTX(100mg/m2 or 75mg/m2)と緩和治療の比較ではOS中央値と1年生存率は,DTX 75mg/m2群,緩和治療群でそれぞれ7.5カ月と37%,4.6カ月と19%で,DTX群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた15)。いずれの試験においても,DTX 75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞肺癌の薬物療法としてはDTX 75mg/m2の有用性が確立された。本邦における推奨用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,OS中央値7.8カ月と上記2編の第Ⅲ相試験のDTX 75mg/m2と同等の効果を有する結果を報告した16)。
-
〈ドセタキセル+ラムシルマブ〉
CQ78参照
-
〈ペメトレキセド単剤〉
Ⅳ期非小細胞肺癌の二次治療におけるPEM単剤とDTX単剤の第Ⅲ相試験(JMEI試験)が報告され,ORR,OS中央値はPEM群で9.1%,8.3カ月,DTX単剤群で8.8%,7.9カ月であり,主要評価項目であるOSで非劣性は証明されなかったが同等の効果HR 0.99(95%CI:0.80-1.20,P=0.226)が報告された。毒性に関しては,Grade 3/4の好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がDTX群で有意に高かった17)。同試験を組織学的に後方視的解析した結果,OSは非扁平上皮癌でそれぞれ9.3カ月と8.0カ月(HR 0.78,95%CI:0.61-1.00,P=0.047)と有意差を認めた。また,PFSにおいても非扁平上皮癌でそれぞれ3.1カ月と3.0カ月(HR 0.82,95%CI:0.66-1.02,P=0.076)と有意差を認めなかったが,効果はほぼ同等であった18)。一方,毒性に関しては,Grade 3以上の発熱性好中球減少(1.9% vs 12.7%),好中球減少(5.3% vs 40.2%),好中球減少に伴った感染(0.0% vs 3.3%)の発現頻度は有意に少なく,ALT上昇(1.9% vs 0.0%)の頻度は有意に高いと違いを認めたが,QOLに関しては差を認めなかった。
-
〈S-1単剤〉
プラチナ既治療のⅣ期非小細胞肺癌,PS 0-2の二次もしくは三次治療例を対象とし,S-1単剤とDTX単剤を比較する第Ⅲ相試験(EAST-LC試験)が本邦を含むアジアで行われた。主要評価項目であるOSは非劣性を示すことが目的であり,S-1群で12.75カ月,DTX群で12.52カ月(HR 0.945,95%CI:0.833-1.073)で,DTX単剤に対するS-1単剤の非劣性が示された。またPFSはS-1群2.9カ月,DTX群2.9カ月(HR 1.03,95%CI:0.91-1.17)で両群に差を認めず,ORRはS-1群8.3%,DTX群9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった19)。
以上より,一次治療耐性または進行後のⅣ期非小細胞肺癌症例に対してDTX±ラムシルマブ,S-1単剤,(非扁平上皮癌の場合)PEM単剤の投与を行うよう勧められる。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (23/23) |
0% | 0% | 0% | 0% |
CQ78.
二次治療でドセタキセルを用いる場合にラムシルマブの併用は推奨されるか?
- 推 奨
-
- a.
- ラムシルマブの適応となるPS 0-1症例に対して,ドセタキセルにラムシルマブを併用するよう提案する。
〔推奨の強さ:2,エビデンスの強さ:B,合意率:74%〕
-
- b.
- 75歳以上の症例に対して,ドセタキセルにラムシルマブを併用しないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:78%〕
-
- c.
- PS 2症例に対して,ドセタキセルにラムシルマブを併用しないよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:87%〕
-
a.プラチナ製剤併用療法後に進行したPS 0-1の進行非小細胞肺癌症例を対象とし,DTX+ラムシルマブ併用療法とDTX単剤を比較する第Ⅲ相試験(REVEL試験)が行われ,主要評価項目であるOSは,ラムシルマブ併用群で有意な延長を認めた(10.5カ月vs 9.1カ月,HR 0.86,95%CI:0.75-0.98,P=0.023)。また,ラムシルマブ併用群において,PFS(4.5カ月vs 3.0カ月,HR 0.76,95%CI:0.68-0.86,P<0.0001),ORR(23% vs 14%,P<0.0001)も有意に良好であった。毒性に関しては,ラムシルマブ併用群でGrade 3/4の好中球減少,発熱性好中球減少,全Gradeの血小板減少,口内炎がより高頻度であったが,Grade 3以上の高血圧は6%で出血性イベントの多くはGrade 1/2であった20)。
また本邦において,DTX+ラムシルマブ併用療法とDTX単剤のランダム化比較第Ⅱ相試験(JVCG試験)が行われ,ラムシルマブ併用群においてPFS(5.2カ月vs 4.2カ月,HR 0.83,95%CI:0.59-1.16),OS(15.2カ月vs 13.9カ月,HR 0.77,95%CI:0.56-1.32),ORR(28.9% vs 18.5%)ともに良好な結果が示された。毒性に関しては,ラムシルマブ併用群において発熱性好中球減少の頻度が高く(34% vs 19%),低アルブミン血症,血小板減少,口内炎,鼻出血,蛋白尿などもDTX単剤よりも高頻度であったが,ほとんどはGrade 1/2であった21)。ラムシルマブにおいてもベバシズマブと同様に出血リスクには注意が必要であり,投与に際してはその適応を十分検討する必要がある。
以上より,ラムシルマブは適応と考えられる症例においてDTXに追加するよう勧められる。エビデンスの強さはB,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 26% (6/23) |
74% (17/23) |
0% | 0% | 0% |
-
b.75歳以上
前述の第Ⅲ相試験(REVEL試験)における75歳以上のサブグループは不明である。また,本邦において実施された第Ⅱ相試験(JVCG試験)でも75歳以上の症例は10例と少数であるため75歳以上の高齢者に対するラムシルマブの安全性や有効性に関してのデータは十分ではない。一方,本ガイドラインの一次治療では,エビデンスの質は低いものの骨髄抑制などの毒性増加への懸念から,75歳以上に対してプラチナ製剤併用療法にラムシルマブと同じ血管新生阻害薬であるベバシズマブの併用を勧める根拠が乏しく,行わないよう提案されている(CQ72参照)。ラムシルマブについても若年者を中心とした本邦の第Ⅱ相試験において発熱性好中球減少をはじめとした毒性の増強が懸念されることを考えると,現時点で高齢者にラムシルマブを併用する根拠は明確ではない。エビデンスの強さはD,また総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 9% (2/23) |
9% (2/23) |
78% (18/23) |
4% (1/23) |
-
c.PS 2
前述のREVEL試験,JVCG試験においては対象症例がPS 0-1であり20)21),PS 2に対するラムシルマブの安全性や有効性に関してのデータはない。よって,PS 2に対するラムシルマブは行うよう勧めるだけの根拠が明確ではない。PS 0-1を対象とした試験では,ラムシルマブ併用群で発熱性好中球減少の発現頻度が高く,PS不良例においてはラムシルマブの併用により毒性の悪化が懸念される。
以上より,益と害のバランスを考慮し現時点では行わないよう勧められる。エビデンスの強さはD,ただし総合的評価では行わないよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 9% (2/23) |
87% (20/23) |
4% (1/23) |
- 1)
- Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med. 2015; 373(2): 123-35.
- 2)
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med. 2015; 373(17): 1627-39.
- 3)
- Wu YL, Lu S, Cheng Y, et al. Nivolumab versus docetaxel in a predominantly Chinese patient population with previously treated advanced NSCLC: CheckMate 078 randomized phase Ⅲ clinical trial. J Thorac Oncol. 2019; 14(5): 867-75.
- 4)
- Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet. 2017; 389(10066): 255-65.
- 5)
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer(KEYNOTE-010): a randomised controlled trial. Lancet. 2016; 387(10027): 1540-50.
- 6)
- Spigel DR, McCleod M, Jotte RM, et al. Safety, efficacy, and patient-reported health-related quality of life and symptom burden with nivolumab in patients with advanced non-small cell lung cancer, including patients aged 70 years or older or with poor performance status(CheckMate 153). J Thorac Oncol. 2019; 14(9): 1628-39.
- 7)
- Reck M, Brahmer J, Bennett B, et al. Evaluation of health-related quality of life and symptoms in patients with advanced non-squamous non-small cell lung cancer treated with nivolumab or docetaxel in CheckMate 057. Eur J Cancer. 2018; 102: 23-30.
- 8)
- Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019; 20(10): 1395-408.
- 9)
- 厚生労働省.ニボルマブ(遺伝子組換え)製剤及びペムブロリズマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌及び悪性黒色腫)について.別添1: ニボルマブ(遺伝子組換え)~非小細胞肺癌~,平成29年2月14日,薬生薬審発0214第1号.
- 10)
- Barlesi F, Garon EB, Kim DW, et al. Health-related quality of life in KEYNOTE-010: a phase Ⅱ/Ⅲ study of pembrolizumab versus docetaxel in patients with previously treated advanced, programmed death ligand 1-expressing NSCLC. J Thorac Oncol. 2019; 14(5): 793-801.
- 11)
- Fehrenbacher L, Spira A, Ballinger M, et al; POPLAR Study Group. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016; 387(10030): 1837-46.
- 12)
- Bordoni R, Ciardiello F, von Pawel J, et al. Patient-reported outcomes in OAK: a phase Ⅲ study of atezolizumab versus docetaxel in advanced non-small-cell lung cancer. Clin Lung Cancer. 2018; 19(5): 441-9.
- 13)
- 厚生労働省.アテゾリズマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌)について.別添: アテゾリズマブ(遺伝子組換え)~非小細胞肺癌~,平成30年4月17日,薬生薬審発0417第1号.
- 14)
- Fossella FV, DeVore R, Kerr RN, et al. Randomized phase Ⅲ trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol. 2000; 18(12): 2354-62.
- 15)
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol. 2000; 18(10): 2095-103.
- 16)
- Mukohara T, Takeda K, Miyazaki M, et al. Japanese experience with second-line chemotherapy with low-dose(60mg/M2)docetaxel in patients with advanced non-small-cell lung cancer. Cancer Chemother Pharmacol. 2001; 48(5): 356-60.
- 17)
- Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol. 2004; 22(9): 1589-97.
- 18)
- Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase Ⅲ studies. Oncologist. 2009; 14(3): 253-63.
- 19)
- Nokihara H, Lu S, Mok TSK, et al. Randomized controlled trial of S-1 versus docetaxel in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy(East Asia S-1 Trial in Lung Cancer). Ann Oncol. 2017; 28(11): 2698-706.
- 20)
- Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage Ⅳ non-small-cell lung cancer after disease progression on platinum-based therapy(REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet. 2014; 384(9944): 665-73.
- 21)
- Yoh K, Hosomi Y, Kasahara K, et al. A randomized, double-blind, phase Ⅱ study of ramucirumab plus docetaxel vs placebo plus docetaxel in Japanese patients with stage Ⅳ non-small cell lung cancer after disease progression on platinum-based therapy. Lung Cancer. 2016; 99: 186-93.
- レジメン
- Ⅳ期非小細胞肺癌
ドライバー遺伝子変異/転座陽性
| EGFR遺伝子変異陽性例 | ゲフィチニブ | 250mg/日 | 1日1回 |
|---|---|---|---|
| エルロチニブ | 150mg/日 | 1日1回 | |
| アファチニブ | 40mg/日 | 1日1回 | |
| オシメルチニブ | 80mg/日 | 1日1回 | |
| ダコミチニブ | 45mg/日 | 1日1回 | |
| ALK融合遺伝子陽性例 | クリゾチニブ | 500mg/日 | 1日2回 |
| アレクチニブ | 600mg/日 | 1日2回 | |
| セリチニブ | 450mg/日 | 1日1回 | |
| ロルラチニブ | 100mg/日 | 1日1回 | |
| ブリグチニブ | 90mg/日,day 1-7 180mg/日,day 8~ |
1日1回 | |
| ROS1融合遺伝子陽性例 | クリゾチニブ | 500mg/日 | 1日2回 |
| エヌトレクチニブ | 600mg/日 | 1日1回 | |
| BRAF遺伝子変異陽性例 | ダブラフェニブ | 300mg/日 | 1日2回 |
| トラメチニブ | 2mg/日 | 1日1回 | |
| MET遺伝子変異陽性例 | テポチニブ | 500mg/日 | 1日1回 |
| カプマチニブ | 800mg/日 | 1日2回 | |
| NTRK融合遺伝子陽性例 | エヌトレクチニブ | 600mg/日 | 1日1回 |
| ベバシズマブ併用 | エルロチニブ | 150mg/日 | 1日1回 |
|---|---|---|---|
| ベバシズマブ | 15mg/kg,day 1 | 3週毎 | |
| ラムシルマブ併用 | エルロチニブ | 150mg/日 | 1日1回 |
| ラムシルマブ | 10mg/kg,day 1 | 2週毎 | |
| 細胞傷害性抗癌薬併用 | ゲフィチニブ | 250mg/日 | 1日1回 |
| CBDCA | (AUC=5),day 1 | 3~4週毎 | |
| PEM※ | 500mg/m2,day 1 | ||
| ・4~6コース終了後,増悪を認めなければゲフィチニブ+PEM併用の維持療法を考慮する | |||
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3コース毎)に1回投与する。
ドライバー遺伝子変異/転座陰性
| CDDP | 75mg/m2,day 1 | 3週毎 |
| PEM※ | 500mg/m2,day 1 | |
|
・4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
| CDDP | 80mg/m2,day 1 | 3週毎 |
| DTX | 60mg/m2,day 1 | |
| CDDP | 80mg/m2,day 1 | 3週毎 |
| GEM | 1000mg/m2,day 1,8 | |
| CDDP | 80mg/m2,day 1 | 3週毎 |
| VNR | 25mg/m2,day 1,8 | |
| CDDP | 80mg/m2,day 1 | 4週毎 |
| CPT-11 | 60mg/m2,day 1,8,15 | |
| CDDP | 60mg/m2,day 8 | 4~5週毎 |
| S-1 | 40mg/m2,1日2回,day 1-21 | |
・増悪しなければ上記を6コース以内で繰り返す
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3コース毎)に1回投与する。
| CBDCA | (AUC=6),day 1 | 3週毎 |
| PTX | 200mg/m2,day 1 | |
|
・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
||
| CBDCA | (AUC=5),day 1 | 3週毎 |
| GEM | 1000mg/m2,day 1,8 | |
| CBDCA | (AUC=5),day 1 | 3週毎 |
| S-1 | 40mg/m2,1日2回,day 1-14 | |
| CBDCA | (AUC=6),day 1 | 3週毎 |
| nab-PTX | 100mg/m2,day 1,8,15 | |
| CBDCA | (AUC=5-6),day 1 | 3週毎 |
| PEM※ | 500mg/m2,day 1 | |
|
・4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
・増悪しなければ上記を6コース以内で繰り返す
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3コース毎)に1回投与する。
| NDP/CDGP | 100mg/m2,day 1 | 3週毎 |
| DTX | 60mg/m2,day 1 |
・増悪しなければ上記を6コース以内で繰り返す
| ペムブロリズマブ併用 | (非扁平上皮癌のみ) | 3週毎 | |
|---|---|---|---|
| CDDP | 75mg/m2,day 1 | ||
| もしくはCBDCA | もしくは(AUC=5),day 1 | ||
| PEM※ | 500mg/m2,day 1 | ||
| ペムブロリズマブ | 200mg/body,day 1 | ||
|
・4コース終了後,増悪を認めなければPEM+ペムブロリズマブ併用の維持療法を考慮する |
|||
| (扁平上皮癌のみ) | 3週毎 | ||
| CBDCA | (AUC=6),day 1 | ||
| PTX | 200mg/m2,day 1 | ||
| もしくはnab-PTX | もしくは100mg/m2,day 1,8,15 | ||
| ペムブロリズマブ | 200mg/body,day 1 | ||
|
・4コース終了後,増悪を認めなければペムブロリズマブ単剤の維持療法を考慮する ・PTXを含むレジメンの場合,PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
| アテゾリズマブ併用 (非扁平上皮癌のみ) |
CBDCA | (AUC=6),day 1 | 3週毎 |
| PTX | 200mg/m2,day 1 | ||
| ベバシズマブ | 15mg/kg,day 1 | ||
| アテゾリズマブ | 1200mg/body,day 1 | ||
|
・4~6コース終了後,増悪を認めなければベバシズマブ+アテゾリズマブ併用の維持療法を考慮する ・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
|||
| CBDCA | (AUC=6),day 1 | 3週毎 | |
| nab-PTX | 100mg/m2,day 1,8,15 | ||
| アテゾリズマブ | 1200mg/body,day 1 | ||
|
・4コース終了後,増悪を認めなければアテゾリズマブ単剤の維持療法を考慮する |
|||
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3コース毎)に1回投与する。
| ベバシズマブ併用 | CBDCA | (AUC=6),day 1 | 3週毎 |
|---|---|---|---|
| PTX | 200mg/m2,day 1 | ||
| ベバシズマブ | 15mg/kg,day 1 | ||
|
・PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う ・増悪しなければ上記を6コース以内で繰り返す ・プラチナ製剤併用療法の終了後,病勢増悪もしくは毒性中止までベバシズマブの単剤投与を継続する |
|||
| ラムシルマブ併用 | DTX | 60mg/m2,day 1 | 3週毎 |
| ラムシルマブ | 10mg/kg,day 1 | ||
| ネシツムマブ併用 | CDDP | 75mg/m2,day 1 | 3週毎 |
| GEM | 1250mg/m2,day 1,8 | ||
| ネシツムマブ | 800mg/body,day 1,8 | ||
|
・4コース終了後,増悪を認めなければネシツムマブの単剤投与を継続する |
|||
| イピリムマブ併用 | ニボルマブ | 240mg/body,day 1 | 2週毎 |
|---|---|---|---|
| イピリムマブ | 1mg/kg,day 1 | 6週毎 |
| 免疫チェックポイント阻害薬 | (PD-L1 TPS 1%以上のみ) | 3週毎 | |
|---|---|---|---|
| ペムブロリズマブ | 200mg/body,day 1 | ||
| ニボルマブ | 240mg/body,day 1 | 2週毎 | |
| アテゾリズマブ | 1200mg/body,day 1 | 3週毎 | |
| 細胞傷害性抗癌薬 | DTX | 60mg/m2,day 1 | 3週毎 |
| PEM※ | 500mg/m2,day 1 | 3週毎 | |
| S-1 | 80-120mg/body,1日2回,day 1-28 | 6週毎 | |
| GEM | 1000mg/m2,day 1,8,15 | 4週毎 | |
| VNR | 25mg/m2,day 1,8 | 3週毎 | |
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5mgを連日経口投与する。なお,PEMの投与を中止または終了する場合には,PEM最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1mgを筋肉内投与する。その後,PEM投与期間中および投与中止後22日目まで9週毎(3コース毎)に1回投与する。


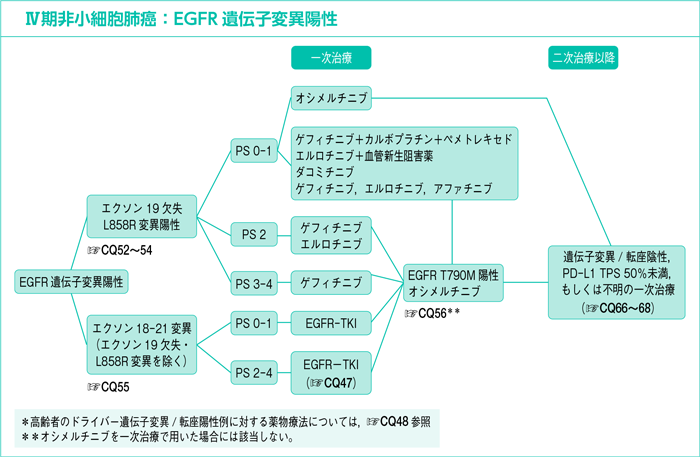
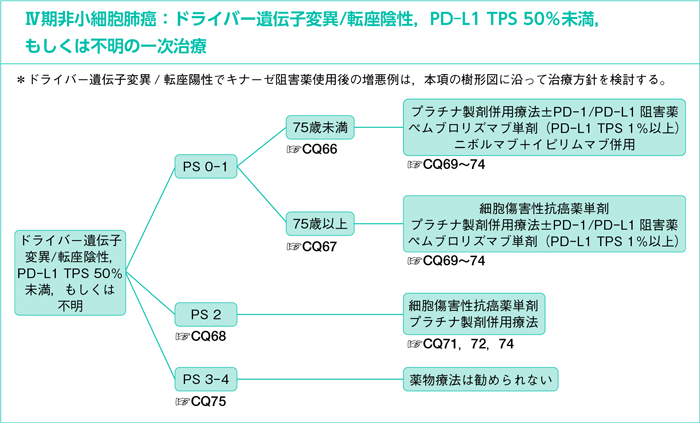
*a~dとeはCQにおける対照(comparisons)が異なっており,エビデンスの強さの評価において異なる基準を用いている(システマティックレビュー表を参照)。