Ⅲ.小細胞肺癌(SCLC)
1
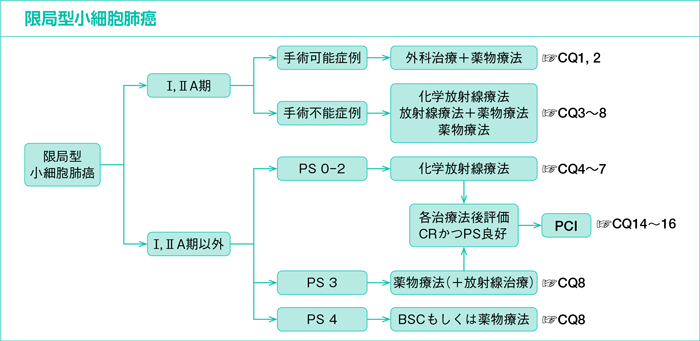
限局型小細胞肺癌(LD-SCLC)
文献検索と採択
- 文献検索期間
-
- 2009年1月1日から2020年11月30日
- 文献検索方法
-
- キーワード:SCLC,stage Ⅰ,stage Ⅰ-Ⅱ,early,inoperable,unresectable,radiotherapy
- 委員がPubMedを用いて検索し,2014年版からは医学図書館協会,2020年版からは国際医学情報センターの協力を得てより詳細な検索を行った。2021年版改訂は,下記の検索式で2020年版以降の検索を行い,各CQにおいて採用を検討した。
- 検索式(検索日:2021年2月10日)
-
#1 “Small Cell Lung Carcinoma/therapy”[Mesh] #2 #1 AND(Limited[TIAB]OR LD[TIAB]) #3 (Small-Cell Lung Cancer*[TIAB]OR Small Cell Lung Carcinoma*[TIAB]OR SCLC[TIAB])AND(limited stage*[TIAB]OR limited disease*[TIAB]OR LD[TIAB])NOT(Non-Small-Cell Lung Cancer*[TIAB]OR Nonsmall Cell Lung Cancer*[TIAB]OR Non Small Cell Lung Carcinoma*[TIAB]OR Nonsmall-Cell Lung Carcinoma*[TIAB]OR NSCLC[TIAB]) #4 #2 OR #3 #5 #4 AND 2019/12:2020/11[DP] #6 #5 AND(JAPANESE[LA]OR ENGLISH[LA])
- 採択方法
-
- 文献はメタアナリシス,第Ⅲ相試験,ランダム化比較第Ⅱ相試験を中心に抽出し,総説もしくは検索時点で日本における未承認薬を用いた試験は除外した。なお,治療リスクに関する重要な文献,論文化されていない重要な学会報告は上記以外でも採用した。
- これ以前の文献でも,今回の改訂に際し重要と考えられたものについては採用としている。
本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | |
|---|---|---|
| CDDP | シスプラチン | |
| CPT-11 | イリノテカン | |
| ETP | エトポシド | |
| プラチナ製剤 | CDDPとCBDCAの総称 | |
| BSC | best supportive care | 緩和治療,ベストサポーティブケア |
| CR | complete remission | 完全寛解 |
| ED | extensive disease | 進展型(小細胞肺癌の) |
| IASLC | International Association for the Study of Lung Cancer | 国際肺癌学会 |
| LD | limited disease | 限局型(小細胞肺癌の) |
| NCD | National Cancer Database | |
| OS | overall survival | 全生存期間 |
| PCI | prophylactic cranial irradiation | 予防的全脳照射 |
| PS | performance status | 全身状態 |
| SBRT | stereotactic body radiation therapy | 体幹部定位放射線治療 |
| SCLC | small cell lung cancer | 小細胞肺癌 |
樹形図
CQ1.
臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌に外科治療は勧められるか?
- 推 奨
- 臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌に対して,外科治療を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:90%〕
LDに対する標準治療は化学放射線療法とされているが,なかでも臨床病期Ⅰ-ⅡA期(第8版),特にcT1N0M0については,外科治療を含む治療法により,治癒や長期生存が期待できる症例があることが報告されており1)2),外科治療単独あるいはこれに薬物療法や放射線治療を加えることで,5年生存率が40~70%に達することが報告されている3)~6)。術式では,肺葉切除以上の術式が,部分切除術と比較してOSが良好であると報告されており7),また薬物療法単独群や化学放射線療法群よりは,外科治療に薬物療法を加えた群での局所制御率とOS中央値が有意に良好であることが報告されている8)9)。
しかしながら,外科治療の対象となる症例数は少ないため,外科治療を含む治療法とこれ以外の治療法の比較試験は存在せず,今後も施行の可能性は極めて乏しいことが予想される。臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌に対する外科治療を含む治療は治癒が得られる可能性があり,切除後に小細胞肺癌の診断が得られるケースも存在することから,すでに実地臨床においてもこの方針が踏襲されつつある10)。エビデンスの質の高い研究を列挙することは困難であるが,治療法の選択肢の1つとして推奨され得る治療法であると考えられる。
以上より,臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌に対して外科治療を行うよう推奨する。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 90% (38/42) |
10% (4/42) |
0% | 0% | 0% |
一方,リンパ節転移を認めるLDにおける外科治療の有用性は明らかではない。IASLCによる小細胞肺癌患者5,002例のデータベースから,577例に外科治療が施行された結果が報告されており,病理病期N0症例ではOS中央値が未到達(2年生存率80%)であったのに対し,N1症例では28カ月(2年生存率55%)と低下することが示されている11)。
CQ2.
小細胞肺癌の完全切除例に対して,追加の治療は勧められるか?
- 推 奨
- 小細胞肺癌の完全切除例に対して,プラチナ製剤併用療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
外科治療と併用される治療法として,どのタイミングでどの治療法を組み合わせるのがよいかということに関しては,推奨の根拠となる十分なエビデンスは存在しない。主として術前,術後の全身薬物療法が併用された報告が多く5)6)12),術後の放射線治療については報告が少ない13)14)。
Ⅰ期の完全切除例の術後治療に関するコホート研究では,術後に薬物療法を施行した群で,外科治療単独群と比較しOSは有意に良好であり,生存に関する多変量解析では,術後薬物療法または術後薬物療法+予防的全脳照射(PCI)で有意に良好な結果であった15)。本邦で行われた,外科治療後にCDDP+ETP(PE)療法による薬物療法の有用性を検証する第Ⅱ相試験(JCOG9101試験)では,臨床病期Ⅰ期の44症例では3年生存率68%であり,病理病期ⅠA期症例では5年生存率73%であった16)。その後,小細胞肺癌を含む肺原発の高悪性度神経内分泌癌の完全切除例を対象として,CDDP+CPT-11(PI療法)とPE療法を比較する第Ⅲ相試験(JCOG1205/1206試験)が行われた。主要評価項目である無再発生存期間は両群間で明らかな差を認めず(HR 1.076,95%CI:0.666-1.738,P=0.619),小細胞肺癌のサブグループ解析でも同様であった(HR 1.029,95%CI:0.544-1.944)。3年生存率は, PI療法群で79.0%,PE療法群で84.1%と,ともに良好であった17)。
術後の放射線治療に関しては,完全切除されたLD 3,017例の後ろ向き研究において,放射線治療施行群の5年生存率は,放射線治療非施行群に比べて有意に劣っていたことが報告されている。一方,この研究におけるサブグループ解析で,pN0群の5年生存率は放射線治療施行群で劣っていたが,pN2症例では,放射線治療施行群で有意に良好であった18)。
外科治療の対象となるLDの症例数が極めて少ないことから,エビデンスの質の高い研究を列挙することは困難であるが,小細胞肺癌は薬物療法に対する感受性が高いこと,また術後の薬物療法に対する良好な治療成績が報告されていること,さらに実地臨床においては切除して初めて小細胞肺癌と診断される症例も存在することなどを考慮に入れると,外科治療後の薬物療法は行うよう勧められる。
以上より,小細胞肺癌の手術後の治療として薬物療法を行うよう推奨する。エビデンスの強さはC,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
CQ3.
医学的な理由で手術ができない臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌の放射線照射法として,定位照射は勧められるか?
- 推 奨
- 医学的な理由で手術ができない臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌の放射線照射法として,定位照射を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:89%〕
LDに対する標準治療は化学放射線療法とされているが,臨床病期Ⅰ-ⅡA期(第8版),特にcT1N0M0については,治癒や長期生存が期待できる症例が存在することが報告されており,外科治療を含む治療法が選択される。しかしながら,切除不能症例に対する標準治療は定まっていない。これらの中で,臨床病期Ⅰ-ⅡA期の非小細胞肺癌に対する根治療法として,SBRTが局所制御の向上と毒性の軽減の点で代表的な治療法として行われているが,2012年以降,小細胞肺癌に対するSBRTの安全性と良好な局所制御に関する成績が国内外から報告されている19)~24)。日本放射線腫瘍学研究機構が行った本邦の遡及的調査の結果,64例(手術不能66%)に35~60Gy/3-19Frの寡分割照射が行われ,OS中央値が23.5カ月,2年の全生存率,局所制御率はそれぞれ76.3%,89.3%であった22)。米国の多施設コホート研究では,2005~15年に74例(手術不能88%)に48~60Gy/3-5FrのSBRTが施行され,OS中央値が17.8カ月,3年の全生存率,局所制御率はそれぞれ34.6%,96.1%であった23)。いずれの研究でも再発形式として遠隔転移の頻度が高く,化学療法併用の症例のOSが良好であった。また,米国のNCDB調査報告として,2004~13年にT1-T2N0M0でSBRTを施行した症例は285例であり,OS中央値23.5カ月,3年生存率35.2%であった。また,Ⅰ期小細胞肺癌にSBRTが用いられる割合は,2004年の0.4%に対し,2013年には6.4%と10倍以上に増加していた25)。NCDBを用いた治療法別の成績を検討した別の報告では,縮小手術例と比べてSBRTのOSは有意な差を認めなかった(HR 1.24,95%CI:0.95-1.61,P=0.11)。また非手術例に限るとSBRTは従来照射法より良好なOSであった(HR 1.30,95%CI:1.02-1.66,P=0.04)26)。NCDB(2004~14年)を用いた報告では,化学療法併用時の照射法別の成績を通常分割照射(CFRT)1,958例とSBRT 149例において比較し,OSに有意差は認められず(OS中央値CFRT:31.2カ月,SBRT:29.2カ月,P=0.77),傾向スコアマッチした群の比較でも同様であった27)。また別のNCDB(2004~15年)を用いた報告では,化学療法併用症例においてSBRTがOS良好な傾向にあった(HR 0.73,P=0.06)28)。
SBRTの報告数は少なく,それぞれの症例数も十分ではないが,いずれも安全で良好な局所制御が報告されている。Ⅰ-ⅡA期の小細胞肺癌はLDに含まれており,切除不能の場合,加速過分割照射法を用いた化学放射線療法が標準治療であるため,放射線治療法にSBRTを採用することは肺毒性の軽減,利便性,コスト削減の点からは有利な点も多い。
以上より,医学的な理由で手術ができない臨床病期Ⅰ-ⅡA期(第8版)の小細胞肺癌の放射線照射法として定位照射を行うよう提案する。エビデンスの強さはD,ただし総合的評価では行うことを弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 89% (32/36) |
11% (4/36) |
0% | 0% |
CQ4.
限局型小細胞肺癌(PS 0-2)において,化学放射線療法は勧められるか?
- 推 奨
- 限局型小細胞肺癌(PS 0-2)に対して,化学放射線療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:A,合意率:100%〕
LDに対して薬物療法と胸部放射線治療の併用は,薬物療法単独に比べてOSを改善することが2つのメタアナリシスにより明らかにされている。13の比較試験のメタアナリシスでは,薬物療法に胸部放射線治療を併用すると,死亡の絶対リスクが14%減少し,3年生存率が5.4±1.4%改善することが報告されている29)。11の比較試験のメタアナリシスでは,薬物療法に胸部放射線治療を併用すると,2年生存率が5.4%,局所制御率が25.3%改善することが報告されている30)。有害事象に関しては,薬物療法と胸部放射線治療の併用により治療関連死が1.2%増加することが報告されており,併用の際には有害事象の発生について十分に注意する必要がある。
以上より,限局型小細胞肺癌(PS 0-2)に対して化学放射線療法を行うよう推奨する。エビデンスの強さはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
CQ5.
限局型小細胞肺癌(PS 0-2)の化学放射線療法における放射線治療のタイミングは,早期同時併用が勧められるか?
- 推 奨
- 限局型小細胞肺癌(PS 0-2)の化学放射線療法における放射線治療は,早期同時併用を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
薬物療法に胸部放射線治療を併用する場合のタイミングとして,主に同時併用(早期・後期)と逐次併用が挙げられる。CDDP+ETP療法に過分割照射を用いた放射線同時併用と逐次併用の比較試験(JCOG9104試験)では,前者において良好なOS中央値が得られ(27.2カ月vs 19.7カ月,P=0.097),毒性も忍容可能であった31)。同時併用における放射線療法の時期を検討する比較試験においては,いくつかの試験で早期同時併用することによりOSが改善することが示されている32)~37)。放射線治療のタイミングを検討したこれらの試験のメタアナリシスでは,早期同時併用の2年生存率の有意な改善38),プラチナ製剤併用療法を用いた場合の早期同時併用の2年生存率の有意な改善39),治療開始(放射線治療もしくは薬物療法)から放射線治療の終了日までの期間が30日以内であった場合の5年生存率の有意な改善40),薬物療法のコンプライアンスが同様であった場合に早期もしくは短期間の放射線併用療法でOSの有意な改善41)などが報告されている。これらの結果は早期の放射線治療の施行と照射期間の短縮が独立した因子あるいは相互的に影響して予後を改善する可能性を支持している。
一方,有害事象に関しては,同時併用や早期同時併用において食道炎や肺臓炎,骨髄抑制(白血球減少,好中球減少,貧血)の頻度が増加することが報告されている。
以上より,限局型小細胞肺癌(PS 0-2)の化学放射線療法における放射線治療は早期同時併用を行うよう推奨する。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
CQ6.
限局型小細胞肺癌(PS 0-2)に対する放射線照射法は,通常照射法と加速過分割照射法のどちらが勧められるか?
- 推 奨
- 限局型小細胞肺癌(PS 0-2)に対する放射線照射法は,加速過分割照射法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:B,合意率:100%〕
化学療法と放射線療法を併用する際の放射線照射方法に関しては,過分割照射法と通常照射法を比較した3つのランダム化試験が報告されている。通常照射法45Gy/25回/5週と加速過分割照射法45Gy/30回/3週の比較試験では,加速過分割照射法群で有意にOSを延長した42)。一方,通常照射法50.4Gy/28回/6週と2.5週間の休止期間を含む過分割照射48Gy/32回/6週の比較試験ではOS,局所制御率,無再発生存期間において両群間で差がなかった43)。有害事象に関しては,加速過分割照射法で通常照射法より食道炎の頻度が高かった。上記2試験が異なる結果となった理由として,全照射期間の違いや通常照射法の線量の違いが挙げられる。全照射期間の延長は照射中の腫瘍の加速再増殖を促す可能性があるため,全照射期間の短縮は治療成績の向上につながると考えられ,照射期間の違いが治療成績に影響した可能性がある。また,通常照射法45Gy/25回/5週と加速過分割照射法45Gy/30回/3週を用いた試験では,総線量は同じであるものの生物学的な効果を示す線量として加速過分割照射法が高い線量となっており,通常照射法の線量の違いが治療成績に影響した可能性も指摘されている。その後,加速過分割照射法45Gy/30回/19日に対する通常照射法66Gy/33回/45日の優越性を検証する比較試験が行われ,主要評価項目であるOSに差を認めず,通常照射法の加速過分割照射法に対する優越性は示されなかった。無増悪生存期間,局所制御率にも差を認めず,有害事象に関しては,加速過分割照射法群でGrade 4の好中球減少の頻度が高かったが,その他の有害事象には差を認めなかった44)。
以上より,限局型小細胞肺癌(PS 0-2)に対する放射線照射法は,加速過分割照射法を行うよう推奨する。エビデンスの強さはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
なお,加速過分割照射による有害事象の増強が懸念される場合や,加速過分割照射が困難な場合は,通常照射でも同程度の治療効果が得られるという報告から,通常照射法も選択肢となる。
CQ7.
限局型小細胞肺癌(PS 0-2)に対する化学放射線療法に併用する最適な薬物療法は何か?
- 推 奨
-
- a.
- 限局型小細胞肺癌(PS 0-2)に対する放射線治療と同時併用する際の薬物療法は,シスプラチン+エトポシド療法を行うよう推奨する。
〔推奨の強さ:1,エビデンスの強さ:C,合意率:100%〕
-
- b.
- シスプラチン+エトポシド療法の投与が困難な場合,カルボプラチン+エトポシド療法後に逐次放射線療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:D,合意率:100%〕
-
a.化学放射線療法に併用する薬物療法のレジメンに関しては,放射線治療の照射方法を一定にして薬物療法のレジメンを比較検討した臨床試験はない。薬物療法と過分割照射による放射線治療の同時併用の比較試験においてCDDP+ETP(PE)療法が多く用いられており31)42)~44),本邦で行われたPE療法(1サイクル)と過分割照射同時併用療法後にCDDP+CPT-11(PI)療法へ変更する群(3サイクル)とPE療法を継続する群(3サイクル)を比較した第Ⅲ相試験(JCOG0202試験)において,PI群におけるOSの延長効果を認めなかった45)。
以上より,限局型小細胞肺癌(PS 0-2)に対する放射線療法と同時併用する際の薬物療法は,CDDP+ETP療法を行うよう推奨する。エビデンスの強さはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 100% (35/35) |
0% | 0% | 0% | 0% |
-
b.CDDP+ETP療法以外の化学放射線療法に併用するレジメンとしては,CBDCA+ETP療法などが検討されているが,エビデンスは少なく骨髄抑制の頻度が高いことが報告されている46)47)。高齢者に関しては,LDに対する化学放射線療法を評価する多くの臨床試験において対象が75歳以下に限定されておりデータは少ない。一部の臨床試験では年齢制限を設けておらず,少数ではあるが75歳以上の患者も登録されており,70歳以上と70歳以下のサブグループ解析では,毒性は有意に増すもののOSなどの治療成績は同等と報告されている48)。また,70歳以上のLD症例における8,637例のコホート研究では,薬物療法と放射線治療(同時併用もしくは遂時併用)を施行した群で,薬物療法単独群よりOSの有意な延長を認めたことが報告されている49)。LDの治療目標は治癒であることから,高齢であることのみを理由に治療強度を減弱させるのは好ましくないが,化学放射線療法の同時併用療法は,その毒性を鑑みると慎重に行う必要がある。実臨床においてはCDDP+ETP療法の投与が困難な症例,高齢者,PS不良例においては毒性を考慮し薬物療法+遂時放射線療法が選択されることが多い。
以上より,CDDP+ETP療法の投与が困難な場合には,CBDCA+ETP療法後に逐次放射線療法を行うよう提案する。エビデンスの強さはD,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (35/35) |
0% | 0% | 0% |
CQ8.
PS 3-4の限局型小細胞肺癌に対して,薬物療法は勧められるか?
- 推 奨
-
- a.
- PS 3の限局型小細胞肺癌に対して,薬物療法を行うよう提案する。
〔推奨の強さ:2,エビデンスの強さ:C,合意率:100%〕
-
- b.
- PS 4の限局型小細胞肺癌に対して,薬物療法は行うよう勧めるだけの根拠が明確ではない。
〔推奨度決定不能〕
-
a.PS 3のLDに対する化学放射線療法のデータはない。進展型小細胞肺癌ではPS不良例に対しても至適な薬物療法を検討する臨床試験がいくつか行われており50)51),PS悪化の原因が小細胞肺癌によるものであり,小細胞肺癌に対する治療効果によってPSの改善が得られる可能性があれば薬物療法単独治療の対象になり得る。また,薬物療法中もしくは薬物療法後にPSが0-2に改善した場合,LDに対して薬物療法と放射線治療の併用が薬物療法単独に比べてOSを改善することが2つのメタアナリシスにより明らかにされており29)30),同時併用でなくとも放射線治療を追加することでOSが延長する可能性があることから,薬物療法施行後にPSの改善が得られれば放射線治療の追加も検討する。
以上より,PS 3の限局型小細胞肺癌に対して薬物療法を行うよう提案する。エビデンスの強さはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断した。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 100% (35/35) |
0% | 0% | 0% |
-
b.PS 4に対する薬物療法の有効性や安全性のデータは極めて少ない50)。小細胞肺癌に対する薬物療法の有効性を考慮すると,PSの悪化の原因が小細胞肺癌によるもので小細胞肺癌に対する治療効果によってPSの改善が得られる可能性があれば,薬物療法の対象になり得ると考えられるが,PS 4に対しては毒性を考慮する必要がある。
以上より,PS 4の限局型小細胞肺癌に対して薬物療法を行うよう勧めるだけの根拠が明確ではなく,推奨度決定不能とした。下記に,推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
推奨度決定不能 | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 80% (28/35) |
17% (6/35) |
3% (1/35) |
- 1)
- Namikawa S, Den T, Kimura M, et al. The role of surgical resection and the effects of neo-adjuvant therapy in the management of small cell lung cancer. Surg Today. 1994; 24(4): 342-6.
- 2)
- Niiranen A. Long-term survival in small cell carcinoma of the lung. Eur J Cancer Clin Oncol. 1988; 24(4): 749-52.
- 3)
- Shah SS, Thompson J, Goldstraw P. Results of operation without adjuvant therapy in the treatment of small cell lung cancer. Ann Thorac Surg. 1992; 54(3): 498-501.
- 4)
- Rea F, Callegaro D, Favaretto A, et al. Long term results of surgery and chemotherapy in small cell lung cancer. Eur J Cardiothorac Surg. 1998; 14(4): 398-402.
- 5)
- Inoue M, Miyoshi S, Yasumitsu T, et al. Surgical results for small cell lung cancer based on the new TNM staging system. Thoracic Surgery Study Group of Osaka University, Osaka, Japan. Ann Thorac Surg. 2000; 70(5): 1615-9.
- 6)
- Shepherd FA, Evans WK, Feld R, et al. Adjuvant chemotherapy following surgical resection for small-cell carcinoma of the lung. J Clin Oncol. 1988; 6(5): 832-8.
- 7)
- Weksler B, Nason KS, Shende M, et al. Surgical resection should be considered for stage I and II small cell carcinoma of the lung. Ann Thorac Surg. 2012; 94(3): 889-93.
- 8)
- Badzio A, Kurowski K, Karnicka-Mlodkowska H, et al. A retrospective comparative study of surgery followed by chemotherapy vs. non-surgical management in limited-disease small cell lung cancer. Eur J Cardiothorac Surg. 2004; 26(1): 183-8.
- 9)
- Rostad H, Naalsund A, Jacobsen R, et al. Small cell lung cancer in Norway. Should more patients have been offered surgical therapy? Eur J Cardiothorac Surg. 2004; 26(4): 782-6.
- 10)
- Takei H, Kondo H, Miyaoka E, et al. Surgery for small cell lung cancer: a retrospective analysis of 243 patients from Japanese Lung Cancer Registry in 2004. J Thorac Oncol. 2014; 9(8): 1140-5.
- 11)
- Nicholson AG, Chansky K, Crowley J, et al. The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the revision of the clinical and pathologic staging of small cell lung cancer in the forthcoming eighth edition of the TNM classification for lung cancer. J Thorac Oncol. 2016; 11(3): 300-11.
- 12)
- Lucchi M, Mussi A, Chella A, et al. Surgery in the management of small cell lung cancer. Eur J Cardiothorac Surg. 1997; 12(5): 689-93.
- 13)
- Yu JB, Decker RH, Detterbeck FC, et al. Surveillance epidemiology and end results evaluation of the role of surgery for stage I small cell lung cancer. J Thorac Oncol. 2010; 5(2): 215-9.
- 14)
- Bischof M, Debus J, Herfarth K, et al. Surgery and chemotherapy for small cell lung cancer in stages I-II with or without radiotherapy. Strahlenther Onkol. 2007; 183(12): 679-84.
- 15)
- Yang CF, Chan DY, Speicher PJ, et al. Role of adjuvant therapy in a population-based cohort of patients with early-stage small-cell lung cancer. J Clin Oncol. 2016; 34(10): 1057-64.
- 16)
- Tsuchiya R, Suzuki K, Ichinose Y, et al. Phase II trial of postoperative adjuvant cisplatin and etoposide in patients with completely resected stage I-IIIa small cell lung cancer: the Japan Clinical Oncology Lung Cancer Study Group Trial(JCOG9101). J Thorac Cardiovasc Surg. 2005; 129(5): 977-83.
- 17)
- Kenmotsu H, Niho S, Tsuboi M, et al. Randomized phase III study of irinotecan plus cisplatin versus etoposide plus cisplatin for completely resected high-grade neuroendocrine carcinoma of the lung: JCOG1205/1206. J Clin Oncol. 2020; 38(36): 4292-301.
- 18)
- Wong AT, Rineer J, Schwartz D, et al. Assessing the impact of postoperative radiation therapy for completely resected limited-stage small cell lung cancer using the National Cancer Database. J Thorac Oncol. 2016; 11(2): 242-8.
- 19)
- Videtic GM, Stephans KL, Woody NM, et al. Stereotactic body radiation therapy-based treatment model for stage I medically inoperable small cell lung cancer. Pract Radiat Oncol. 2013; 3(4): 301-6.
- 20)
- Shioyama Y, Nakamura K, Sasaki T, et al. Clinical results of stereotactic body radiotherapy for Stage I small-cell lung cancer: a single institutional experience. J Radiat Res. 2013; 54(1): 108-12.
- 21)
- Li C, Xiong Y, Zhou Z, et al. Stereotactic body radiotherapy with concurrent chemotherapy extends survival of patients with limited stage small cell lung cancer: a single-center prospective phase II study. Med Oncol. 2014; 31(12): 369.
- 22)
- Shioyama Y, Nagata Y, Komiyama T, et al. Multi-institutional retrospective study of stereotactic body radiation therapy for stage I small cell lung cancer: Japan Radiation Oncology Study Group(JROSG). Int J Radiat Oncol Biol Phys. 2015; 93(3, Suppl): S101.
- 23)
- Verma V, Simone CB 2nd, Allen PK, et al. Multi-institutional experience of stereotactic ablative radiation therapy for stage I small cell lung cancer. Int J Radiat Oncol Biol Phys. 2017; 97(2): 362-71.
- 24)
- Shioyama Y, Onishi H, Takayama K, et al. Clinical outcomes of stereotactic body radiotherapy for patients with stage I small-cell lung cancer: analysis of a subset of the Japanese Radiological Society multi-institutional SBRT study group database. Technol Cancer Res Treat. 2018; 17: 1533033818783904.
- 25)
- Stahl JM, Corso CD, Verma V, et al. Trends in stereotactic body radiation therapy for stage I small cell lung cancer. Lung Cancer. 2017; 103: 11-6.
- 26)
- Paximadis P, Beebe-Dimmer JL, George J, et al. Comparing treatment strategies for stage I small-cell lung cancer. Clin Lung Cancer. 2018; 19(5): e559-65.
- 27)
- Verma V, Hasan S, Wegner RE, et al. Stereotactic ablative radiation therapy versus conventionally fractionated radiation therapy for stage I small cell lung cancer. Radiother Oncol. 2019; 131: 145-9.
- 28)
- Newman NB, Sherry AD, Byrne DW, et al. Stereotactic body radiotherapy versus conventional radiotherapy for early-stage small cell lung cancer. J Radiat Oncol. 2019; 8(2): 239-48.
- 29)
- Pignon JP, Arriagada R, Ihde DC, et al. A meta-analysis of thoracic radiotherapy for small-cell lung cancer. N Engl J Med. 1992; 327(23): 1618-24.
- 30)
- Warde P, Payne D. Does thoracic irradiation improve survival and local control in limited-stage small-cell carcinoma of the lung? A meta-analysis. J Clin Oncol. 1992; 10(6): 890-5.
- 31)
- Takada M, Fukuoka M, Kawahara M, et al. Phase III study of concurrent versus sequential thoracic radiotherapy in combination with cisplatin and etoposide for limited-stage small-cell lung cancer: results of the Japan Clinical Oncology Group Study 9104. J Clin Oncol. 2002; 20(14): 3054-60.
- 32)
- Murray N, Coy P, Pater JL, et al. Importance of timing for thoracic irradiation in the combined modality treatment of limited-stage small-cell lung cancer. The National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 1993; 11(2): 336-44.
- 33)
- Perry MC, Eaton WL, Propert KJ, et al. Chemotherapy with or without radiation therapy in limited small-cell carcinoma of the lung. N Engl J Med. 1987; 316(15): 912-8.
- 34)
- Perry MC, Herndon JE 3rd, Eaton WL, et al. Thoracic radiation therapy added to chemotherapy for small-cell lung cancer: an update of Cancer and Leukemia Group B Study 8083. J Clin Oncol. 1998; 16(7): 2466-7.
- 35)
- Sun JM, Ahn YC, Choi EK, et al. Phase III trial of concurrent thoracic radiotherapy with either first- or third-cycle chemotherapy for limited-disease small-cell lung cancer. Ann Oncol. 2013; 24(8): 2088-92.
- 36)
- Spiro SG, James LE, Rudd RM, et al. Early compared with late radiotherapy in combined modality treatment for limited disease small-cell lung cancer: a London Lung Cancer Group multicenter randomized clinical trial and meta-analysis. J Clin Oncol. 2006; 24(24): 3823-30.
- 37)
- Jeremic B, Shibamoto Y, Acimovic L, et al. Initial versus delayed accelerated hyperfractionated radiation therapy and concurrent chemotherapy in limited small-cell lung cancer: a randomized study. J Clin Oncol. 1997; 15(3): 893-900.
- 38)
- Fried DB, Morris DE, Poole C, et al. Systematic review evaluating the timing of thoracic radiation therapy in combined modality therapy for limited-stage small-cell lung cancer. J Clin Oncol. 2004; 22(23): 4837-45.
- 39)
- Pijls-Johannesma M, De Ruysscher D, Vansteenkiste J, et al. Timing of chest radiotherapy in patients with limited stage small cell lung cancer: a systematic review and meta-analysis of randomised controlled trials. Cancer Treat Rev. 2007; 33(5): 461-73.
- 40)
- De Ruysscher D, Pijls-Johannesma M, Bentzen SM, et al. Time between the first day of chemotherapy and the last day of chest radiation is the most important predictor of survival in limited-disease small-cell lung cancer. J Clin Oncol. 2006; 24(7): 1057-63.
- 41)
- De Ruysscher D, Lueza B, Le Péchoux C, et al. Impact of thoracic radiotherapy timing in limited-stage small-cell lung cancer: usefulness of the individual patient data meta-analysis. Ann Oncol. 2016; 27(10): 1818-28.
- 42)
- Turrisi AT 3rd, Kim K, Blum R, et al. Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med. 1999; 340(4): 265-71.
- 43)
- Bonner JA, Sloan JA, Shanahan TG, et al. Phase III comparison of twice-daily split-course irradiation versus once-daily irradiation for patients with limited stage small-cell lung carcinoma. J Clin Oncol. 1999; 17(9): 2681-91.
- 44)
- Faivre-Finn C, Snee M, Ashcroft L, et al. Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer(CONVERT): an open-label, phase 3, randomised, superiority trial. Lancet Oncol. 2017; 18(8): 1116-25.
- 45)
- Kubota K, Hida T, Ishikura S, et al. Etoposide and cisplatin versus irinotecan and cisplatin in patients with limited-stage small-cell lung cancer treated with etoposide and cisplatin plus concurrent accelerated hyperfractionated thoracic radiotherapy(JCOG0202)a randomised phase 3 study. Lancet Oncol. 2014; 15(1): 106-13.
- 46)
- Kim E, Biswas T, Bakaki P, et al. Comparison of cisplatin/etoposide versus carboplatin/etoposide concurrent chemoradiation therapy for limited-stage small cell lung cancer(LS-SCLC)in the elderly population(age>65 years)using national SEER-Medicare data. Pract Radiat Oncol. 2016; 6(5): e163-9.
- 47)
- Rossi A, Di Maio M, Chiodini P, et al. Carboplatin- or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer: the COCIS meta-analysis of individual patient data. J Clin Oncol. 2012; 30(14): 1692-8.
- 48)
- Yuen AR, Zou G, Turrisi AT, et al. Similar outcome of elderly patients in intergroup trial 0096: Cisplatin, etoposide, and thoracic radiotherapy administered once or twice daily in limited stage small cell lung carcinoma. Cancer. 2000; 89(9): 1953-60.
- 49)
- Corso CD, Rutter CE, Park HS, et al. Role of Chemoradiotherapy in Elderly Patients With Limited-Stage Small-Cell Lung Cancer. J Clin Oncol. 2015; 33(36): 4240-6.
- 50)
- Girling DJ. Comparison of oral etoposide and standard intravenous multidrug chemotherapy for small-cell lung cancer: a stopped multicentre randomised trial. Medical Research Council Lung Cancer Working Party. Lancet. 1996; 348(9027): 563-6.
- 51)
- Souhami RL, Spiro SG, Rudd RM, et al. Five-day oral etoposide treatment for advanced small-cell lung cancer: randomized comparison with intravenous chemotherapy. J Natl Cancer Inst. 1997; 89(8): 577-80.
- レジメン
- 限局型小細胞肺癌
| CDDP+ETP療法 | CDDP | 80mg/m2,day 1 | 3週毎 計4コース |
|---|---|---|---|
| ETP | 100mg/m2,day 1-3 | ||
| CDDP+CPT-11療法 | CDDP | 60mg/m2,day 1 | 4週毎 計4コース |
| CPT-11 | 60mg/m2,day 1,8,15 |
| 胸部放射線治療 | 加速過分割照射法 | 1日2回,45Gy/30回 | 3週 |
|---|---|---|---|
| 化学療法 | CDDP | 80mg/m2,day 1 | 3~4週毎 (放射線治療施行中は4週毎) |
| ETP | 100mg/m2,day 1-3 |
※1.放射線治療は化学療法1コース目の第2日目から開始(早期併用)
※2.化学療法は放射線治療完遂後も合計4コースまで継続
※3.加速過分割照射法が困難であれば,通常分割照射法50~60Gy/25~30回(5~6週)を推奨