6
Ⅱ.非小細胞肺癌(NSCLC)
文献検索と採択

本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | IFM | イホスファミド |
|---|---|---|---|
| CDDP | シスプラチン | nab-PTX | ナブパクリタキセル |
| CPT-11 | イリノテカン | PEM | ペメトレキセド |
| DTX | ドセタキセル | PTX | パクリタキセル |
| GEM | ゲムシタビン | VNR | ビノレルビン |
| PD-1阻害剤 | ペムブロリズマブ,ニボルマブの総称 |
|---|---|
| S-1 | テガフール・ギメラシル・オテラシルカリウム配合剤 |
| プラチナ製剤 | CDDPとCBDCAの総称 |
| 第1・2世代のEGFR-TKI | ゲフィチニブ・エルロチニブ・アファチニブの総称 |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
|---|---|---|
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| MST | median survival time | 生存期間中央値 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 一般状態 |
| QOL | quality of life | 生活の質 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害剤 |
| Score | 定 義 |
|---|---|
| 0 | 全く問題なく活動できる。 発病前と同じ日常生活が制限なく行える。 |
| 1 | 肉体的に激しい活動は制限されるが,歩行可能で,軽作業や座っての作業は行うことができる。例:軽い家事,事務作業 |
| 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。 日中の50%以上はベッド外で過ごす。 |
| 3 | 限られた自分の身の回りのことしかできない。 日中の50%以上をベッドか椅子で過ごす。 |
| 4 | 全く動けない。 自分の身の回りのことは全くできない。 完全にベッドか椅子で過ごす。 |
出典:Common Toxicity Criteria Version2.0 Publish Date April 30, 1999
(JCOGホームページhttp://www.jcog.jp/より引用)
しかしながら,日本の臨床試験においては75歳以上の患者が除外されていることが多く,75歳以上の高齢者のデータは少ない。また,近年の70歳以上の高齢者を対象とした第3世代細胞障害性抗癌剤単剤とプラチナ製剤併用療法を比較した2編の第Ⅲ相試験において両試験とも登録された患者の多くが75歳以上であった。
以上より,本ガイドラインでは「75歳以上」を高齢者と定義する。
- Switch maintenance:プラチナ製剤併用療法による導入療法後,導入療法で使用した薬剤とは別の薬剤に切り替えて投与する方法。
- Continuation maintenance:プラチナ製剤併用療法による導入療法後,プラチナ製剤と併用した薬剤を継続して投与する方法。
樹形図
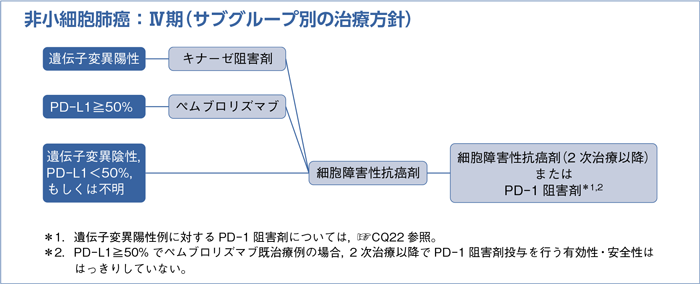
Ⅳ期非小細胞肺癌における薬物療法の意義とサブグループ別の治療方針
一方,2000年代以降になって分子標的治療薬・免疫チェックポイント阻害剤といった新規治療が登場し,これらは細胞障害性抗癌剤との比較によってその有効性を示している。
分子標的治療薬の多くはEGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異といった癌発生の直接的な原因となるようなドライバーと称される遺伝子変異に対する阻害剤である。全身状態良好で,これらドライバー遺伝子の変異を有する患者に対して,それぞれのキナーゼ阻害剤を投与することでORRの増加,PFSの延長などの有効性が報告されている。EGFR遺伝子変異,ALK遺伝子転座では細胞障害性抗癌剤と比較した第Ⅲ相試験が実施され,キナーゼ阻害剤のほうは細胞障害性抗癌剤に対して有効であることが報告されている6)~12)。頻度の少ないEGFRのuncommon mutation,ROS1遺伝子転座,BRAF遺伝子変異陽性例では細胞障害性抗癌剤と比較した第Ⅲ相試験が実施されていないが,第Ⅱ相試験や第Ⅲ相試験のサブセットではそれぞれの阻害剤によって同程度の高い有効性が報告されている13)~16)。また多くの分子標的治療薬は一般的に細胞障害性抗癌剤よりも有害事象が軽度であることが多く,少数例の検討ながらPS不良例における前向き試験での有効性が報告されている点も重要である17)18)。
2015年以降,本邦で使用可能となった免疫チェックポイント阻害剤は細胞障害性抗癌剤,分子標的治療薬と異なる作用機序を有する新規薬剤で,腫瘍免疫における負の調節因子であるPD-1などの免疫チェックポイント分子を標的とした抗体薬である。PS 0-1でEGFR遺伝子変異,ALK遺伝子転座を有さない,PD-L1陽性腫瘍細胞(TPS)が50%以上の非小細胞肺癌を対象としたPD-1阻害剤(ペムブロリズマブ)とプラチナ製剤併用療法の第Ⅲ相試験(KEYNOTE-024試験)では,ペムブロリズマブ群においてORR,PFS,OSの有意な改善が示され,有害事象も忍容可能であった19)。
以上,全身状態良好なⅣ期非小細胞肺癌患者に対しては薬物療法(細胞障害性抗癌剤,分子標的治療薬,免疫チェックポイント阻害剤)が緩和治療に比して生存期間を延長し,QOLも改善することが示されている。治療方針の決定に際して,分子標的治療薬では腫瘍における遺伝子変異の有無を,ペムブロリズマブではPD-L1の発現状態を確認する必要があり,これらの薬剤を適切なタイミングで使用するためには組織,病期診断と並行して目の前の患者が1)遺伝子変異陽性例,2)PD-L1≧50%,3)それ以外,のいずれのサブグループに属するのかを診断することが重要である。以下に各サブグループにおける治療方針を述べる。
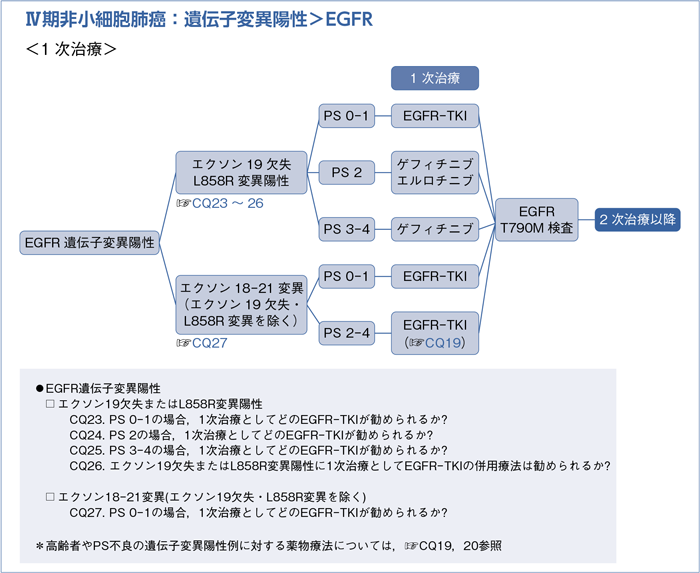
1) 遺伝子変異陽性例:☞CQ18~34
2) PD-L1強陽性(≧50%)例:☞CQ35,36
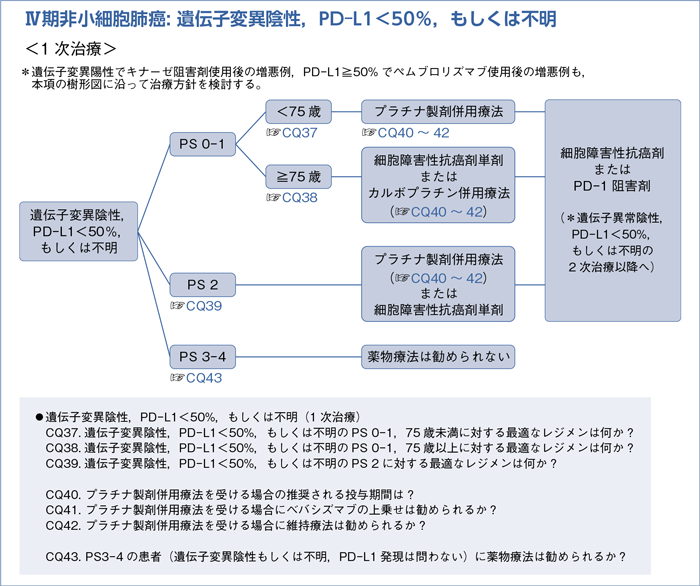
3)遺伝子変異陰性,PD-L1<50%,もしくは不明:☞CQ37~47
- 1)Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010; (5): CD007309.
- 2)Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer: a meta-analysis. J Thorac Oncol. 2007 Sep; 2(9): 845-53.
- 3)Fujiwara Y, Hotta K, Di Maio M, et al. Time trend in treatment-related deaths of patients with advanced non-small-cell lung cancer enrolled into phase Ⅲ trials of systemic treatment. Ann Oncol. 2011; 22(2): 376-82.
- 4)Anderson H, Hopwood P, Stephens RJ, et al. Gemcitabine plus best supportive care(BSC)vs BSC in inoperable non-small cell lung cancer--a randomized trial with quality of life as the primary outcome. UK NSCLC Gemcitabine Group. Non-Small Cell Lung Cancer. Br J Cancer. 2000; 83(4): 447-53.
- 5)Sederholm C, Hillerdal G, Lamberg K, et al. Phase Ⅲ trial of gemcitabine plus carboplatin versus single-agent gemcitabine in the treatment of locally advanced or metastatic non-small-cell lung cancer: the Swedish Lung Cancer Study Group. J Clin Oncol. 2005; 23(33): 8380-8.
- 6)Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8.
- 7)Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8.
- 8)Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42.
- 9)Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46.
- 10)Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22.
- 11)Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma(LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol. 2015; 16(2): 141-51.
- 12)Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77.
- 13)Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 371(21): 1963-71.
- 14)Goto K, Yang JCH, Kim DW, et al. Phase Ⅱ study of crizotinib in east Asian patients(pts)with ROS1-positive advanced non-small cell lung cancer(NSCLC). J Clin Oncol. 2016; 34(15_suppl): 9022.
- 15)Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016; 17(7): 984-93.
- 16)Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8.
- 17)Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400.
- 18)Iwama E, Goto Y, Murakami H, et al. Alectinib for Patients with ALK Rearrangement-Positive Non-Small Cell Lung Cancer and a Poor Performance Status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017; 12(7): 1161-6.
- 19)Reck M, Rodriguez-Abreu D, Robinson AG, et al; KEYNOTE-024 Investigators. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016; 375(19): 1823-33.
- 20)Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67.
- 21)Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014; 311(19): 1998-2006.
6-1.遺伝子変異陽性
樹形図

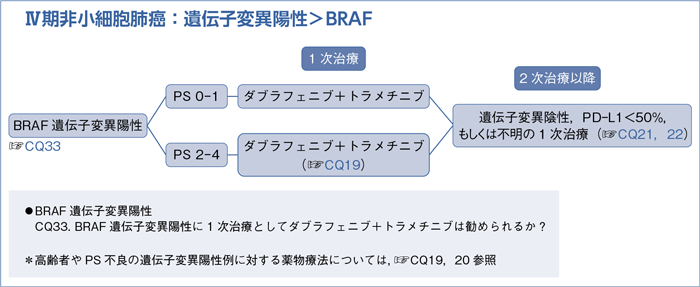
6-1-1.遺伝子変異陽性の治療方針(非扁平上皮癌)
- 推 奨
- 遺伝子変異(EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異)を有するPS 0-1の患者に,それぞれの遺伝子を標的とするキナーゼ阻害剤を行うよう推奨する。(1A)
なお,これらの試験では後治療としてクロスオーバーが認められていることから,OSの差は示されておらず生存期間において優先順位を付けることはできない。EGFR遺伝子変異陽性例の大規模研究において,1次から3次治療のエルロチニブ単剤のPFSに有意差を認めないことが報告されており13),EGFR-TKI単剤と細胞障害性抗癌剤の投与順序に関しては,現時点で明確な結論はない。毒性についてはキナーゼ阻害剤で軽い傾向にあるものの,薬剤により毒性のプロファイルおよび程度が異なる。しかしながら,EGFR-TKIをはじめとするキナーゼ阻害剤はPFS,ORRで細胞障害性抗癌剤より優れており,投与の機会を逸しないことが重要であることから,細胞障害性抗癌剤よりも優先することを推奨する。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 77% | 23% | 0% | 0% | 0% |
- 推 奨
a.遺伝子変異(EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異)を有するPS 2の患者に,それぞれの遺伝子を標的とするキナーゼ阻害剤を行うよう推奨する。(1C)
b.遺伝子変異(EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異)を有するPS 3-4の患者に,それぞれの遺伝子を標的とするキナーゼ阻害剤を行うよう提案する。(2C)
- a.
- EGFR遺伝子変異陽性やALK遺伝子転座陽性の患者を対象とした細胞障害性抗癌剤との比較試験にもPS 2の患者が5~10%程度含まれており,PS 0-1と同等の有効性が示されている3)4)7)。また,EGFR遺伝子変異陽性の患者に対するゲフィチニブや,ALK遺伝子転座陽性の患者に対するアレクチニブはPS不良例に対する有効性が報告されている14)15)。
PS 2のEGFRのuncommon mutation,ROS1遺伝子転座,BRAF遺伝子変異陽性に関するデータは患者数が少ないために限られているが,EGFRやALKの結果を鑑みて,キナーゼ阻害剤による治療を行うよう推奨される。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。 - b.
- PS 3-4のEGFR遺伝子変異陽性の患者を対象としたゲフィチニブや,ALK遺伝子転座陽性の患者を対象としたアレクチニブはPS不良例に対する有効性が報告されており,患者数はそれぞれ22人,6人と少ないが,安全性について大きな問題は認められなかった14)15)。また,ゲフィチニブの検討では奏効率が66%であり,79%の患者でPSの改善を認めている。
PS 3-4のROS1遺伝子転座,EGFRのuncommon mutation,BRAF遺伝子変異陽性に関するデータはPS 2よりもさらに限られているが,PS 2と同様に有効性が期待される。
一方,キナーゼ阻害剤によって有害事象の頻度やプロファイルは様々であり,全身状態良好例においてさえも高い頻度で休薬・減量を必要とする薬剤が存在するため,PS 3-4で用いる場合はより一層の注意が必要である。
以上より,エビデンスレベルはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 9% | 91% | 0% | 0% | 0% |
- 推 奨
- 遺伝子変異(EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異)を有する75歳以上の患者に,それぞれの遺伝子を標的とするキナーゼ阻害剤を行うよう推奨する。(1C)
EGFRのuncommon mutation,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異に関して,75歳以上のサブグループのデータはないが,一般にキナーゼ阻害剤は有害事象が細胞障害性抗癌剤と比べて軽いため,高齢者に対しても比較的安全に使用することができる。EGFR-TKIの研究結果を鑑みて,ALK遺伝子転座,ROS1遺伝子転座,BRAF遺伝子変異に対しては75歳以上でもキナーゼ阻害剤を行うように推奨する。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。ただし,薬剤による有害事象には若年者より一層の注意が必要である。
- 推 奨
- 遺伝子変異陽性例の患者においても,遺伝子変異のない患者で推奨される細胞障害性抗癌剤を行うよう推奨する。(1A)
- 推 奨
- 遺伝子変異陽性例の患者に免疫チェックポイント阻害剤を勧めるだけの根拠が明確ではない。(推奨なし)
これらの結果,本CQに対しては推奨度を決定するのに十分なデータがないことから推奨なし,とした。
6-1-2.EGFR遺伝子変異陽性(非扁平上皮癌)
■EGFR遺伝子変異陽性の1次治療:エクソン19欠失またはL858R変異陽性
- 推 奨
- EGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブのいずれか)を行うよう推奨する。(1A)
これらの結果,PS 0-1,75歳未満に対しては,EGFR-TKIを行うように推奨する。
EGFR-TKI同士を直接比較した第Ⅲ相試験で優越性が示されたものはなく,特定の薬剤を推奨することはない。ランダム化第Ⅱ相試験では,アファチニブがゲフィチニブに対して,PFSの延長を示したものの,毒性はより高度であった24)25)。効果と毒性を考慮したうえで,いずれかのEGFR-TKIを選択することが推奨される。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。
- 推 奨
- EGFR-TKI(ゲフィチニブ,エルロチニブのいずれか)を行うよう推奨する。(1C)
- 推 奨
- ゲフィチニブを行うよう推奨する。(1C)
以上より,エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 60% | 40% | 0% | 0% | 0% |
- 推 奨
- エルロチニブ+ベバシズマブを行うよう提案する。(2C)
なお,EGFR-TKIと細胞障害性抗癌剤の併用も複数報告されているが,これについては標準治療であるEGFR-TKI単剤の1次治療とその後の細胞障害性抗癌剤も含めた治療成績との比較が不明であり,現時点でその有効性は不明である。
■EGFR遺伝子変異陽性の1次治療:エクソン18-21変異(エクソン19欠失・L858R変異を除く)
- 推 奨
a.エクソン18-21の遺伝子変異(エクソン19欠失・L858R変異・エクソン20の挿入変異・T790M変異以外)にはEGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブ)による治療を行うよう提案する。(2C)
b.エクソン20の挿入変異にはEGFR-TKIを行わないよう推奨する。(1C)
c.EGFR-TKI未治療のT790M変異にオシメルチニブを行うよう勧めるだけの根拠が明確ではない。(推奨なし)
*EGFR遺伝子変異の種類,検査法などの詳細については「肺癌患者におけるEGFR遺伝変異検査の手引き」(日本肺癌学会)を参照
*Uncommon mutationがある場合は,エクソン19の欠失とL858R変異が同時にあったとしても,uncommon mutationに分類する。
- a.
- EGFR遺伝子変異の約90%をエクソン19の欠失変異,エクソン21のL858R変異が占める28)。その他の遺伝子変異はuncommon mutationと称され,エクソン18-21にわたり(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)が報告されている。これらの変異でもEGFR-TKIの感受性はあるが奏効率はやや劣ると報告されている29)。第Ⅲ相試験の多くは,これらの変異が除外されているが1)4)21),含まれたとしても全体の1割程度に過ぎない2)5)6)。
T790Mとエクソン20の挿入変異以外のuncommon mutationでは,EGFR-TKIにて48~71%の奏効率が得られている29)30)。なかでもアファチニブの奏効率は71.1%であり,ゲフィチニブやエルロチニブより高い傾向にあった30)。アファチニブのデータは前向き試験の結果ではあるものの少数のサブセットであり,他のEGFR-TKIと差を付けるだけの根拠に乏しいと考えられた。
以上より,EGFR-TKIによる治療を提案する。エビデンスレベルはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。 - b.
- エクソン20の挿入変異の報告は少なく奏効率も10%弱であることから,1次治療としてEGFR-TKIを行わないよう推奨する30)31)。エビデンスレベルはC,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- c.
- EGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブ)による治療の前にT790M変異陽性の患者の報告は少なく,オシメルチニブを行うように勧めるだけの根拠が明確ではない。
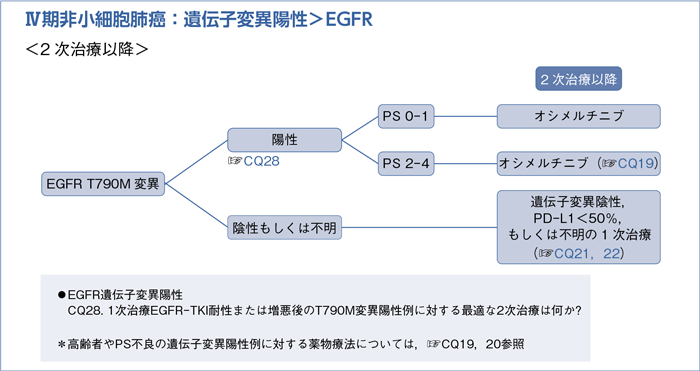
■EGFR遺伝子変異陽性の2次治療以降
- 推 奨
- 1次治療EGFR-TKI耐性または増悪後のT790M変異陽性例に対するオシメルチニブによる治療を行うよう推奨する。(1B)
これらの結果,オシメルチニブによる治療を行うよう勧められる。エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。
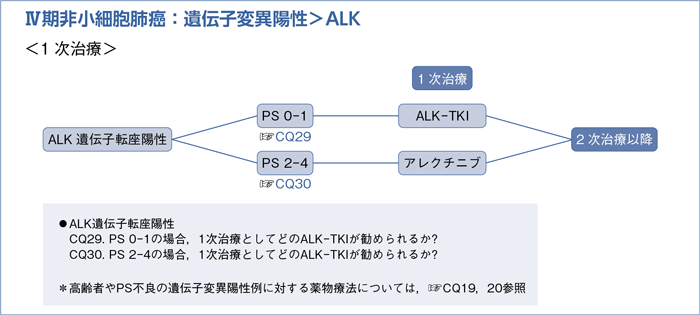
6-1-3.ALK遺伝子転座陽性(非扁平上皮癌)
■ALK遺伝子転座陽性の1次治療
- 推 奨
a.アレクチニブによる治療を行うよう推奨する。(1A)
b.クリゾチニブによる治療を行うよう提案する。(2A)
c.セリチニブによる治療を行うよう提案する。(2B)
なお,高齢者について,クリゾチニブとプラチナ製剤併用療法の第Ⅲ相試験には65歳以上の患者が16%含まれており,65歳未満と比べて有効性が劣ることはなかった7)。
アレクチニブとクリゾチニブの第Ⅲ相試験では75歳以上の患者が11%おり,75歳未満と比べてもクリゾチニブに対するアレクチニブの有効性は変わらなかった。
- 推 奨
- アレクチニブによる治療を行うよう推奨する。(1C)
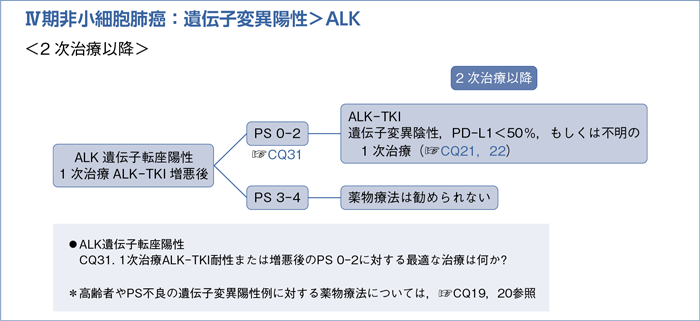
■ALK遺伝子転座陽性の2次治療以降
- 推 奨
a.初回ALK-TKIがクリゾチニブの場合は,アレクチニブによる治療を行うよう推奨する。(1C)
b.初回ALK-TKIがクリゾチニブの場合は,セリチニブによる治療を行うよう提案する。(2C)
c.初回ALK-TKIがアレクチニブまたはセリチニブの場合は,「遺伝子変異陰性,PD-L1<50%,もしくは不明に対する最適な1次治療」に準じて治療する。(☞CQ21,22)
- a.
- クリゾチニブ耐性後のALK遺伝子転座陽性進行非小細胞肺癌を対象とし,アレクチニブを投与する第Ⅰ/Ⅱ相試験ならびに第Ⅱ相試験が海外で行われ,ORR 48~50%,PFS中央値8.1~8.9カ月の良好な成績が報告されている36)~38)。日本で行われたクリゾチニブ既治療の23例に対しアレクチニブを投与した試験では,ORR 65%,PFS中央値は12.9カ月であった39)。プラチナ製剤併用療法と比較したデータはないが,少なくとも同程度の有効性は期待できる。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- b.
- ALK遺伝子転座陽性の患者を対象としセリチニブを投与する第Ⅰ相試験が行われ,expansion phaseでのサブグループ解析において,クリゾチニブ既治療の80例でORR 56%,PFS中央値6.9カ月であった40)。また,クリゾチニブならびにプラチナ製剤併用療法後に増悪したALK遺伝子転座陽性例を対象とした単アームの第Ⅱ相試験において,ORR 38.6%,PFS中央値5.7カ月の成績が報告されている41)。本邦で行われた第Ⅰ相試験においては,クリゾチニブ既治療の9例中5例でPRの効果が得られた42)。アレクチニブ同様,プラチナ製剤併用療法と比較したデータはないものの,少なくとも同程度の有効性は期待できる。エビデンスレベルはC,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 20% | 80% | 0% | 0% | 0% |
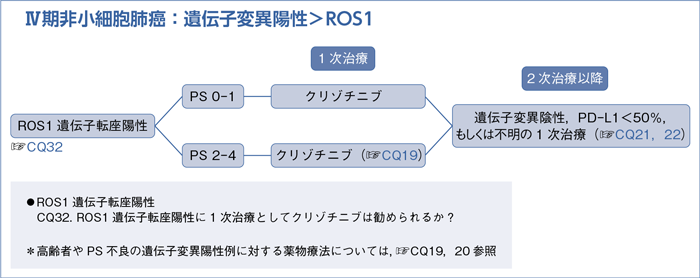
6-1-4.ROS1遺伝子転座陽性(非扁平上皮癌)
- 推 奨
- クリゾチニブを行うよう推奨する。(1C)
6-1-5.BRAF遺伝子変異陽性(非扁平上皮癌)
- 推 奨
- ダブラフェニブ+トラメチニブを行うよう提案する。(2C)
*2017年11月30日時点で,BRAF V600E遺伝子変異陽性例に対するダブラフェニブ+トラメチニブの併用療法は,本邦で保険償還されていない。承認後の使用に際しては,添付文書の記載をよく確認すること。
6-1-6.遺伝子変異陽性(扁平上皮癌)
- 推 奨
a.EGFR遺伝子高感受性変異(エクソン19の欠失またはL858Rの変異)陽性の扁平上皮癌患者に対してEGFR-TKIを使用することを提案する。(2D)
b.ALK遺伝子転座陽性,ROS1遺伝子転座陽性,BRAF遺伝子変異陽性の扁平上皮癌に対して,それぞれのキナーゼ阻害剤を使用することを提案する。(2D)
- a.
- EGFR遺伝子変異陽性の扁平上皮癌患者を対象としたEGFR-TKIを用いた比較試験は存在せず,非小細胞癌患者を対象とした前向き試験のサブグループ,それらを集めたpooled analysisのみ存在する。前向き試験から治療成績を確認できた11例の奏効率は9.1%であり,その効果は限定的であったが,エクソン18-21の遺伝子変異(エクソン19欠損・L858R変異)以外の変異症例が3例以上は含まれているため,有効性の解釈に注意が必要である43)~45)。後ろ向き研究からは奏効率25~32%,PFSは1.4~3.9カ月と報告されているが症例数は少ない43)46)47)。
以上より,EGFR遺伝子高感受性変異(エクソン19の欠失またはL858Rの変異)陽性の扁平上皮癌患者に対するEGFR-TKIの効果は限定的であるが,奏効例も存在するため行うことを提案する。エビデンスレベルはD,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Dとした。 - b.
- 扁平上皮癌患者のEGFR uncommon mutation,ALK遺伝子転座陽性,ROS1遺伝子転座陽性,BRAF遺伝子変異陽性患者を対象とした臨床試験は存在せず,エビデンスに乏しいが同じ対象におけるEGFR-TKIでの報告を鑑みて,それぞれのキナーゼ阻害剤を使用することを提案する。エビデンスレベルはD,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Dとした。
- 1)Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8.
- 2)Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8.
- 3)Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42.
- 4)Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46.
- 5)Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22.
- 6)Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma(LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol. 2015; 16(2): 141-51.
- 7)Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77.
- 8)Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 371(21): 1963-71.
- 9)Goto K, Yang JCH, Kim DW, et al. Phase Ⅱ study of crizotinib in east Asian patients(pts)with ROS1-positive advanced non-small cell lung cancer(NSCLC). J Clin Oncol. 2016; 34(15_suppl): 9022.
- 10)Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol. 2016; 17(7): 984-93.
- 11)Sequist LV, Yang JC, Yamamoto N, et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013; 31(27): 3327-34.
- 12)Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014; 311(19): 1998-2006.
- 13)Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67.
- 14)Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400.
- 15)Iwama E, Goto Y, Murakami H, et al. Alectinib for Patients with ALK Rearrangement-Positive Non-Small Cell Lung Cancer and a Poor Performance Status(Lung Oncology Group in Kyushu 1401). J Thorac Oncol. 2017; 12(7): 1161-6.
- 16)Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations: NEJ 003 study. J Thorac Oncol. 2012; 7(9): 1417-22.
- 17)Goto K, Nishio M, Yamamoto N, et al. A prospective, phase Ⅱ, open-label study(JO22903)of first-line erlotinib in Japanese patients with epidermal growth factor receptor(EGFR)mutation-positive advanced non-small-cell lung cancer(NSCLC). Lung Cancer. 2013; 82(1): 109-14.
- 18)Mitsudomi T, Morita S, Yatabe Y, et al. Updated overall survival results of WJTOG 3405, a randomized phase Ⅲ trial comparing gefitinib(G)with cisplatin plus docetaxel(CD)as the first-line treatment for patients with non-small cell lung cancer harboring mutations of the epidermal growth factor receptor(EGFR). J Clin Oncol. 2012; 30(15_suppl): 7521.
- 19)Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase Ⅲ trial comparing gefitinib with carboplatin-paclitaxel for chemo-naive non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002). Ann Oncol. 2013; 24(1): 54-9.
- 20)Inoue A, Yoshida K, Morita S, et al. Characteristics and overall survival of EGFR mutation-positive non-small cell lung cancer treated with EGFR tyrosine kinase inhibitors: a retrospective analysis for 1660 Japanese patients. Jpn J Clin Oncol. 2016; 46(5): 462-7.
- 21)Lee CK, Man J, Lord S, et al. Checkpoint Inhibitors in Metastatic EGFR-Mutated Non-Small Cell Lung Cancer-A Meta-Analysis. J Thorac Oncol. 2017; 12(2): 403-7.
- 22)Gainor JF, Shaw AT, Sequist LV, et al. EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non-Small Cell Lung Cancer: A Retrospective Analysis. Clin Cancer Res. 2016; 22(18): 4585-93.
- 23)Oizumi S, Kobayashi K, Inoue A, et al. Quality of life with gefitinib in patients with EGFR-mutated non-small cell lung cancer: quality of life analysis of North East Japan Study Group 002 Trial. Oncologist. 2012; 17(6): 863-70.
- 24)Seto T, Kato T, Nishio M, et al. Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations(JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol. 2014; 15(11): 1236-44.
- 25)Park K, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer(LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016; 17(5): 577-89.
- 26)Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer: a cohort and nested case-control study. Am J Respir Crit Care Med. 2008; 177(12): 1348-57.
- 27)Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006; 24(16): 2549-56.
- 28)Beau-Faller M, Prim N, Ruppert AM, et al. Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol. 2014; 25(1): 126-31.
- 29)Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on “uncommon” epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res. 2011; 17(11): 3812-21.
- 30)Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8.
- 31)Yasuda H, Kobayashi S, Costa DB. EGFR exon 20 insertion mutations in non-small-cell lung cancer: preclinical data and clinical implications. Lancet Oncol. 2012; 13(1): e23-31.
- 32)Mok TS, Wu Y-L, Ahn M-J, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N Engl J Med. 2017; 376(7): 629-40.
- 33)Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer(ASCEND-4): a randomised, open-label, phase 3 study. Lancet. 2017; 389(10072): 917-29.
- 34)Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer(J-ALEX): an open-label, randomised phase 3 trial. Lancet. 2017; 390(10089): 29-39.
- 35)Peters S, Camidge DR, Shaw AT, et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2017; 377(9): 829-838.
- 36)Ou SH, Ahn JS, De Petris L, et al. Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer: A Phase Ⅱ Global Study. J Clin Oncol. 2016; 34(7): 661-8.
- 37)Gadgeel SM, Gandhi L, Riely GJ, et al. Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer(AF-002JG): results from the dose-finding portion of a phase 1/2 study. Lancet Oncol. 2014; 15(10): 1119-28.
- 38)Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol. 2016; 17(2): 234-42.
- 39)Hotta K, Hida T, Nakagawa K, et al. Updated Data from JP28927 Study of Alectinib in ALK plus NSCLC Patients with or without History of ALK Inhibitor Treatment. J Thorac Oncol. 2015; 10(9): S648.
- 40)Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med. 2014 Mar 27; 370(13): 1189-97.
- 41)Crinò L, Ahn MJ, De Marinis F, et al. Multicenter Phase Ⅱ Study of Whole-Body and Intracranial Activity With Ceritinib in Patients With ALK-Rearranged Non-Small-Cell Lung Cancer Previously Treated With Chemotherapy and Crizotinib: Results From ASCEND-2. J Clin Oncol. 2016; 34(24): 2866-73.
- 42)Nishio M, Murakami H, Horiike A, et al. PhaseⅠ Study of Ceritinib(LDK378)in Japanese Patients with Advanced, Anaplastic Lymphoma Kinase-Rearranged Non-Small-Cell Lung Cancer or Other Tumors. J Thorac Oncol. 2015; 10(7): 1058-66.
- 43)Shukuya T, Takahashi T, Kaira R, et al. Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports. Cancer Sci. 2011; 102(5): 1032-7.
- 44)Yamada K, Takayama K, Kawakami S, et al. Phase Ⅱ trial of erlotinib for Japanese patients with previously treated non-small-cell lung cancer harboring EGFR mutations: results of Lung Oncology Group in Kyushu(LOGiK0803). Jpn J Clin Oncol. 2013; 43(6): 629-35.
- 45)Yamada K, Aono H, Hosomi Y, et al. A prospective, multicentre phase Ⅱ trial of low-dose erlotinib in non-small cell lung cancer patients with EGFR mutations pretreated with chemotherapy: Thoracic Oncology Research Group 0911. Eur J Cancer. 2015; 51(14): 1904-10.
- 46)Hata A, Katakami N, Yoshioka H. How sensitive are epidermal growth factor receptor-tyrosine kinase inhibitors for squamous cell carcinoma of the lung harboring EGFR gene-sensitive mutations? J Thorac Oncol. 2013; 8(1): 89-95.
- 47)Xu J, Zhang Y, Jin B, et al. Efficacy of EGFR tyrosine kinase inhibitors for non-adenocarcinoma lung cancer patients harboring EGFR-sensitizing mutations in China. J Cancer Res Clin Oncol. 2016; 142(6): 1325-30.
6-2.PD-L1≧50%
樹形図

- 推 奨
- ペムブロリズマブ単剤療法を行うよう推奨する。(1B)
以上より,PD-L1陽性細胞≧50%のⅣ期非小細胞肺癌(EGFR遺伝子変異陰性およびALK遺伝子転座陰性),PS 0-1症例に対する最適な1次治療としてペムブロリズマブ単剤療法を行うよう勧められる。エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。
- 推 奨
- ペムブロリズマブ単剤療法を行うよう提案する。(2D)
以上より,PS 2のPD-L1≧50%のⅣ期非小細胞肺癌に対し投与の是非を慎重に検討したうえで1次治療においてペムブロリズマブ単剤療法の投与を行うことをエキスパートオピニオンとして提案する。エビデンスレベルはD,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Dとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 61% | 30% | 9% | 0% |
6-3.遺伝子変異陰性,PD-L1<50%,もしくは不明
樹形図
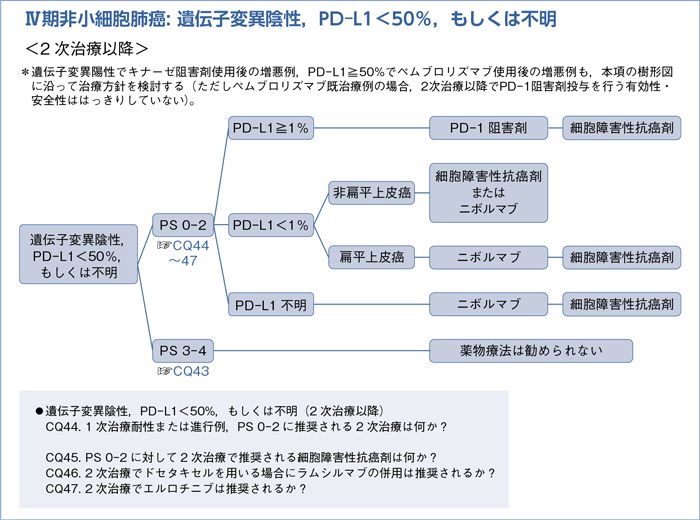
■遺伝子変異陰性,PD-L1<50%,もしくは不明の1次治療
- 推 奨
- プラチナ製剤と第3世代以降の細胞障害性抗癌剤併用を行うよう推奨する。(1A)
*PEMは非扁平上皮癌への投与が推奨される。
*ネダプラチンは扁平上皮癌への投与が推奨される。
新規薬剤においても,複数の第Ⅲ相試験によって有効性が示されているが,いくつかの薬剤は特定の組織型に対してのみ有効性が示されている。PEMはそのような薬剤の1つであり,非扁平上皮癌に対して用いられる。CDDP+PEMとCDDP+GEMの第Ⅲ相試験(JMDB試験)が行われ,全体では同等の効果であったが組織型による差が認められ,非扁平上皮癌においてはCDDP+PEM群でOSの有意な延長(11.8カ月vs 10.4カ月,HR 0.81,95%CI:0.70-0.94,P=0.005)を認めた一方で,扁平上皮癌においてはCDDP+PEM群でPFS(4.4カ月vs 5.5カ月,HR 1.36,95%CI:1.12-1.65,P=0.002), OS(9.4カ月vs 10.8カ月,HR 1.23,95%CI:1.00-1.51,P=0.05)ともに劣っていた4)。サブセット解析ではあるが,有効性ならびに毒性の観点から非扁平上皮癌においてはCDDP+PEMは至適レジメンの1つである。また,CBDCA+PEMは生存期間を主要評価項目とした比較試験がないものの,患者が自覚する毒性がCDDPよりも軽度であることから実地臨床では頻用されている。CBDCA+PEMとCBDCA+GEM,CBDCA+DTXやCBDCA+PTX+ベバシズマブとの比較試験では,生存期間や主要評価項目であった有害事象などで優越性を示せていない5)~7)。しかしながら,CBDCA+PTX+ベバシズマブと比較しても生存曲線に大きな差はなく7),ベバシズマブを併用した試験ではCBDCA+PTX+ベバシズマブよりPFSが上回る傾向にある8)。以上より,CBDCA+PEMを行うことは許容される。
扁平上皮癌に対しては,ネダプラチン+DTXとCDDP+DTXの比較第Ⅲ相試験が本邦で実施され,OSの有意な延長が認められた(13.6カ月vs 11.4カ月,HR 0.81,95%CI:0.65-1.02,P=0.037)。毒性はプロファイルが異なり,ネダプラチン群では白血球減少・好中球減少・血小板減少が多く,CDDP群では悪心・倦怠感・低ナトリウム血症・低カリウム血症が多かった。本邦において第3世代以降の細胞障害性抗癌剤併用で唯一の優越性が示された有望なレジメンである9)。
その他,S-1の有効性を評価した2編の第Ⅲ相試験(LETS試験,CATS試験)では,CBDCA+S-1はCBDCA+PTXに対して,CDDP+S-1はCDDP+DTXに対する非劣性が示された10)11)。ヒト血清アルブミンとPTXを結合させたナノ粒子製剤であるnab-PTXとCBDCAの併用療法はCBDCA+PTXとの第Ⅲ相試験において,有意にORRの上昇を認めた(33.0% vs 25.0%,response rate ratio 1.31,95%CI:1.08-1.59,P=0.005)12)。これらのレジメンは組織型にかかわらず使用可能である。
以上より,75歳未満,PS 0-1症例に対して,プラチナ製剤と第3世代以降の細胞障害性抗癌剤併用を行うよう勧められる。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。各レジメンに固有の毒性プロファイルが報告されており,これらも踏まえて選択するべきと考えられる。
- 推 奨
a.第3世代細胞障害性抗癌剤単剤を行うよう推奨する。(1A)
b.カルボプラチン併用療法を行うよう提案する。(2B)
*PEMは非扁平上皮癌への投与が推奨される。
- a.
- 高齢者においては,緩和治療に対してVNRが有意にOSを延長し薬物療法が有効であること,VNRと比較してGEMが同様の有効性を示していることが確認されている15)16)。その後,本邦で行われた第Ⅲ相試験(WJTOG9904試験)において,DTXはVNRに対して,PFSで5.5カ月vs 3.1カ月(HR 0.61,95%CI:0.45-0.82,P<0.001),OSで有意差は認めなかったものの14.3カ月vs 9.9カ月(HR 0.78,95%CI:0.56-1.09,P=0.138)と良好な成績を示した17)。
以上より,高齢者に対する標準治療はDTXをはじめとした第3世代細胞障害性抗癌剤単剤と考えられ行うよう勧められる。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。 - b.
- 高齢者を対象とした第3世代細胞障害性抗癌剤単剤とプラチナ製剤併用を比較した第Ⅲ相試験が2編報告され,両試験とも登録された患者の多くが75歳以上であった。本邦ではJCOG0803/WJOG4307L試験が行われ,weekly CDDP+DTX vs DTXが比較された。この試験では,中間解析において併用療法が単剤療法の成績を上回らないことが示され(OS 13.3カ月vs 14.8カ月,HR 1.18,95%CI:0.83-1.69),試験中止となった18)。IFCT0501試験では,CBDCA+weekly PTXとGEMもしくはVNRのランダム化比較が行われ,併用療法でPFSの有意な延長(6.0カ月vs 2.8カ月,HR 0.51,95%CI:0.42-0.62,P<0.0001),OSの有意な延長(10.3カ月vs 6.2カ月,HR 0.64,95%CI:0.52-0.78,P<0.0001)が示された19)。しかしながらこの成績は,上記aに述べた本邦での単剤療法の成績を大きく上回っているとはいえず,併用群における治療関連死が4.4%と高いなどの問題点として指摘されている。また,投与量も本邦における標準的なものとは異なっており,データの解釈には注意を要する。
以上より,PS 0-1の75歳以上症例に対して,CBDCA併用療法は選択肢の1つと考えられる。エビデンスレベルはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。
- 推 奨
a.第3世代細胞障害性抗癌剤単剤を行うよう推奨する。(1A)
b.プラチナ製剤併用療法を行うよう提案する。(2B)
*PEMは非扁平上皮癌への投与が推奨される。
- a.
- メタアナリシスにおいて第3世代細胞障害性抗癌剤(DTX,PTX,VNR,GEM)単剤療法は緩和治療に比して1年生存率約7%の改善が示されているが,この中にPS 2以上は約30%含まれていた2)。また,この解析でも取り上げられた3編の試験においてPS 2のサブセットの治療成績が明らかになっており,いずれもOSが延長する傾向が確認されている20)。
以上より,PS 2症例において,第3世代細胞障害性抗癌剤単剤を行うよう勧められる。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。 - b.
- PTX単剤とCBDCA+PTXとを比較した第Ⅲ相試験(CLGB9730試験)においてPS 2のサブセットが報告されており,CBDCA+PTXはPTX単剤に対して1年生存率で優位に上回っていた(18% vs 10%,HR 0.60,95%CI:0.40-0.91,P=0.016)21)。PS 2に対するCBDCA+PTXとCDDP+GEMとを比較した試験(ECOG1599試験)では,OSは各6.2カ月,6.9カ月と報告され,毒性に関しても忍容可能と考えられた22)。また,CBDCA+GEMとGEM単剤の比較試験が行われ,有意差が認められなかったものの,併用群でOSが6.7カ月vs 4.8カ月(P=0.49),PFSが4.1カ月vs 3.0カ月(P=0.36)の延長傾向が示された23)。さらに,PS 2症例を対象としたCBDCA+PEMとPEM単剤の第Ⅲ相試験が報告されている。この試験では第Ⅲ相試験としては登録数が205例と小規模で,扁平上皮癌を含む患者を対象としているなど問題があるが,併用群でPFSの有意な延長(5.8カ月vs 2.8カ月,HR 0.46,95%CI:0.35-0.63,P<0.001),OSの有意な延長(9.3カ月vs 5.3カ月,HR 0.62,95%CI:0.46-0.83,P=0.001)が示されている。毒性に関しては,併用群で貧血や好中球減少が高く,3.9%の治療関連死が認められた24)。
以上より,毒性が忍容可能と思われるPS 2症例に対してはプラチナ製剤併用療法を考慮してもよいと考えられる。エビデンスレベルはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。ただし,PS 2症例に関するエビデンスは限られており,そのほとんどはCBDCA併用レジメン,もしくは通常より減量した用量が用いられていることに注意が必要である。
- 推 奨
- プラチナ製剤併用療法のプラチナ製剤投与期間を6サイクル以下とするよう推奨する。(1C)
一方,近年行われた第Ⅲ相試験では,1次治療におけるプラチナ製剤の投与サイクル数を4もしくは6サイクルと規定しているものがほとんどであり,CDDP+PEMとCDDP+GEMを比較した第Ⅲ相試験(JMDB試験)では,プラチナ製剤併用療法の投与中央値はどちらも5サイクルであった4)。
以上より,プラチナ製剤併用療法の投与期間は4~6サイクルとするよう勧められる。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。効果および毒性の観点から,6サイクルを超えるプラチナ製剤の投与は推奨されない。
- 推 奨
a.ベバシズマブの適応となる75歳未満,PS 0-1症例に対して,プラチナ製剤併用療法にベバシズマブを併用するよう提案する。(2A)
b.75歳以上,もしくはPS 2症例に対して,ベバシズマブの併用を行わないよう提案する。(75歳以上:2C,PS 2:2D)
*ベバシズマブは扁平上皮癌への投与は行わない。
- a.
- メタアナリシスでは,プラチナ製剤併用療法にベバシズマブを追加することでORRの上昇,PFSの延長が示されており,OSについても延長が認められたとする報告がある28)29)。一方で,ベバシズマブの併用でGrade 3以上の毒性(蛋白尿,高血圧,出血性イベント,好中球減少,発熱性好中球減少,治療関連死)の有意な増加が報告されている28)~30)。
出血リスクに関しては,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血,コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており,ベバシズマブの投与に際してはその適応を十分に検討する必要がある30)。
CBDCA+PTXにベバシズマブを追加することの有効性を評価した第Ⅲ相試験(ECOG4599試験)では,ベバシズマブ併用群でORRの上昇,PFSの有意な延長(6.2カ月vs 4.5カ月,HR 0.66,95%CI:0.57-0.77,P<0.001)ならびにOSの有意な延長(12.3カ月vs 10.3カ月,HR 0.79,95%CI:0.67-0.92,P=0.003)を認めた31)。一方,CDDP+GEMにベバシズマブを追加した第Ⅲ相試験(AVAiL試験)においては,PFSは有意に延長したがOSでは有意な延長を認めなかった32)。本邦ではCBDCA+PTXにベバシズマブを追加するランダム化第Ⅱ相試験(JO19907試験)が行われ,併用群においてORRの上昇(60.7% vs 31.0%,P=0.0013),PFSの延長(6.9カ月vs 5.9カ月,HR 0.61,95%CI:0.42-0.89,P=0.0090)を認め,新たな毒性を認めなかったが,OSについては有意な延長を認めなかった(22.8カ月vs 23.4カ月,HR 0.99,95%CI:0.65-1.50,P=0.9526)33)。中国において同じレジメンを比較した第Ⅲ相試験(BEYOND試験)では,ベバシズマブを1次治療以後も継続することが可能なデザインであったが,PFSの有意な延長(9.2カ月vs 6.5カ月,HR 0.40,95%CI:0.29-0.54,P<0.001)と,OSの有意な延長(24.3カ月vs 17.7カ月,HR 0.68,95%CI:0.50-0.93,P=0.0154)が認められた34)。
以上より,ベバシズマブの適応となる75歳未満,PS 0-1症例に対してプラチナ製剤併用療法を用いる際にはベバシズマブを追加することが勧められる。エビデンスレベルはA,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Aとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし (記載方法の変更含む) |
行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 10% | 69% | 21% | 0% | 0% |
- ベバシズマブの投与についてはその薬剤の特性からプラチナ製剤併用療法の終了後,病勢進行もしくは毒性中止まで投与を継続する方法が一般的である31)~34)。
b-1.75歳以上
- 高齢者におけるプラチナ製剤併用療法+ベバシズマブについて,ECOG4599試験におけるサブセット解析で70歳以上の高齢者では効果の上乗せは認められず,若年に比してGrade 3以上の好中球減少,出血,蛋白尿が多かったとされている35)。その後に報告されたECOG4599試験とPoint Break試験を統合したサブセット解析では,OSおよびPFSにおいて75歳以上で特にベバシズマブの上乗せ効果に乏しい傾向がみられた36)。米国におけるベバシズマブ併用療法の後方視的研究(ARIES)では,65歳未満と65歳以上,および75歳未満と75歳以上のサブグループ解析でどちらも有効性は同等であったが,毒性の面において高齢者群でGrade 3以上の動脈血栓塞栓症が増える傾向にあり,75歳以上ではさらに高かった(65歳未満1.5%,65歳以上2.9%,75歳以上3.5%)37)。また,欧州を中心に施行されたベバシズマブ併用療法のコホート研究(SAiL)では,70歳未満と70歳以上で有効性は同等であったが,高齢者群でGrade 3以上の出血の有害事象が増える傾向がみられた(70歳未満3.5%,70歳以上5.3%)38)。ただし,後者に示す2試験はいずれも非ランダム化試験でありエビデンスは低い。
本邦においては75歳以上の高齢者におけるベバシズマブ併用療法の十分なデータはなく,有効性や安全性は確認されていない。以上より,高齢者に対するベバシズマブ併用を行うよう勧めるだけの根拠が明確ではなく,現時点では行わないよう勧められる。エビデンスレベルはC,また総合的評価では行わないよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。
b-2.PS 2
- ベバシズマブ併用の臨床試験ならびに観察研究においてその大半がPS 0-1であり,PS 2に対するベバシズマブの安全性や有効性に関してのデータは少ない37)38)。よって,PS 2に対するベバシズマブは行うよう勧めるだけの根拠が明確でない。ベバシズマブを併用することにより毒性の頻度は有意に増加することから,益と害のバランスを考慮し現時点では行わないよう勧められる。エビデンスレベルはD,ただし総合的評価では行わないよう弱く推奨(2で推奨)できると判断し,推奨度は2Dとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 12% | 88% | 0% |
- 推 奨
- 〈非扁平上皮癌〉
a.シスプラチン+ペメトレキセド併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してペメトレキセドによるcontinuation maintenanceを行うよう推奨する。(1B)
b.プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してペメトレキセドによるswitch maintenanceを行うよう提案する。(2B)
- 〈扁平上皮癌〉
c.プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対してswitch maintenance,continuation maintenanceを行わないよう推奨する。(1C)
☞維持療法
- a.
- CDDP+PEM併用療法後のPEMを用いたcontinuation maintenanceの第Ⅲ相試験(PARAMOUNT試験)で,PFSの有意な延長(4.1カ月vs 2.8カ月,HR 0.62,95%CI:0.50-0.73,P<0.0001),OSの有意な延長(13.9カ月vs 11.0カ月,HR 0.78,95%CI:0.64-0.96,P=0.0195)が示された40)。QOLの低下は認めず,維持療法群において毒性の増強はみられたものの許容範囲内であった。ベバシズマブの併用に関しては,CDDP+PEM+ベバシズマブ併用療法後にPEM+ベバシズマブ群とベバシズマブ単独群の第Ⅲ相試験(AVAPERL試験)が行われ,前者でPFSの有意な延長(7.4カ月vs 3.7カ月,HR 0.48,95%CI:0.44-0.75,P<0.0001)を認めたが,OSの有意な延長は認めなかった41)。
以上より,CDDP+PEM併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対するPEMのcontinuation maintenanceは行うよう勧められる。エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。 - b.
- プラチナ製剤併用療法後のPEMを用いたswitch maintenanceの第Ⅲ相試験で,PFSの有意な延長(4.3カ月vs 2.6カ月,HR 0.50,95%CI:0.42-0.61,P<0.0001),OSの有意な延長(13.4カ月vs 10.6カ月,HR 0.79,95%CI:0.65-0.95,P=0.012)が示された42)。しかしながら,プラセボ群に対する2次治療以降でのクロスオーバーが少ないこと,すなわち,プラセボ群において2次治療以降に有効とされているPEMが投与されていないこと(18%)が問題とされている。
以上より,プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な症例に対するPEMによるswitch maintenanceは選択肢の1つと考えられる。エビデンスレベルはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。
*エルロチニブを用いたswitch maintenanceについて
- プラチナ製剤併用療法後のエルロチニブを用いたswitch maintenanceは,第Ⅲ相試験(SATURN試験)でPFSの有意な延長(12.3週vs 11.1週,HR 0.71,95%CI:0.62-0.82,P<0.0001),OSの有意な延長(12.0カ月vs 11.0カ月,HR 0.81,95%CI:0.70-0.95,P=0.0088)が示されている43)。しかしながら,プラセボ群に対する2次治療以降でのクロスオーバーが少ないこと,すなわち,プラセボ群において2次治療以降に有効とされているエルロチニブが投与されていないこと(21%)が問題とされていた。その後,EGFR遺伝子変異陰性進行期非小細胞肺癌に対する早期からエルロチニブ維持療法を行う群とPD後にエルロチニブ療法を行う群の第Ⅲ相試験(IUNO試験)が行われた。その結果,OSにおいて早期からエルロチニブ維持療法を行う群の優位性は示されなかった(9.7カ月vs 9.5カ月,HR 1.02,95%CI:0.85-1.22,P=0.82)44)。以上より,非扁平上皮癌(治療標的となる遺伝子変異陰性もしくは不明)におけるエルロチニブの維持療法(switch maintenance)は有効性と間質性肺障害のリスクなどから臨床的有用性は低いと考えられる。
- c.
- プラチナ製剤併用療法後のPEM,エルロチニブを用いたswitch maintenanceの第Ⅲ相試験でPFS,OSの延長が示されたが,扁平上皮癌のサブセットにおいてはOSにおける有意差が消失していた42)43)。さらに,早期からエルロチニブ維持療法を行う群とPD後にエルロチニブ療法を行う群を比較した第Ⅲ相試験(IUNO試験)が行われたが,前述の試験と同様に扁平上皮癌のサブセットにおいてもOSの延長は示されなかった(9.7カ月vs 9.5カ月,HR 1.00,95%CI:0.74-1.35,P=0.82)44)。以上より,扁平上皮癌に対するswitch maintenanceは推奨するだけの根拠に乏しい。また,continuation maintenanceについても扁平上皮癌に対する有効性は示されていない。維持療法において毒性が増強する点も考慮すると,プラチナ製剤併用療法4サイクル後,病勢進行を認めず毒性も忍容可能な扁平上皮癌に対してswitch maintenance,continuation maintenanceともに行わないよう勧められる。エビデンスレベルはC,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- 推 奨
- 薬物療法を行わないよう推奨する。(1D)
以上より,PS 3-4の患者(遺伝子変異陰性もしくは不明,PD-L1発現は問わない)に対する薬物療法は行わないよう推奨される。エビデンスレベルはD,ただし総合的評価では行わないよう強く推奨(1で推奨)できると判断し,推奨度は1Dとした。
■遺伝子変異陰性,PD-L1<50%,もしくは不明の2次治療以降
- 推 奨
a.PD-L1≧1%症例に対して,PD-1阻害剤を先行するよう提案する。(2B)
b.PD-L1<1%症例に対して,
b-1.非扁平上皮癌ではニボルマブもしくは細胞障害性抗癌剤のいずれかを行うよう提案する。(推奨なし)
b-2.扁平上皮癌ではニボルマブを行うよう推奨する。(1B)
c.PD-L1発現率が測定不能な場合,ニボルマブを行うよう提案する。(2B)
*PD-L1<1%,測定不能な場合はペムブロリズマブの投与は行わない。
一方で,その後に行われた1次治療における第Ⅲ相試験(KEYNOTE-024試験)の結果,PD-L1≧50%に対しては1次治療としてペムブロリズマブ単剤が標準治療となっており,2次治療で免疫チェックポイント阻害剤を考慮すべき対象はPD-L1 50%未満となっている。そこで本項ではPD-L1の発現に基づく推奨度の検討を行った。
なお,上記の第Ⅲ相試験はいずれもPS 0-1の症例を対象として実施しており,PS 2の1次治療耐性または進行後のⅣ期非扁平上皮非小細胞肺癌症例に対するPD-1阻害剤の有用性は効果・安全性ともに現時点で不明である。そのため,PS 2に対してPD-1阻害剤の使用を推奨するだけの根拠は十分でない。ただしガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)では,PD-1阻害剤は細胞障害性抗癌剤と比較して重篤な有害事象の頻度は低いことから,投与の是非を慎重に検討したうえでPD-1阻害剤の投与を考慮してもよいという意見が多くみられた。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 83% | 17% | 0% | 0% |
- a.
- 本CQの対象であるPD-L1:1~49%のサブセット解析に関する報告はKEYNOTE-010試験に基づくペムブロリズマブのデータのみである。この試験はPD-L1:1%以上の非小細胞肺癌を対象としたペムブロリズマブ2 mg/kgもしくは10 mg/kgをDTX単剤と比較した第Ⅲ相試験で,全体ではペムブロリズマブ群において生存期間の延長が得られている(10.4カ月vs 12.7カ月vs 8.5カ月で,DTX群に対していずれも有意差あり)。この試験のPD-L1:1-49%におけるサブセット解析ではペムブロリズマブ2 mg/kg群でOSはHR 0.79(95%CI:0.61-1.04),10 mg/kg群でOSはHR 0.71(95%CI:0.53-0.94)であり,統合したOSはHR 0.76(95%CI:0.60-0.96)と,ペムブロリズマブが優れる傾向がみられた46)。またGrade 3以上の毒性はペムブロリズマブ2 mg/kg群で13%,10 mg/kg群で16%,DTX群で35%とペムブロリズマブ群で頻度が低く,ペムブロリズマブの免疫関連の毒性として甲状腺機能障害,肺臓炎,皮膚障害などが認められた。なおペムブロリズマブ2 mg/kg群と10 mg/kg群での有効性や毒性の差は認めなかったことも報告されている46)(PD-L1陽性の切除不能な進行・再発非小細胞肺癌に対する本邦でのペムブロリズマブの投与量は,添付文書より200 mg/bodyの3週毎投与である)。
ニボルマブは扁平上皮癌を対象としたCheckMate017試験において,PD-L1発現の有無を問わずDTXと比較しOSの有意な延長が示されている(9.2カ月vs 6.0カ月,HR 0.59,95%CI:0.44-0.79,P<0.001)49)。また非扁平上皮癌を対象としたCheckMate057試験においても同様にDTXと比較しOSの有意な延長が示されている(12.2カ月vs 9.4カ月,HR 0.73,95%CI:0.59-0.89,P=0.002)。同試験においてニボルマブの有効性はPD-L1発現レベルに応じて上昇し,PD-L1発現率≥1%のサブセットではOSはHR 0.58(95%CI:0.43-0.79),PFSはHR 0.70(95%CI:0.53-0.94)と有意に生存期間を延長することが示されている47)。主な毒性としてペムブロリズマブ同様に肺臓炎,甲状腺機能障害,大腸炎,肝機能障害,皮疹,1型糖尿病などの免疫関連の毒性が報告されており,毒性管理には注意が必要である。
以上より,PD-L1発現率≧1%の1次治療耐性または進行後のⅣ期非小細胞肺癌に対してはPD-1阻害剤を行うよう提案する。エビデンスレベルはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| PD-1阻害剤を推奨 | 細胞障害性抗癌剤を推奨 | 評価不能 |
|---|---|---|
| 78% | 11% | 11% |
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 12% | 87% | 0% | 0% | 0% |
- b-1.
- 非扁平上皮癌を対象としたCheckMate057試験のPD-L1陰性例におけるサブセット解析において,ORRはニボルマブ群で9%,DTX群で15%であり,またPFSのDTX群に対するHRは1.19(95%CI:0.88-1.61)と短期的な効果の指標はDTX群で良い傾向があったものの,1年のPFS率など長期の指標はニボルマブ群で優っており(18% vs 8%),OSのHRは0.90(95%CI:0.66-1.24)であった47)。主な毒性としてニボルマブ群で倦怠感,吐き気,食欲低下,DTX群で好中球減少,倦怠感,脱毛などであり,Grade3以上の毒性はニボルマブ群で有意に少なかった(10% vs 54%)。一方,ニボルマブ群で肺臓炎,甲状腺機能障害,大腸炎,肝機能障害,皮疹,1型糖尿病などの免疫関連の毒性が報告されており,免疫関連の毒性管理には注意が必要である。ペムブロリズマブはPD-L1≧1%を対象として臨床開発が行われているため,PD-L1<1%を対象としたデータはない。
以上より,現在のデータからはPD-L1<1%の非扁平上皮癌に対してニボルマブと細胞障害性抗癌剤のいずれかを勧めるだけの根拠が明確でなく,患者と腫瘍の状態を勘案しいずれかを選択するよう提案する。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)による投票によっても,いずれかの治療に値するコンセンサスは得られなかった。
| ニボルマブを推奨 | 細胞障害性抗癌剤を推奨 | 評価不能 |
|---|---|---|
| 38% | 24% | 38% |
- なお,PD-L1<1%の治療方針においては,厚生労働省により作成・公表された最適使用推進ガイドライン48)において「PD-L1発現率が1%未満であることが確認された非扁平上皮癌患者においては,原則,ドセタキセルなどの本剤(ニボルマブ)以外の抗悪性腫瘍剤の投与を優先する」と記載されており,本ガイドラインの推奨と異なる。実際の治療選択にあたっては,最適使用推進ガイドラインも参考のうえで治療方針を決定するよう推奨される。
- b-2.
- 扁平上皮癌を対象としたニボルマブのCheckMate017試験のPD-L1発現率に基づくサブセット解析では,PD-L1の発現によらずニボルマブの有効性が示されている49)。主な毒性は,ニボルマブ群で倦怠感や食欲低下,DTX群で好中球減少,倦怠感,脱毛などであり,Grade 3以上の毒性はニボルマブ群で有意に少なかった(7% vs 55%)。一方,ニボルマブ群で肺臓炎,甲状腺機能障害,大腸炎,肝機能障害,皮疹,1型糖尿病などの免疫関連の毒性が報告されており,免疫関連の毒性管理には注意が必要である。以上より,エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。
- c.
- 厚生労働省により作成・公表された最適使用推進ガイドライン48)では,原則として腫瘍のPD-L1発現に基づき治療選択をすることが推奨されており,可能なかぎりPD-L1発現率の検討を行うことが勧められるが,十分な腫瘍組織が得られないなどの理由がある場合にはそのかぎりではない。その場合にはCheckMate057試験の結果47)に基づきニボルマブの使用を提案する。エビデンスレベルはB,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 15% | 85% | 0% | 0% | 0% |
- 推 奨
- ドセタキセル±ラムシルマブ,ペメトレキセド単剤,S-1単剤を行うよう推奨する。(1A)
*PEMは非扁平上皮癌の投与が推奨される。
〈ドセタキセル単剤〉
〈ドセタキセル+ラムシルマブ〉
〈ペメトレキセド単剤〉
〈S-1単剤〉
- 推 奨
a.ラムシルマブの適応となるPS 0-1症例に対して,ドセタキセルにラムシルマブを併用するよう提案する。(2B)
b.75歳以上,もしくはPS 2症例に対して,ドセタキセルにラムシルマブを併用しないよう提案する。(75歳以上:2D,PS 2:2D)
- a.
- プラチナ製剤併用療法後に進行したPS 0-1の進行非小細胞肺癌症例を対象とし,DTX+ラムシルマブ併用療法とDTX単剤を比較する第Ⅲ相試験(REVEL試験)が行われ,主要評価項目であるOSは,ラムシルマブ併用群で有意な延長を認めた(10.5カ月vs 9.1カ月,HR 0.86,95%CI:0.75-0.98,P=0.023)。また,ラムシルマブ併用群において,PFS(4.5カ月vs 3.0カ月,HR 0.76,95%CI:0.68-0.86,P<0.0001),ORR(23% vs 14%,P<0.0001)も有意に良好であった。毒性に関しては,ラムシルマブ併用群でGrade 3/4の好中球減少,発熱性好中球減少,全Gradeの血小板減少,口内炎がより高頻度であったが,Grade 3以上の高血圧は6%で出血性イベントの多くはGrade 1/2であった56)。
また本邦において,DTX+ラムシルマブ併用療法とDTX単剤のランダム化比較第Ⅱ相試験(JVCG試験)が行われ,ラムシルマブ併用群においてPFS(5.2カ月vs 4.2カ月,HR 0.83,95%CI:0.59-1.16),OS(15.2カ月vs 13.9カ月,HR 0.77,95%CI:0.56-1.32),ORR(28.9% vs 18.5%)ともに良好な結果が示された。毒性に関しては,ラムシルマブ併用群において発熱性好中球減少の頻度が高く(34% vs 19%),低アルブミン血症,血小板減少,口内炎,鼻出血,蛋白尿などもDTX単剤よりも高頻度であったが,ほとんどはGrade 1/2であった57)。ラムシルマブにおいてもベバシズマブと同様に出血リスクには注意が必要であり,投与に際してはその適応を十分検討する必要がある。
以上より,ラムシルマブは適応と考えられる症例においてDTXに追加するよう勧められる。エビデンスレベルはB,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Bとした。
b-1.75歳以上
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 11% | 89% | 0% |
b-2.PS 2
以上より,益と害のバランスを考慮し現時点では行わないよう勧められる。エビデンスレベルはD,ただし総合的評価では行わないよう弱く推奨(2で推奨)できると判断し,推奨度は2Dとした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 0% | 28% | 72% | 0% |
- 推 奨
- EGFR遺伝子変異陰性もしくは不明の患者に対して,エルロチニブ投与を推奨するだけの根拠が明確ではない。(推奨なし)
その後,プラチナ製剤治療歴のあるEGFR遺伝子変異野生型症例を対象とし,2次治療としてDTX単剤とエルロチニブ単剤を比較する第Ⅲ相試験(TAILOR試験)が報告され,OSはDTX群が8.2カ月に対して,エルロチニブ群が5.4カ月(HR 0.73,95%CI:0.53-1.00,P=0.05)とDTX群が有意に良好であった59)。また本邦においても,主要評価項目をPFSとしてプラチナ製剤治療歴のある2次もしくは3次治療例を対象に,DTX単剤とエルロチニブ単剤を比較する第Ⅲ相試験(DELTA試験)が報告され,EGFR遺伝子変異陰性例におけるエルロチニブ群のPFSは1.3カ月,DTX群は2.9カ月(HR 1.57,95%CI:1.18-2.11,P<0.01)とエルロチニブ群で劣る結果であり,扁平上皮癌を含むEGFR遺伝子変異陰性非小細胞肺癌におけるエルロチニブ単剤の有効性はDTX単剤より低いことが示された60)。
近年,Ⅳ期非小細胞肺癌の2次治療においては,PD-1阻害剤であるニボルマブ単剤やペムブロリズマブ単剤,DTX+ラムシルマブ療法は,DTX単剤との比較試験において有意な生存期間の延長を認めⅣ期非小細胞肺癌の標準治療となり,S-1単剤もDTX単剤に対する非劣性が示され標準治療の1つとなった。新たに標準治療となったこれらの薬剤の治療成績と前述のDTX単剤との比較試験の結果を考慮するとエルロチニブ単剤は有効性が低く,EGFR遺伝子変異陰性例においてはEGFR-TKIの間質性肺障害発症のリスク因子と報告されている臨床的背景をもつことが多いため,間質性肺障害発症のリスクを考慮した慎重な患者選択が必要とされる。
以上より,遺伝子変異陰性もしくは不明におけるエルロチニブ単剤は有効性と間質性肺障害のリスクなどから推奨するだけの根拠が明確でなく,「推奨なし」とした。下記に,ガイドライン検討委員会薬物療法及び集学的治療小委員会(作成班)において推奨度決定のために行われた投票結果を記載する。
| 行うことを 推奨 |
行うことを 弱く推奨(提案) |
評価不能・推奨なし | 行わないことを 弱く推奨(提案) |
行わないことを 推奨 |
|---|---|---|---|---|
| 0% | 22% | 43% | 35% | 0% |
- 1)Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010 May 12; (5): CD007309.
- 2)Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer: a meta-analysis. J Thorac Oncol. 2007; 2(9): 845-53.
- 3)Ohe Y, Ohashi Y, Kubota K, et al. Randomized phase Ⅲ study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan. Ann Oncol. 2007; 18(2): 317-23.
- 4)Scagliotti GV, Parikh P, von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008; 26(21): 3543-51.
- 5)Grønberg BH, Bremnes RM, Fløtten O, et al. Phase Ⅲ study by the Norwegian lung cancer study group: pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol. 2009; 27(19): 3217-24.
- 6)Rodrigues-Pereira J, Kim JH, Magallanes M, et al. A randomized phase 3 trial comparing pemetrexed/carboplatin and docetaxel/carboplatin as first-line treatment for advanced, nonsquamous non-small cell lung cancer. J Thorac Oncol. 2011; 6(11): 1907-14.
- 7)Zinner RG, Obasaju CK, Spigel DR, et al. PRONOUNCE: randomized, open-label, phase Ⅲ study of first-line pemetrexed+carboplatin followed by maintenance pemetrexed versus paclitaxel+carboplatin+bevacizumab followed by maintenance bevacizumab in patients ith advanced nonsquamous non-small-cell lung cancer. J Thorac Oncol. 2015; 10(1): 134-42.
- 8)Patel JD, Socinski MA, Garon EB, et al. PointBreak: a randomized phase Ⅲ study of pemetrexed plus carboplatin and bevacizumab followed by maintenance pemetrexed and bevacizumab versus paclitaxel plus carboplatin and bevacizumab followed by maintenance bevacizumab in patients with stage ⅢB or Ⅳ nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(34): 4349-57.
- 9)Shukuya T, Yamanaka T, Seto T, et al. Nedaplatin plus docetaxel versus cisplatin plus docetaxel for advanced or relapsed squamous cell carcinoma of the lung(WJOG5208L): a randomised, open-label, phase 3 trial. Lancet Oncol. 2015; 16(16): 1630-8.
- 10)Okamoto I, Yoshioka H, Morita S, et al. Phase Ⅲ trial comparing oral S-1 plus carboplatin with paclitaxel plus carboplatin in chemotherapy-naive patients with advanced non-small-cell lung cancer: results of a west Japan oncology group study. J Clin Oncol. 2010; 28(36): 5240-6.
- 11)Kubota K, Sakai H, Katakami N, et al. A randomized phase Ⅲ trial of oral S-1 plus cisplatin versus docetaxel plus cisplatin in Japanese patients with advanced non-small-cell lung cancer: TCOG0701 CATS trial. Ann Oncol. 2015; 26(7): 1401-8.
- 12)Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase Ⅲ trial. J Clin Oncol. 2012; 30(17): 2055-62.
- 13)Maione P, Perrone F, Gallo C, et al. Pretreatment quality of life and functional status assessment significantly predict survival of elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the multicenter Italian lung cancer in the elderly study. J Clin Oncol. 2005; 23(28): 6865-72.
- 14)Hesketh PJ, Lilenbaum RC, Chansky K, et al. Chemotherapy in patients>or=80 with advanced non-small cell lung cancer: combined results from SWOG 0027 and LUN 6. J Thorac Oncol. 2007; 2(6): 494-8.
- 15)The Elderly Lung Cancer Vinorelbine Italian Study Group. Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. J Natl Cancer Inst. 1999; 91(1): 66-72.
- 16)Gridelli C, Perrone F, Gallo C, et al. Chemotherapy for elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study(MILES)phase Ⅲ randomized trial. J Natl Cancer Inst. 2003; 95(5): 362-72.
- 17)Kudoh S, Takeda K, Nakagawa K, et al. Phase III study of docetaxel compared with vinorelbine in elderly patients with advanced non-small-cell lung cancer: results of the West Japan Thoracic Oncology Group Trial(WJTOG 9904). J Clin Oncol. 2006; 24(22): 3657-63.
- 18)Abe T, Takeda K, Ohe Y, et al. Randomized phase Ⅲ trial comparing weekly docetaxel plus cisplatin versus docetaxel monotherapy every 3 weeks in elderly patients with advanced non-small-cell lung cancer: the intergroup trial JCOG0803/WJOG4307L. J Clin Oncol. 2015; 33(6): 575-81.
- 19)Quoix E, Zalcman G, Oster JP, et al. Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet. 2011; 378(9796): 1079-88.
- 20)Gridelli C, Ardizzoni A, Le Chevalier T, et al. Treatment of advanced non-small-cell lung cancer patients with ECOG performance status 2: results of an European Experts Panel. Ann Oncol. 2004; 15(3): 419-26.
- 21)Lilenbaum RC, Herndon JE 2nd, List MA, et al. Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B(study 9730). J Clin Oncol. 2005; 23(1): 190-6.
- 22)Langer C, Li S, Schiller J, et al. Randomized phase Ⅱ trial of paclitaxel plus carboplatin or gemcitabine plus cisplatin in Eastern Cooperative Oncology Group performance status 2 non-small-cell lung cancer patients: ECOG 1599. J Clin Oncol. 2007; 25(4): 418-23.
- 23)Kosmidis PA, Dimopoulos MA, Syrigos K, et al. Gemcitabine versus gemcitabine-carboplatin for patients with advanced non-small cell lung cancer and a performance status of 2: a prospective randomized phase Ⅱ study of the Hellenic Cooperative Oncology Group. J Thorac Oncol. 2007; 2(2): 135-40.
- 24)Zukin M, Barrios CH, Pereira JR, et al. Randomized phase Ⅲ trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol. 2013; 31(23): 2849-53.
- 25)von Plessen C, Bergman B, Andresen O, et al. Palliative chemotherapy beyond three courses conveys no survival or consistent quality-of-life benefits in advanced non-small-cell lung cancer. Br J Cancer. 2006; 95(8): 966-73.
- 26)Park JO, Kim SW, Ahn JS, et al. Phase Ⅲ trial of two versus four additional cycles in patients who are nonprogressive after two cycles of platinum-based chemotherapy in non small-cell lung cancer. J Clin Oncol. 2007; 25(33): 5233-9.
- 27)Rossi A, Chiodini P, Sun JM, et al. Six versus fewer planned cycles of first-line platinum-based chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2014; 15(11): 1254-62.
- 28)Lima AB, Macedo LT, Sasse AD. Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer: a systematic review and meta-analysis. PLoS One. 2011; 6(8): e22681.
- 29)Soria JC, Mauguen A, Reck M, et al. Systematic review and meta-analysis of randomised, phase Ⅱ/Ⅲ trials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-small-cell lung cancer. Ann Oncol. 2013; 24(1): 20-30.
- 30)Sandler AB, Schiller JH, Gray R, et al. Retrospective evaluation of the clinical and radiographic risk factors associated with severe pulmonary hemorrhage in first-line advanced, unresectable non-small-cell lung cancer treated with Carboplatin and Paclitaxel plus bevacizumab. J Clin Oncol. 2009; 27(9): 1405-12.
- 31)Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006; 355(24): 2542-50.
- 32)Reck M, von Pawel J, Zatloukal P, et al. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase Ⅲ trial(AVAiL). Ann Oncol. 2010; 21(9): 1804-9.
- 33)Niho S, Kunitoh H, Nokihara H, et al. Randomized phase Ⅱ study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung cancer. Lung Cancer. 2012; 76(3): 362-7.
- 34)Zhou C, Wu YL, Chen G, et al. BEYOND: A Randomized, Double-Blind, Placebo-Controlled, Multicenter, Phase Ⅲ Study of First-Line Carboplatin/Paclitaxel Plus Bevacizumab or Placebo in Chinese Patients With Advanced or Recurrent Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2015; 33(19): 2197-204.
- 35)Ramalingam SS, Dahlberg SE, Langer CJ, et al. Outcomes for elderly, advanced-stage non small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel: analysis of Eastern Cooperative Oncology Group Trial 4599. J Clin Oncol. 2008; 26(1): 60-5.
- 36)Langer CJ, Socinski MA, Patel JD, et al. Isolating the Role of Bevacizumab in Elderly Patients With Previously Untreated Nonsquamous Non-Small Cell Lung Cancer: Secondary Analyses of the ECOG 4599 and PointBreak Trials. Am J Clin Oncol. 2016; 39(5): 441-7.
- 37)Wozniak AJ, Kosty MP, Jahanzeb M, et al. Clinical outcomes in elderly patients with advanced non-small cell lung cancer: results from ARIES, a bevacizumab observational cohort study. Clin Oncol(R Coll Radiol). 2015; 27(4): 187-96.
- 38)Laskin J, Crino L, Felip E, et al. Safety and efficacy of first-line bevacizumab plus chemotherapy in elderly patients with advanced or recurrent nonsquamous non-small cell lung cancer: safety of avastin in lung trial(MO19390). J Thorac Oncol. 2012; 7(1): 203-11.
- 39)Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase Ⅱ trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer. J Clin Oncol. 2004 Jun 1; 22(11): 2184-91.
- 40)Paz-Ares LG, de Marinis F, Dediu M, et al. PARAMOUNT: Final overall survival results of the phase Ⅲ study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(23): 2895-902.
- 41)Barlesi F, Scherpereel A, Gorbunova V, et al. Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL(MO22089)randomized phase Ⅲ trial. Ann Oncol. 2014; 25(5): 1044-52.
- 42)Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet. 2009; 374(9699): 1432-40.
- 43)Cappuzzo F, Ciuleanu T, Stelmakh L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol. 2010; 11(6): 521-9.
- 44)Cicènas S, Geater SL, Petrov P, et al. Maintenance erlotinib versus erlotinib at disease progression in patients with advanced non-small-cell lung cancer who have not progressed following platinum-based chemotherapy(IUNO study). Lung Cancer. 2016; 102: 30-37.
- 45)Lee SM, Khan I, Upadhyay S, et al. First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy(TOPICAL): a double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2012; 13(11): 1161-70.
- 46)Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer(KEYNOTE-010): a randomised controlled trial. Lancet. 2016; 387(10027): 1540-50.
- 47)Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(17): 1627-39.
- 48)厚生労働省.ニボルマブ(遺伝子組換え)製剤及びペムブロリズマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(非小細胞肺癌及び悪性黒色腫)について.別添1:ニボルマブ(遺伝子組換え)~非小細胞肺癌~,平成29年2月14日,薬生薬審発0214第1号.
- 49)Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(2): 123-35.
- 50)Fossella FV, DeVore R, Kerr RN, et al. Randomized phase Ⅲ trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol. 2000; 18(12): 2354-62.
- 51)Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol. 2000; 18(10): 2095-103.
- 52)Mukohara T, Takeda K, Miyazaki M, et al. Japanese experience with second-line chemotherapy with low-dose(60mg/M2)docetaxel in patients with advanced non-small-cell lung cancer. Cancer Chemother Pharmacol. 2001; 48(5): 356-60.
- 53)Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol. 2004; 22(9): 1589-97.
- 54)Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase Ⅲ studies. Oncologist. 2009; 14(3): 253-63.
- 55)Nishio M, Mok T, Nakagawa K, et al. EAST-LC: Randomized controlled phase Ⅲ trial of S-1 versus docetaxel in patients with non-small-cell lung cancer who had received a platinum-based treatment. Annals of Oncol. 2016; 27(Suppl 6): 1218PD.
- 56)Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage Ⅳ non-small-cell lung cancer after disease progression on platinum-based therapy(REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet. 2014; 384(9944): 665-73.
- 57)Yoh K, Hosomi Y, Kasahara K, et al. A randomized, double-blind, phase Ⅱ study of ramucirumab plus docetaxel vs placebo plus docetaxel in Japanese patients with stage Ⅳ non-small cell lung cancer after disease progression on platinum-based therapy. Lung Cancer. 2016; 99: 186-93.
- 58)Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med. 2005; 353(2): 123-32.
- 59)Garassino MC, Martelli O, Broggini M, et al. Erlotinib versus docetaxel as second-line treatment of patients with advanced non-small-cell lung cancer and wild-type EGFR tumours(TAILOR): a randomised controlled trial. Lancet Oncol. 2013; 14(10): 981-8.
- 60)Kawaguchi T, Ando M, Asami K, et al. Randomized phase Ⅲ trial of erlotinib versus docetaxel as second- or third-line therapy in patients with advanced non-small-cell lung cancer: Docetaxel and Erlotinib Lung Cancer Trial(DELTA). J Clin Oncol. 2014; 32(18): 1902-8.
レジメン:Ⅳ期非小細胞肺癌
遺伝子変異陽性
| EGFR遺伝子変異陽性例 | ゲフィチニブ | 250 mg/日 | 1日1回 |
|---|---|---|---|
| エルロチニブ | 150 mg/日 | 1日1回 | |
| アファチニブ | 40 mg/日 | 1日1回 | |
| (EGFR T790M遺伝子変異陽性のみ) オシメルチニブ |
80 mg/日 | 1日1回 | |
| ALK遺伝子転座陽性例 | クリゾチニブ | 500 mg/日 | 1日2回 |
| アレクチニブ | 600 mg/日 | 1日2回 | |
| セリチニブ | 750 mg/日 | 1日1回 | |
| ROS1遺伝子転座陽性例 | クリゾチニブ | 500 mg/日 | 1日2回 |
| BRAF遺伝子変異陽性例 | ダブラフェニブ トラメチニブ |
300 mg/日 2 mg/日 |
1日2回 1日1回 |
PD-L1≧50%
| ペムブロリズマブ | 200 mg/body,day 1 | q3w |
すべてのサブグループ
CDDPレジメン
| CDDP | 75 mg/m2,day 1 | q3w |
| PEM | 500 mg/m2,day 1 | |
4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
| ※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,本剤の投与を中止または終了する場合には,本剤最終投与日から22日目まで可能なかぎり葉酸を投与する。 ②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,本剤投与期間中および投与中止後22日目まで9週ごと(3コースごと)に1回投与する。 |
||
| CDDP | 80 mg/m2,day 1 | q3w |
| DTX | 60 mg/m2,day 1 | |
| CDDP | 80 mg/m2,day 1 | q3w |
| GEM | 1000 mg/m2,day 1,8 | |
| CDDP | 80 mg/m2,day 1 | q3w |
| VNR | 25 mg/m2,day 1,8 | |
| CDDP | 80 mg/m2,day 1 | q4w |
| CPT-11 | 60 mg/m2,day 1,8,15 | |
| CDDP | 60 mg/m2,day 8 | q4-5w |
| S-1 | 40 mg/m2,1日2回,day 1-21 | |
CBDCAレジメン
| CBDCA | (AUC=6),day 1 | q3w |
| PTX | 200 mg/m2,day 1 | |
PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う |
||
| CBDCA | (AUC=5),day 1 | q3w |
| GEM | 1000 mg/m2,day 1,8 | |
| CBDCA | (AUC=5),day 1 | q3w |
| S-1 | 40 mg/m2,1日2回,day 1-14 | |
| CBDCA | (AUC=6),day 1 | q3w |
| nab-PTX | 100 mg/m2,day 1,8,15 | |
| CBDCA | (AUC=5-6),day 1 | q3w |
| PEM | 500 mg/m2,day 1 | |
4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
- 増悪しなければ上記を6コース以内で繰り返す。
- 維持療法を行う場合はプラチナ製剤併用を4コースで終了し,病勢増悪を認めず,毒性が忍容可能な場合に(プラチナ製剤を含まない)単剤療法に移行する。
ネダプラチンレジメン
| ネダプラチン | 100 mg/m2,day 1 | q3w |
| DTX | 60 mg/m2,day 1 |
| ベバシズマブ併用※ | CBDCA | (AUC=6),day 1 | q3w |
|---|---|---|---|
| PTX | 200mg/m2,day 1 | ||
| ベバシズマブ | 15mg/kg,day 1 | ||
| PTX投与30分前までにデキサメタゾン,H1,H2 blockerの前投薬を行う | |||
| ラムシルマブ併用 | DTX | 60mg/m2,day 1 | q3w |
| ラムシルマブ | 10mg/kg,day 1 | ||
- ※ベバシズマブ併用に際して
- 増悪しなければ上記を6コース以内で繰り返す。
- ベバシズマブについてはプラチナ製剤併用療法の終了後,病勢増悪もしくは毒性中止まで単剤投与を継続する。
| 免疫チェックポイント阻害剤 | (PD-L1≧1%のみ) ペムブロリズマブ |
200 mg/body,day 1 | q3w |
|---|---|---|---|
| ニボルマブ | 3 mg/kg,day 1 | q2w | |
| 細胞障害性抗癌剤 | DTX | 60 mg/m2,day 1 | q3w |
| PEM | 500 mg/m2,day 1 | q3w | |
| S-1 | 80-120 mg/body,1日2回,day 1-28 | q6w | |
| GEM | 1000 mg/m2,day 1,8,15 | q4w | |
| VNR | 25 mg/m2,day 1,8 | q3w |
※PEM の投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,本剤の投与を中止または終了する場合には,本剤最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,本剤投与期間中および投与中止後22日目まで9週ごと(3コースごと)に1回投与する。