7
Ⅱ.非小細胞肺癌(NSCLC)
本文中に用いた略語および用語の解説
| BLM | ブレオマイシン | |
|---|---|---|
| CBDCA | カルボプラチン | |
| CDDP | シスプラチン | |
| DOXY | ドキシサイクリン | |
| ETP | エトポシド | |
| MINO | ミノサイクリン | |
| MMC | マイトマイシンC | |
| OK-432 | ピシバニール | |
| PEM | ペメトレキセド | |
| PTX | パクリタキセル | |
| Talc | タルク | |
| TC | テトラサイクリン | |
| BP製剤 | ビスフォスフォネート製剤 | |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
| BSC | best supportive care | 緩和治療,ベストサポーティブケア |
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| HR | hazard ratio | ハザード比 |
| OS | overall survival | 全生存期間 |
| PS | performance status | 一般状態 |
| QOL | quality of life | 生活の質 |
| RR | relative risk | 相対危険度 |
| SRE | skeletal related event | 骨関連事象 |
| STI | stereotactic irradiation | 定位放射線照射 |
| 以下の2つに分けられる | ||
| SRS | stereotactic radiosurgery | 定位手術的照射:1回照射 |
| SRT | stereotactic radiotherapy | 定位放射線治療:分割照射 |
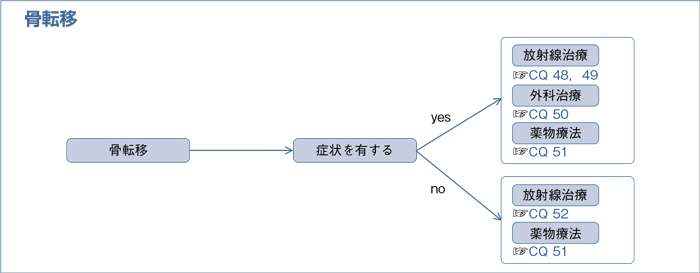
7-1.骨転移
文献検索と採択

樹形図
- 推 奨
- 放射線治療を行うよう勧められる。(1A)
未治療の骨転移合併非小細胞肺癌では,可能なら全身治療としての薬物療法を導入すべきであるが,症状を有する,または病的骨折の危険性が高い,または脊椎転移が脊髄圧迫を生じている場合は放射線治療が優先されることがある。
16のランダム化試験のメタアナリシス2)によると,放射線治療による痛みの改善は50~80%と高率に得られ,有害事象の頻度も少なかった(病的骨折2.8~3.2%,脊髄圧迫1.9~2.8%)。以上より,放射線治療によって高い局所制御率と臨床的有効性がメタアナリシスにて確認されている。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。
a.分割照射は勧められるか?
b.単回照射は勧められるか?
- 推 奨
a.分割照射を行うよう推奨する。(1A)
b.単回照射を行うよう提案する。(2A)
以上より,骨転移に対する標準的な照射方法としては,20 Gy/5回,30 Gy/10回などの分割照射が勧められる。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。一方,期待生存期間3カ月以内,連日の治療が困難,原腫瘍が増悪しているなど症例によっては単回照射が選択肢と考えられる。エビデンスレベルはA,また総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Aとした。
なお,PS良好で原疾患が制御されている孤立性転移など長期予後が期待される患者に限れば高線量の放射線治療も考慮される4)。
- 推 奨
- 外科治療を行うよう提案する。(2C)
以上より,脊椎転移が脊髄圧迫を生じている骨転移に対する外科治療は少数の比較試験で有効性が示唆されているものの,相反する報告も存在している。エビデンスレベルはC,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。
- 推 奨
- 骨修飾薬(ゾレドロン酸またはデノスマブ)を推奨する。(1B)
乳癌,前立腺癌を除く,進行癌と多発性骨髄腫患者(非小細胞肺癌40%)を対象に,デノスマブとゾレドロン酸を,SRE発症までの期間で比較した第Ⅲ相試験が行われた。初回SRE発症までの期間は,デノスマブ群20.6カ月,ゾレドロン酸群16.3カ月で,非劣性が証明されたが,優越性は証明されなかった。一方で,疼痛スコアの増悪や骨病変に対する放射線治療のリスクは,デノスマブ群が有意に少なかった8)9)。
以上より,骨転移を有する症例では,SREの発現率の軽減とSRE発現までの期間を延長させることが複数の研究で示されているため,ゾレドロン酸またはデノスマブの投与は勧められる。エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。
BP製剤とデノスマブの重要な有害事象に顎骨壊死と腎機能障害が報告されている。顎骨壊死のリスク因子は,直近の歯科的処置やBP製剤の36カ月以上の長期投与が挙げられている10)。そのため,日常診療におけるBP製剤の長期使用では,顎骨壊死は十分に注意すべき有害事象である。デノスマブとゾレドロン酸の比較試験の統合解析では,両薬剤で,顎骨壊死の頻度に有意差を認めず11),デノスマブもBP製剤と同様な対応が必要である(参考資料:http://jsbmr.umin.jp/guide/pdf/bronjpositionpaper2012.pdf)。
BP製剤の腎障害は,BP製剤を使用した症例の4%に報告されている12)。一方,デノスマブは,海外第Ⅲ相試験2)3)において,クレアチニンクリアランス値が30 ml/min未満の重度腎疾患患者および透析の必要な末期腎不全患者は対象から除外されており,慎重投与となっている。
デノスマブで注意すべき有害事象は,低カルシウム(Ca)血症である。低Ca血症の頻度がBP製剤と比較して有意に多いという報告(ゾレドロン酸投与群5.8%,デノスマブ投与群10.8%)があり,予防のためにCa製剤,ビタミンD製剤の内服,定期的な血清Caの測定が推奨されている2)3)。
- 推 奨
- 放射線治療を行うよう勧められる。(1C)
以上より,病的骨折の危険性が高い,または脊椎転移による脊髄圧迫が切迫していると判断される場合には,明らかな神経症状がなくても放射線治療を行うよう勧められる。単群試験やこれまでのコンセンサスによる部分が多いため,エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- 1)Tsuya A, Kurata T, Tamura K, et al. Skeletal metastases in non-small cell lung cancer: a retrospective study. Lung Cancer. 2007; 57(2): 229-32.
- 2)Chow E, Harris K, Fan G, et al. Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol. 2007; 25(11): 1423-36.
- 3)Sande TA, Ruenes R, Lund JA, et al. Long-term follow-up of cancer patients receiving radiotherapy for bone metastases: results from a randomised multicentre trial. Radiother Oncol. 2009; 91(2): 261-6.
- 4)Milano MT, Katz AW, Muhs AG, et al. A prospective pilot study of curative-intent stereotactic body radiation therapy in patients with 5 or fewer oligometastatic lesions. Cancer. 2008; 112(3): 650-8.
- 5)Patchell RA, Tibbs PA, Regine WF, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial. Lancet. 2005; 366(9486): 643-8.
- 6)Rades D, Huttenlocher S, Dunst J, et al. Matched pair analysis comparing surgery followed by radiotherapy and radiotherapy alone for metastatic spinal cord compression. J Clin Oncol. 2010; 28(22): 3597-604.
- 7)Rosen LS, Gordon D, Tchekmedyian NS, et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial. Cancer. 2004; 100(12): 2613-21.
- 8)Henry DH, Costa L, Goldwasser F, et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer(excluding breast and prostate cancer)or multiple myeloma. J Clin Oncol. 2011; 29(9): 1125-32.
- 9)Vadhan-Raj S, von Moos R, Fallowfield LJ, et al. Clinical benefit in patients with metastatic bone disease: results of a phase 3 study of denosumab versus zoledronic acid. Ann Oncol. 2012; 23(12): 3045-51.
- 10)Migliorati CA, Siegel MA, Elting LS. Bisphosphonate-associated osteonecrosis: a long-term complication of bisphosphonate treatment. Lancet Oncol. 2006; 7(6): 508-14.
- 11)Saad F, Brown JE, Van Poznak C, et al. Incidence, risk factors, and outcomes of osteonecrosis of the jaw: integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases. Ann Oncol. 2012; 23(5): 1341-7.
- 12)Bonomi M, Nortilli R, Molino A, et al. Renal toxicity and osteonecrosis of the jaw in cancer patients treated with bisphosphonates: a long-term retrospective analysis. Med Oncol. 2010; 27(2): 224-9.
- 13)Harrington KD. New trends in the management of lower extremity metastases. Clin Orthop Relat Res. 1982;(169): 53-61.
- 14)Maranzano E, Latini P. Effectiveness of radiation therapy without surgery in metastatic spinal cord compression: final results from a prospective trial. Int J Radiat Oncol Biol Phys. 1995; 32(4): 959-67.
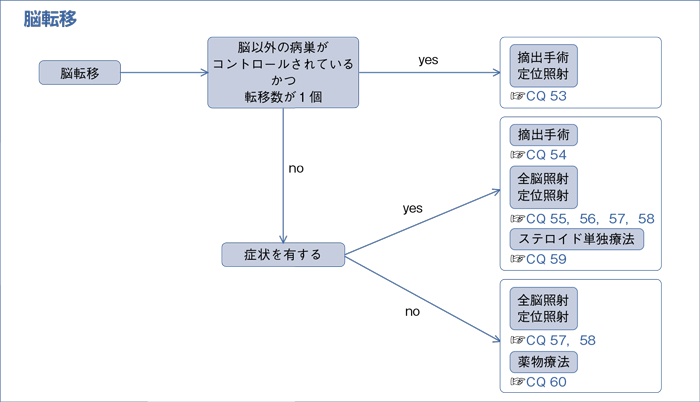
7-2.脳転移
文献検索と採択

樹形図
- 推 奨
- 脳以外の病巣がコントロールされており,かつ単発の脳転移に対して,定位手術的照射*や外科治療を行うよう推奨する。(1C)
*定位放射線照射(STI)は,線量分割の違いにより,1回照射の場合を定位手術的照射(SRS),分割照射の場合を定位放射線治療(SRT)と定義されている。ガンマナイフはSRSに含まれる。脳幹など重要組織が近接している場合や大きい腫瘍にはSRTで治療を行うことがある。
以上より,脳以外の病巣がコントロールされており,かつ単発の脳転移に対して,SRSや外科治療を行う妥当性はあると考えられる。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- 推 奨
- 症状を有する単発性脳転移に対して,外科治療を行うよう提案する。(2C)
- 推 奨
- 症状を有する脳転移に対して,放射線治療は行うよう勧められる。(1C)
- 推 奨
- 癌性髄膜炎に対して,放射線治療を行うよう勧める根拠は明確でない。(推奨なし)
- 推 奨
a.多発性脳転移に対して,全脳照射を行うよう勧められる。(1C)
b.4個以下で腫瘍径3 cm程度までであればSRS*が勧められる。(1C)
c.5~10個の脳転移に対するSRS*を行うだけの根拠が明確でない。(推奨なし)
*定位放射線照射(STI)は,線量分割の違いにより,1回照射の場合を定位手術的照射(SRS),分割照射の場合を定位放射線治療(SRT)と定義されている。ガンマナイフはSRSに含まれる。脳幹など重要組織が近接している場合や大きい腫瘍にはSRTで治療を行うことがある。
- a・b.
- 従来,多発性脳転移に対しては全脳照射が行われてきた。前向き試験ではその生存期間中央値は3.5~7.5カ月程度であり,頭蓋内無増悪期間は中央値約6カ月程度と報告されている6)~10)。
4個以下,3 cm程度の脳転移に対してはSRSのエビデンスも蓄積されており,前向き試験のデータでは生存期間中央値は約8~15カ月,照射1年後の局所コントロール率は4~9割程度と報告されている11)12)。
脳腫瘍に対する放射線照射の有害事象として治療後のQOLの低下が問題となることがある。手術やSRSに全脳照射を追加することで,活動性の低下や認知機能障害が生じることを示す報告13)がある一方で,評価の方法や時期の違いの影響から差がなかったとする報告もある11)。一方,全脳照射を省くことで脳内再発によって認知機能の悪化がみられることがある。
以上より,多発性脳転移に対する全脳照射,4個以下で腫瘍径3 cm程度までに対するSRSは複数の前向き試験でその有効性が示唆されている。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。 - c.
- 5個以上の脳転移に対するSRSの有効性については,前向き観察研究で5~10個の脳転移と2~4個の脳転移に対する治療成績の比較によって,生存率に差がなかったとする結果が本邦から報告されており,有害事象の出現率にも差を認めなかった(9% vs 9%,P=0.89)14)。ただし,本研究の適格基準として最大経3 cm未満,最大腫瘍体積10 ml 未満,合計体積15 ml などが挙げられており,この結果を適応できる患者は限られる可能性がある。現在,海外で5個以上の脳転移に対するSRSと全脳照射のランダム化比較試験が行われており,多発脳病変に対するSRSの適応については今後の検討課題であり,現時点で推奨するだけの根拠は明確でなく,推奨なしとした。
- 推 奨
- 手術,SRSに全脳照射の併用を行わないことを勧める。(1A)
4個以下の脳転移に対するSRSと,SRS+全脳照射との併用療法を比較した試験は複数あり,ランダム化比較試験のメタアナリシスで局所制御率については併用群で有意に良好であった(HR 2.61,95%CI:1.68-4.06,P<0.0001)が,OSに有意差を認めなかった(HR 0.98,95%CI:0.71-1.35,P=0.88)15)。認知機能に関しては1つのランダム化比較試験ではSRS群とSRS+全脳照射群間でMini Mental State Examinationの結果に有意差は認められなかったが11),もう1つのランダム化比較試験ではHopkins Verbal Learning Test-Revisedを用いて評価を行ったところ,記憶学習能力が併用群で有意に低下したため早期中止となっている12)。
また,手術もしくはSRSを行った患者に対して全脳照射の追加を検討したランダム化比較試験において,全脳照射併用群は健康関連QOLが悪い傾向にあった13)。
以上より,4個以下の脳転移に対する手術やSRSに全脳照射の追加は,局所制御には有効であると考えられるが生存には寄与せず,認知機能低下などの有害事象も懸念されることが複数の臨床試験で示されている。エビデンスレベルはA,また総合的評価では行わないよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。
- 推 奨
- 症状を有する脳転移に対して,予後不良と考えられる場合はステロイド単独治療も勧められる。(1B)
以上から,症状を有する脳転移に対して,予後不良と考えられる場合はステロイド単独治療も勧められる。エビデンスレベルはB,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Bとした。
- 推 奨
- 薬物療法は有効であり,行うよう勧められる。(1C)
よって,無症候性脳転移に対して薬物療法・放射線治療のどちらを先行させるかという重要なクリニカルクエスチョンが生じるが,現時点で明確なエビデンスは乏しいことから,脳転移巣のサイズ・個数・部位,医療状況などをもとに放射線腫瘍医と十分検討のうえで判断されるべきである。
なお,これまで本ガイドラインでは無症候性脳転移に対する薬物療法の有効性に関する言及がなかったため,今回本CQでその意義について遺伝子変異の有無に分けて検討した(放射線治療に関しては,☞CQ57を参照すること)。
<遺伝子変異陽性例>
以上より,遺伝子変異を有する無症候性脳転移症例に対する分子標的治療薬については,いずれも単群第Ⅱ相試験や第Ⅲ相試験のサブセットで症例数は少ないものの,高い有効性を示唆するデータが複数報告されており,推奨グレードは1Cとした。
<遺伝子変異陰性または不明の場合>
以上より,遺伝子変異を有さないまたは不明の無症候性脳転移に対する細胞障害性抗癌剤については,有効性を示唆するデータが複数報告されているものの,いずれも単群第Ⅱ相試験の結果である。エビデンスレベルはC,ただし総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Cとした。
- 1)Muacevic A, Wowra B, Siefert A, et al. Microsurgery plus whole brain irradiation versus Gamma Knife surgery alone for treatment of single metastases to the brain: a randomized controlled multicentre phase III trial. J Neurooncol. 2008; 87(3): 299-307.
- 2)Patchell RA, Tibbs PA, Regine WF, et al. Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA. 1998; 280(17): 1485-9.
- 3)Ashworth A, Rodrigues G, Boldt G, et al. Is there an oligometastatic state in non-small cell lung cancer? A systematic review of the literature. Lung Cancer. 2013; 82(2): 197-203.
- 4)Borgelt B, Gelber R, Kramer S, et al. The palliation of brain metastases: final results of the first two studies by the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 1980; 6(1): 1-9.
- 5)Morris PG, Reiner AS, Szenberg OR, et al. Leptomeningeal metastasis from non-small cell lung cancer: survival and the impact of whole brain radiotherapy. J Thorac Oncol. 2012; 7(2): 382-5.
- 6)Patchell RA, Tibbs PA, Walsh JW, et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med. 1990; 322(8): 494-500.
- 7)Mintz AH, Kestle J, Rathbone MP, et al. A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer. 1996; 78(7): 1470-6.
- 8)Kondziolka D, Patel A, Lunsford LD, et al. Stereotactic radiosurgery plus whole brain radiotherapy versus radiotherapy alone for patients with multiple brain metastases. Int J Radiat Oncol Biol Phys. 1999; 45(2): 427-34.
- 9)Noordijk EM, Vecht CJ, Haaxma-Reiche H, et al. The choice of treatment of single brain metastasis should be based on extracranial tumor activity and age. Int J Radiat Oncol Biol Phys. 1994; 29(4): 711-7.
- 10)Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet. 2004; 363(9422): 1665-72.
- 11)Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA. 2006; 295(21): 2483-91.
- 12)Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol. 2009; 10(11): 1037-44.
- 13)Soffietti R, Kocher M, Abacioglu UM, et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery: quality-of-life results. J Clin Oncol. 2013; 31(1): 65-72.
- 14)Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases(JLGK0901): a multi-institutional prospective observational study. Lancet Oncol. 2014; 15(4): 387-95.
- 15)Tsao M, Xu W, Sahgal A. A meta-analysis evaluating stereotactic radiosurgery, whole-brain radiotherapy, or both for patients presenting with a limited number of brain metastases. Cancer. 2012; 118(9): 2486-93.
- 16)Mulvenna P, Nankivell M, Barton R, et al. Dexamethasone and supportive care with or without whole brain radiotherapy in treating patients with non-small cell lung cancer with brain metastases unsuitable for resection or stereotactic radiotherapy(QUARTZ): results from a phase 3, non-inferiority, randomised trial. Lancet. 2016; 388(10055): 2004-2014.
- 17)Iuchi T, Shingyoji M, Sakaida T, et al. Phase II trial of gefitinib alone without radiation therapy for Japanese patients with brain metastases from EGFR-mutant lung adenocarcinoma. Lung Cancer. 2013; 82(2): 282-7.
- 18)Park SJ, Kim HT, Lee DH, et al. Efficacy of epidermal growth factor receptor tyrosine kinase inhibitors for brain metastasis in non-small cell lung cancer patients harboring either exon 19 or 21 mutation. Lung Cancer. 2012; 77(3): 556-60.
- 19)Schuler M, Wu YL, Hirsh V, et al. First-Line Afatinib versus Chemotherapy in Patients with Non-Small Cell Lung Cancer and Common Epidermal Growth Factor Receptor Gene Mutations and Brain Metastases. J Thorac Oncol. 2016; 11(3): 380-90.
- 20)Costa DB, Shaw AT, Ou SH, et al. Clinical Experience With Crizotinib in Patients With Advanced ALK-Rearranged Non-Small-Cell Lung Cancer and Brain Metastases. J Clin Oncol. 2015; 33(17): 1881-8.
- 21)Nokihara H, Hida T, Kondo M, et al. Alectinib(ALC)versus crizotinib(CRZ)in ALK-inhibitor naive ALK-positive non-small cell lung cancer(ALK+NSCLC): Primary results from the J-ALEX study. J Clin Oncol. 2016; 34(suppl; abstr 9008).
- 22)Barlesi F, Gervais R, Lena H, et al. Pemetrexed and cisplatin as first-line chemotherapy for advanced non-small-cell lung cancer(NSCLC)with asymptomatic inoperable brain metastases: a multicenter phase II trial(GFPC 07-01). Ann Oncol. 2011; 22(11): 2466-70.
- 23)Besse B, Le Moulec S, Mazières J, et al. Bevacizumab in Patients with Nonsquamous Non-Small Cell Lung Cancer and Asymptomatic, Untreated Brain Metastases(BRAIN): A Nonrandomized, Phase II Study. Clin Cancer Res. 2015; 21(8): 1896-903.
7-3.胸部病変に対する緩和的放射線治療
文献検索と採択

- 推 奨
- 放射線治療を行うよう勧められる。(1A)
- 1)Fairchild A, Harris K, Barnes E, et al. Palliative thoracic radiotherapy for lung cancer: a systematic review. J Clin Oncol. 2008; 26(24): 4001-11. (II)
- 2)Ma JT, Zheng JH, Han CB, et al. Meta-analysis comparing higher and lower dose radiotherapy for palliation in locally advanced lung cancer. Cancer Sci. 2014; 105(8): 1015-22. (I)
7-4.癌性胸膜炎
文献検索と採択

- 推 奨
a.胸膜癒着術を行うよう推奨する。(1A)
b.薬物療法未治療例には,胸膜癒着術の代わりに薬物療法を行うよう提案する。(2C)
- a.
- 胸膜癒着術の使用薬剤としては抗菌薬(TC,DOXY,MINOなど),抗癌剤(BLM,CDDPなど),鉱物(Talc),溶連菌製剤(OK-432)などが報告されている。
本邦でTalcが承認される前に行われたBLM,OK-432,CDDP+ETP(PE)胸腔内投与のランダム化第Ⅱ相試験では,4週間後の胸水コントロール率は,BLM(68.6%),OK-432(75.8%),PE(70.6%)であった。PEでは消化器毒性の頻度が多く,治療効果に有意差は認めなかったものの胸水コントロール率の高いOK-432が汎用される根拠となった1)。
各薬剤を比較したメタアナリシスでは,Talc噴霧法による胸水制御が良好で,BLM,DOXY,TCなどより優れていた2)。Talc噴霧法とTalc懸濁法を比較した第Ⅲ相試験では,78%と71%で胸水制御が得られ,有意差は認めなかった3)。重篤な副作用として急性呼吸促迫症候群があるが,粒子径の大きいもの(平均24.5μm)では低頻度であった(558例中0例)4)。よって,2013年に本邦でもTalc懸濁法が承認されてから,胸水制御のエビデンスのあるTalcが汎用されるようになった。胸腔ドレナージ後の胸膜癒着術は,ドレナージ単独より胸水コントロール率に優れていることがエビデンスレベルの高い研究で示されている。エビデンスレベルはA,また総合的評価では行うよう強く推奨(1で推奨)できると判断し,推奨度は1Aとした。 - b.
- 分子標的治療薬による胸水制御を前向きに検討した報告はなかったが,日常臨床において,遺伝子変異例では,胸水に対しても分子標的治療薬が有効であることはしばしば経験される。一方,胸水に対して胸膜癒着術を行わずに,細胞障害性抗癌剤の投与を行うことが有効であると示した報告が2つある。CBDCA+PEM+ベバシズマブ療法を行った第Ⅱ相試験では,28例の胸水コントロール率は92.9%で5),CBDCA+PTX+ベバシズマブ療法を行った第Ⅱ相試験では,23例の胸水コントロール率は86.9%であった6)。前者では貧血(CTCAE Grade 3以上)が25%,後者では発熱性好中球減少症が26.1%で報告され,POINTBREAK試験やECOG4599試験より有害事象の頻度が高い傾向にあった。
胸膜癒着術を行わずに全身薬物療法を導入することで,長期の持続ドレナージに伴うPSの増悪や全身薬物療法導入時期の遅れを回避できる可能性がある。一方で,前述の報告は遺伝子変異陽性例や扁平上皮癌を対象としておらず,限られた患者集団およびレジメンでの単群の第Ⅱ相試験であり,十分なエビデンスがあるとは言い難い。エビデンスレベルはC,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。
- 1)Yoshida K, Sugiura T, Takifuji N, et al. Randomized phase II trial of three intrapleural therapy regimens for the management of malignant pleural effusion in previously untreated non-small cell lung cancer: JCOG 9515. Lung Cancer. 2007;58(3):362-8.
- 2)Clive AO, Jones HE, Bhatnagar R, et al. Interventions for the management of malignant pleural effusions: a network meta-analysis. Cochrane Database Syst Rev. 2016;(5):CD010529.
- 3)Dresler CM, Olak J, Herndon JE 2nd, et al. Phase III intergroup study of talc poudrage vs talc slurry sclerosis for malignant pleural effusion. Chest. 2005;127(3):909-15.
- 4)Janssen JP, Collier G, Astoul P, et al. Safety of pleurodesis with talc poudrage in malignant pleural effusion: a prospective cohort study. Lancet. 2007;369(9572):1535-9.
- 5)Usui K, Sugawara S, Nishitsuji M, et al. A phase II study of bevacizumab with carboplatin-pemetrexed in non-squamous non-small cell lung carcinoma patients with malignant pleural effusions: North East Japan Study Group Trial NEJ013A. Lung Cancer. 2016;99:131-6.
- 6)Tamiya M, Tamiya A, Yamadori T, et al. Phase2 study of bevacizumab with carboplatin-paclitaxel for non-small cell lung cancer with malignant pleural effusion. Med Oncol. 2013;30(3):676.
7-5.癌性心膜炎
文献検索と採択

- 推 奨
- 心膜癒着術を行うよう提案する。(2C)
なお,血行動態が不安定な場合は心膜開窓術などの手術も治療選択肢であるが,心囊水制御について前向きに検討した文献はなく,各施設の医療状況や経験をもとに判断されるべきである。
対象集団が少ないことからランダム化試験が施行しにくく,十分なエビデンスがないものの,短期の症状緩和に関する益と害のバランスを考慮した場合,心囊ドレナージ後の心膜癒着術を考慮してよいと考えられる。エビデンスレベルはC,ただし総合的評価では行うよう弱く推奨(2で推奨)できると判断し,推奨度は2Cとした。
- 1)Kunitoh H, Tamura T, Shibata T, et al. A randomised trial of intrapericardial bleomycin for malignant pericardial effusion with lung cancer(JCOG9811). Br J Cancer. 2009; 100(3): 464-9.
- 2)Maruyama R, Yokoyama H, Seto T, et al. Catheter drainage followed by the instillation of bleomycin to manage malignant pericardial effusion in non-small cell lung cancer: a multi-institutional phase II trial. J Thorac Oncol. 2007; 2(1): 65-8.
- 3)Kaira K, Takise A, Kobayashi G, et al. Management of malignant pericardial effusion with instillation of mitomycin C in non-small cell lung cancer. Jpn J Clin Oncol. 2005; 35(2): 57-60.
- 4)Moriya T, Takiguchi Y, Tabeta H, et al. Controlling malignant pericardial effusion by intrapericardial carboplatin administration in patients with primary non-small-cell lung cancer. Br J Cancer. 2000; 83(7): 858-62.
レジメン:転移など各病態に対する治療
転移性骨腫瘍
| 緩和的放射線治療 | 30 Gy/10回(2週),20 Gy/5回(1週),8 Gy/1回(1日)など | ||
|---|---|---|---|
| 薬物療法 | ゾレドロン酸4 mg | 3~4週毎投与 | |
| デノスマブ120 mg | 4週毎投与 | ||
| Ca製剤 | 500 mg/日 | 連日投与 | |
| 天然型ビタミンD | 400 IU/日 | 連日投与 | |
| (デノスマブ使用においては,高Ca血症を認めないかぎり,低Ca血症予防のためCa製剤とビタミンD製剤の補充を推奨) | |||
転移性脳腫瘍
| 緩和的放射線治療 (全脳照射) |
30 Gy/10回(2週),37.5 Gy/15回(3週),40 Gy/20回(4週)など |
|---|
胸部病変
| 緩和的放射線治療 | 30 Gy/10回(2週),37.5 Gy/15回(3週),40 Gy/20回(4週)など |
|---|