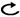3
Ⅰ.診 断
- *病理診断の推奨グレードについて
- 病理・細胞診断では,診断方法や鑑別診断等を記載することとし,推奨グレードは示していない。
- *エビデンスについて
- 3-1~3-2の各項目のエビデンスは,日本肺癌学会編「悪性胸膜中皮腫病理診断の手引き」(日本肺癌学会ホームページに掲載中)を参考にして頂きたい(https://www.haigan.gr.jp/uploads/photos/647.pdf)。
文献検索と採択

樹形図
- 推 奨
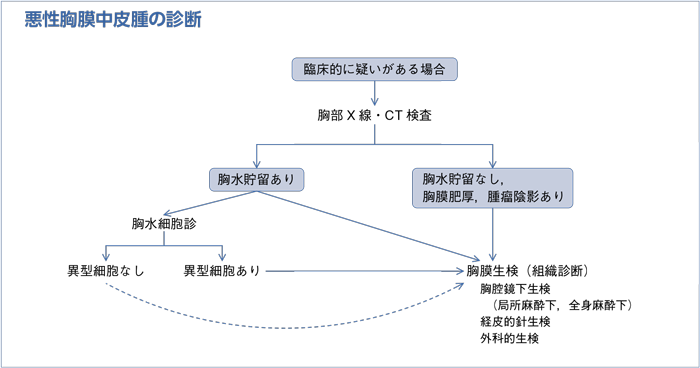
a.Papanicolaou染色,Giemsa染色,PAS染色などの通常の染色を行った胸水細胞診標本だけで中皮腫の診断を付けることは勧められない。
b.中皮腫と反応性中皮過形成の鑑別には,セルブロックを含む細胞診標本で免疫染色(核におけるBAP1の消失の検出など),FISH(p16のホモ接合性欠失の検出)などを検討することが勧められる。中皮腫と癌腫の鑑別には,セルブロックを含む細胞診標本で中皮腫の場合に陽性となる抗体2抗体以上が陽性で,陰性となる抗体2抗体以上が陰性であることを確認することが勧められる。
c.細胞診で中皮腫が疑われる場合は,組織学的検査を行うことが勧められる。分子生物学的手法などを用いれば細胞診のみにても中皮腫の確定診断が可能な場合があるが,経験豊富な専門家に意見を聞くことが勧められる。
- 推 奨
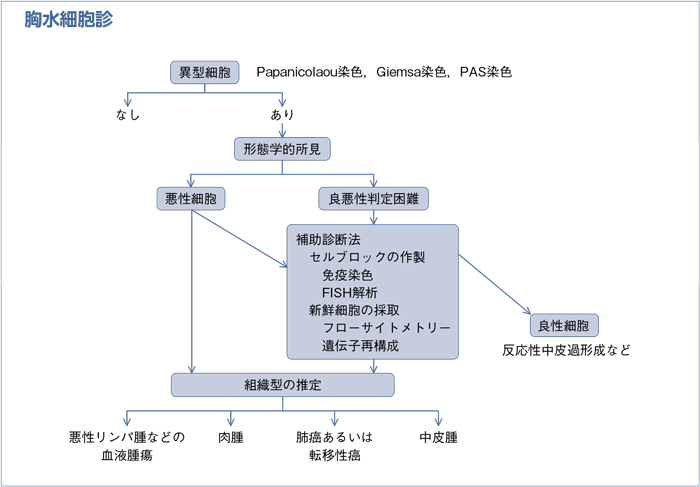
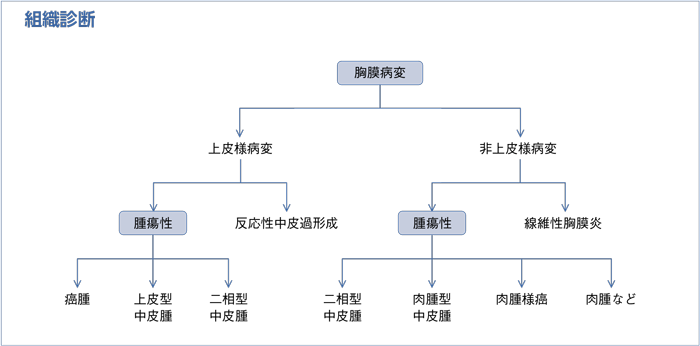
a.深部脂肪組織を含めた十分な胸膜検体のもとに病理診断を行うことが勧められる。
b.病理診断には組織型〔上皮型,肉腫型(線維形成型を含む),二相型〕(表1)を記載することが勧められる。
c.中皮腫の診断には常に免疫染色を行うことが勧められる。
d.診断が困難な場合は,経験豊富な専門家に意見を聞くことが勧められる。
- 推 奨
- 上皮型中皮腫の診断に際しては,中皮腫の場合に陽性となる抗体および陰性となる抗体をそれぞれ2抗体以上確認することが勧められる(表2)。
- 推 奨
a.上皮型中皮腫と反応性中皮過形成の鑑別には,間質あるいは深部脂肪組織への浸潤所見を評価することが勧められる(表3)。
b.上皮型中皮腫と反応性中皮過形成の鑑別に有用な抗体(Desmin,EMAなど)は存在するが,その結果のみで診断することは勧められない(表3)。
c.上皮型中皮腫と反応性中皮過形成の鑑別にfluorescence in situ hybridization(FISH)法によるp16遺伝子欠失の解析は有用であるが,手技に精通した施設で行うことが勧められる(表3)。
- 推 奨
a.肉腫型中皮腫と肉腫との鑑別には,中皮腫で陽性となるcytokeratin(CAM5.2,AE1/AE3)の発現を検討することが勧められる。
b.肉腫型中皮腫と肺の肉腫様癌との鑑別に有用な抗体は存在するが,その結果のみで診断することは勧められない。
- 推 奨
- 中皮腫と滑膜肉腫の鑑別が困難な場合は,t(X;18)(p11;q11)によって形成されるSS18-SSX融合遺伝子の有無を検討することが勧められる。
- 推 奨
- 線維形成型中皮腫と線維性胸膜炎の鑑別には,浸潤性増殖,壊死,明らかな肉腫様成分,転移巣の存在を評価することが勧められる(表4)。
| 組織型 | 鑑別すべき疾患 |
|---|---|
| 上皮型中皮腫 | 原発性肺癌 胸膜への転移・浸潤性腫瘍 反応性中皮過形成 |
| 肉腫型中皮腫 線維形成型中皮腫 |
胸壁,胸膜,肺由来の肉腫 肉腫様癌 線維性胸膜炎 |
| 二相型中皮腫 | 二相型滑膜肉腫 癌肉腫 肺芽腫 |
| 陽性抗体 | 陰性抗体 |
|---|---|
| calretinin Wilms’ tumor 1(WT1) D2-40(Podoplanin) |
carcinoembryonic antigen(CEA) thyroid transcription factor-1(TTF-1) Napsin A surfactant apoprotein A estrogen receptor(ER) p63 p40 claudin 4 MOC-31 BerEP4 |
| 上皮型中皮腫 | 反応性中皮過形成 | |
|---|---|---|
| 間質浸潤,深部脂肪組織浸潤 | 通常あり | なし |
| 細胞密度 | 高い | 高いこともある(表層) |
| 乳頭状構造 | 複雑,多層性 | 単純,単層性 |
| 炎症 | 少ない | 通常あり |
| Desmin | 陰性 | 陽性 |
| EMA | 細胞膜に陽性 | 陰性 |
| BAP11 | 核に陰性 | 核に陽性 |
| p16遺伝子欠失2 | あり | なし |
1反応性中皮過形成では核にBAP1が陽性であり,核にBAP1が陰性である場合は中皮腫の可能性が高い。しかし,核にBAP1が陽性の中皮腫もあるので注意が必要である。
2FISH解析による。反応性中皮過形成ではp16遺伝子欠失はみられず,p16遺伝子欠失がある場合は中皮腫と考えられる。しかし,p16遺伝子欠失がみられない中皮腫もあるので注意が必要である。
| 線維形成性中皮腫 | 線維性胸膜炎 | |
|---|---|---|
| Storiform pattern | 目立つ | 目立たない |
| 壊死 | あり(散在) | なし(あっても糜爛) |
| 発育 | 不均一な厚み,浸潤性増殖 expansile nodule 細胞密度の異なる部分が混在 |
均一な厚み |
| 肉腫様成分 | あり | なし |
| Zonation1 | なし | あり |
| 毛細血管 | 血管は少なく,向きは不規則 | 垂直に走行 |
1胸膜の胸腔側で細胞密度が高く,胸壁側の深部にいくにつれて細胞密度が低くなる所見。
- 1)Hjerpe A, Ascoli V, Bedrossian CW, et al; International Mesothelioma Interest Group; International Academy of Cytology; Papanicolaou Society of Cytopathology. Guidelines for the cytopathologic diagnosis of epithelioid and mixed-type malignant mesothelioma. Complementary statement from the International Mesothelioma Interest Group, also endorsed by the International Academy of Cytology and the Papanicolaou Society of Cytopathology. Acta Cytol. 2015; 59(1): 2-16.
- 2)Hjerpe A, Dobra K. Comments on the recently published“Guidelines for the cytopathologic diagnosis of epithelioid and mixed-type malignant mesothelioma”. Cancer Cytopathol. 2015; 123(8): 449-53.
- 3)Hasteh F, Lin GY, Weidner N, et al. The use of immunohistochemistry to distinguish reactive mesothelial cells from malignant mesothelioma in cytologic effusions. Cancer Cytopathol. 2010; 118(2): 90-6.
- 4)Su XY, Li GD, Liu WP, et al. Cytological differential diagnosis among adenocarcinoma, epithelial mesothelioma, and reactive mesothelial cells in serous effusions by immunocytochemistry. Diagn Cytopathol. 2011; 39(12): 900-8.
- 5)Matsumoto S, Nabeshima K, Kamei T, et al. Morphology of 9p21 homozygous deletion-positive pleural mesothelioma cells analyzed using fluorescence in situ hybridization and virtual microscope system in effusion cytology. Cancer Cytopathol. 2013; 121(8): 415-22.
- 6)Hida T, Matsumoto S, Hamasaki M, et al. Deletion status of p16 in effusion smear preparation correlates with that of underlying malignant pleural mesothelioma tissue. Cancer Sci. 2015; 106(11): 1635-41.
- 7)Hwang HC, Sheffield BS, Rodriguez S, et al. Utility of BAP1 Immunohistochemistry and p16(CDKN2A)FISH in the Diagnosis of Malignant Mesothelioma in Effusion Cytology Specimens. Am J Surg Pathol. 2016; 40(1): 120-6.
- 8)Churg A, Cagle PT, Roggli VL. Tumors of the Serosal Membranes. AFIP Atlas of tumor pathology Series 4, vol. 3. American Registry of Pathology in collaboration with the Armed Forces Institute of Pathology, Washington, DC, 2006.
- 9)Takeshima Y, Inai K, Amatya VJ, et al. Accuracy of pathological diagnosis of mesothelioma cases in Japan: clinicopathological analysis of 382 cases. Lung Cancer. 2009; 66(2): 191-7.
- 10)Scherpereel A, Astoul P, Baas P, et al; European Respiratory Society/European Society of Thoracic Surgeons Task Force. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010; 35(3): 479-95.
- 11)Husain AN, Colby T, Ordonez N, et al; International Mesothelioma Interest Group. Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med. 2013; 137(5): 647-67.
- 12)Travis W, Brambilla E, Burke A, et al. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. 4th ed. International Agency for Research on Cancer, Lyon. 2015.
- 13)Galateau-Salle F, Churg A, Roggli V, et al; World Health Organization Committee for Tumors of the Pleura. The 2015 World Health Organization Classification of Tumors of the Pleura: Advances since the 2004 Classification. J Thorac Oncol. 2016; 11(2): 142-54.
- 14)Ordóñez NG. Application of immunohistochemistry in the diagnosis of epithelioid mesothelioma: a review and update. Hum Pathol. 2013; 44(1): 1-19.
- 15)Bishop JA, Sharma R, Illei PB. Napsin A and thyroid transcription factor-1 expression in carcinomas of the lung, breast, pancreas, colon, kidney, thyroid, and malignant mesothelioma. Hum Pathol. 2010; 41(1): 20-5.
- 16)Ordóñez NG. The diagnostic utility of immunohistochemistry in distinguishing between epithelioid mesotheliomas and squamous carcinomas of the lung: a comparative study. Mod Pathol. 2006; 19(3): 417-28.
- 17)Bishop JA, Teruya-Feldstein J, Westra WH, et al. p40(ΔNp63)is superior to p63 for the diagnosis of pulmonary squamous cell carcinoma. Mod Pathol. 2012; 25(3): 405-15.
- 18)Facchetti F, Lonardi S, Gentili F, et al. Claudin 4 identifies a wide spectrum of epithelial neoplasms and represents a very useful marker for carcinoma versus mesothelioma diagnosis in pleural and peritoneal biopsies and effusions. Virchows Arch. 2007; 451(3): 669-80.
- 19)Ordóñez NG. Value of claudin-4 immunostaining in the diagnosis of mesothelioma. Am J Clin Pathol. 2013; 139(5): 611-9.
- 20)Attanoos RL, Griffin A, Gibbs AR. The use of immunohistochemistry in distinguishing reactive from neoplastic mesothelium. A novel use for desmin and comparative evaluation with epithelial membrane antigen, p53, platelet-derived growth factor-receptor, P-glycoprotein and Bcl-2. Histopathology. 2003; 43(3): 231-8.
- 21)King J, Thatcher N, Pickering C, et al. Sensitivity and specificity of immunohistochemical antibodies used to distinguish between benign and malignant pleural disease: a systematic review of published reports. Histopathology. 2006; 49(6): 561-8.
- 22)Tsukiji H, Takeshima Y, Amatya VJ, et al. Myogenic antigen expression is useful for differentiation between epithelioid mesothelioma and non-neoplastic mesothelial cells. Histopathology. 2010; 56(7): 969-74.
- 23)Illei PB, Rusch VW, Zakowski MF, et al. Homozygous deletion of CDKN2A and codeletion of the methylthioadenosine phosphorylase gene in the majority of pleural mesotheliomas. Clin Cancer Res. 2003; 9(6): 2108-13.
- 24)Takeda M, Kasai T, Enomoto Y, et al. 9p21 deletion in the diagnosis of malignant mesothelioma, using fluorescence in situ hybridization analysis. Pathol Int. 2010; 60(5): 395-9.
- 25)Sheffield BS, Hwang HC, Lee AF, et al. BAP1 immunohistochemistry and p16 FISH to separate benign from malignant esothelial proliferations. Am J Surg Pathol. 2015; 39(7): 977-82.
- 26)Lucas DR, Pass HI, Madan SK, et al. Sarcomatoid mesothelioma and its histological mimics: a comparative immunohistochemical study. Histopathology. 2003; 42(3): 270-9.
- 27)Klebe S, Brownlee NA, Mahar A, et al. Sarcomatoid mesothelioma: a clinical-pathologic correlation of 326 cases. Mod Pathol. 2010; 23(3): 470-9.
- 28)Padgett DM, Cathro HP, Wick MR, et al. Podoplanin is a better immunohistochemical marker for sarcomatoid mesothelioma than calretinin. Am J Surg Pathol. 2008; 32(1): 123-7.
- 29)Takeshima Y, Amatya VJ, Kushitani K, et al. Value of immunohistochemistry in the differential diagnosis of pleural sarcomatoid mesothelioma from lung sarcomatoid carcinoma. Histopathology. 2009; 54(6): 667-76.
- 30)Chirieac LR, Pinkus GS, Pinkus JL, et al. The immunohistochemical characterization of sarcomatoid malignant mesothelioma of the pleura. Am J Cancer Res. 2011; 1(1): 14-24.
- 31)Miettinen M, Limon J, Niezabitowski A, et al. Calretinin and other mesothelioma markers in synovial sarcoma: analysis of antigenic similarities and differences with malignant mesothelioma. Am J Surg Pathol. 2001; 25(5): 610-7.
- 32)Sandberg AA, Bridge JA. Updates on the cytogenetics and molecular genetics of bone and soft tissue tumors. Synovial sarcoma. Cancer Genet Cytogenet. 2002; 133(1): 1-23.
- 33)Mangano WE, Cagle PT, Churg A, et al. The diagnosis of desmoplastic malignant mesothelioma and its distinction from fibrous pleurisy: a histologic and immunohistochemical analysis of 31 cases including p53 immunostaining. Am J Clin Pathol. 1998; 110(2): 191-9.
- 34)Churg A, Colby TV, Cagle P, et al. The separation of benign and malignant mesothelial proliferations. Am J Surg Pathol. 2000; 24(9): 1183-200.
- 35)Barak S, Wang Z, Miettinen M. Immunoreactivity for calretinin and keratins in desmoid fibromatosis and other myofibroblastic tumors: a diagnostic pitfall. Am J Surg Pathol. 2012; 36(9): 1404-9.
- 36)Wu D, Hiroshima K, Matsumoto S, et al. Diagnostic usefulness of p16/CDKN2A FISH in distinguishing between sarcomatoid mesothelioma and fibrous pleuritis. Am J Clin Pathol. 2013; 139(1): 39-46.
- 37)日本肺癌学会編.臨床・病理 肺癌取扱い規約 第7版.金原出版,2010.
- 38)日本肺癌学会編.悪性胸膜中皮腫病理診断の手引き 第1.0版.日本肺癌学会,2013.https://www.haigan.gr.jp/uploads/photos/647.pdf
- *文献のエビデンスレベルについて
- 病理診断に関わる参考文献にはエビデンスレベルの記載はしていない。
日本肺癌学会「悪性胸膜中皮腫病理診断の手引き」を参考にして頂きたい。