5
Ⅰ.診 断
病期診断
5-1.病期診断(画像診断)
文献検索と採択

5-1.病期診断(画像診断)
- 推 奨
a.中皮腫の治療方針の決定のために病期診断は行うよう勧められる。(グレードA)
b.胸部造影CTは,病期診断のために行うよう勧められる。(グレードA)
c.FDG-PET/CTは,病期診断のために行うよう勧められる。(グレードB)
エビデンス
- a.
- 現在広く使用されている中皮腫のTNM分類1)は,病期分類に従った治療方針決定のために必須であり,ある程度の予後を反映するものの,T1/T2間,N1/N2間,Stage I/II間で生存率に有意な差がみられず改良が必要とされている2)3)。
- b.
- CTは原発巣の広がり,局所浸潤,リンパ節腫大や遠隔転移を捉えることができ,病期診断において,その経済性と比較的容易に実施できるため侵襲的検査の前に最初に行うべき基本検査である4)5)。
MRIは病期診断においてルーチンに用いられるわけではない。胸壁や内胸筋膜への局所浸潤ではMRIの正診率が69%で,CTの46%より高く,横隔膜浸潤でもCTの55%に対し,MRIでは82%と高い6)。同様に葉間列への広がり,骨への局所浸潤の評価においてCTより有用との報告7)もある。しかし近年のmultidetector CTの発達に伴い任意の方向で再構成できるようになり,CTでも局所の広がりに関してかなり正確に評価可能と思われる8)。
脳転移の検索において造影MRIは高い感度を有する有用な検査であるが9),体内金属などで造影MRIができない場合は造影CTでも代用可能である。ただし頭部造影MRIや頭部造影CTなどによる病期診断は必須ではない。 - c.
- FDG-PET/CTは,病期診断において,一般的にやや過小評価されるものの10)11),比較的正確で観察者間相違も小さい12)。CT,PET,MRI,PET/CTのStageⅡおよびStage Ⅲに対する正診率は0.77,0.86,0.8,1.0と0.75,0.83,0.9,1.0でありPET/CTは両Stageにおいて高く13),逆にT4やN2などの進行例での正診率は高くない傾向がある10)。FDG-PET/CTは局所浸潤の評価には向かないが,無症状あるいは他の画像診断で発見されていない胸郭外遠隔転移の検出にも優れている11)14)15)。
引用論文
- 1)Rusch VW. A proposed new international TNM staging system for malignant pleural mesothelioma. From the International Mesothelioma Interest Group. Chest. 1995; 108(4): 1122-8. (I)
- 2)Rusch VW, Giroux D, Kennedy C, et al; IASLC Staging Committee. Initial analysis of the international association for the study of lung cancer mesothelioma database. J Thorac Oncol. 2012; 7(11): 1631-9. (IV)
- 3)Rusch VW, Giroux D. Do we need a revised staging system for malignant pleural mesothelioma? Analysis of the IASLC database. Ann Cardiothorac Surg. 2012; 1(4): 438-48. (IV)
- 4)Nickell LT Jr, Lichtenberger JP 3rd, Khorashadi L, et al. Multimodality imaging for characterization, classification, and staging of malignant pleural mesothelioma. Radiographics. 2014; 34(6): 1692-706. (I)
- 5)Truong MT, Viswanathan C, Godoy MB, et al. Malignant pleural mesothelioma: role of CT, MRI, and PET/CT in staging evaluation and treatment considerations. Semin Roentgenol. 2013; 48(4): 323-34. (I)
- 6)Heelan RT, Rusch VW, Begg CB, et al. Staging of malignant pleural mesothelioma: comparison of CT and MR imaging. AJR Am J Roentgenol. 1999; 172(4): 1039-47. (IV)
- 7)Knuuttila A, Halme M, Kivisaari L, et al. The clinical importance of magnetic resonance imaging versus computed tomography in malignant pleural mesothelioma. Lung Cancer. 1998; 22(3): 215-25. (IV)
- 8)Pinto C, Novello S, Torri V, et al. Second Italian consensus conference on malignant pleural mesothelioma: state of the art and recommendations. Cancer Treat Rev. 2013; 39(4): 328-39. (I)
- 9)Akeson P, Larsson EM, Kristoffersen DT, et al. Brain metastases--comparison of gadodiamide injection-enhanced MR imaging at standard and high dose, contrast-enhanced CT and non-contrast-enhanced MR imaging. Acta Radiol. 1995; 36(3): 300-6. (IV)
- 10)Pilling J, Dartnell JA, Lang-Lazdunski L. Integrated positron emission tomography-computed tomography does not accurately stage intrathoracic disease of patients undergoing trimodality therapy for malignant pleural mesothelioma. Thorac Cardiovasc Surg. 2010; 58(4): 215-9. (IV)
- 11)Wilcox BE, Subramaniam RM, Peller PJ, et al. Utility of integrated computed tomography-positron emission tomography for selection of operable malignant pleural mesothelioma. Clin Lung Cancer. 2009; 10(4): 244-8. (IV)
- 12)Frauenfelder T, Kestenholz P, Hunziker R, et al. Use of computed tomography and positron emission tomography/computed tomography for staging of local extent in patients with malignant pleural mesothelioma. J Comput Assist Tomogr. 2015; 39(2): 160-5. (IV)
- 13)Plathow C, Staab A, Schmaehl A, et al. Computed tomography, positron emission tomography, positron emission tomography/computed tomography, and magnetic resonance imaging for staging of limited pleural mesothelioma: initial results. Invest Radiol. 2008; 43(10): 737-44. (IV)
- 14)Ambrosini V, Rubello D, Nanni C, et al. Additional value of hybrid PET/CT fusion imaging vs. conventional CT scan alone in the staging and management of patients with malignant pleural mesothelioma. Nucl Med Rev Cent East Eur. 2005; 8(2): 111-5. (IV)
- 15)Flores RM, Akhurst T, Gonen M, et al. Positron emission tomography defines metastatic disease but not locoregional disease in patients with malignant pleural mesothelioma. J Thorac Cardiovasc Surg. 2003; 126(1): 11-6. (IV)
5-2.外科的病期診断
文献検索と採択
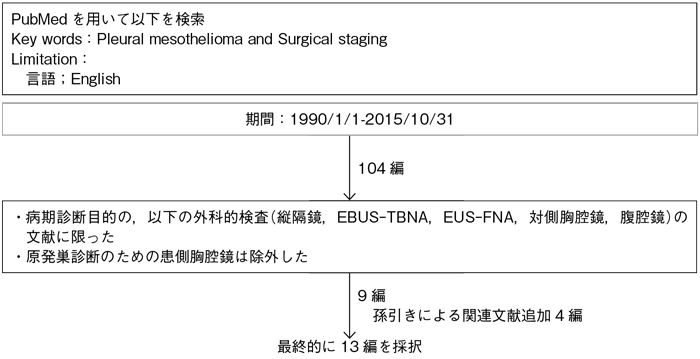
5-2.外科的病期診断
- 推 奨
- 病期診断と手術適応を判定する際に,縦隔・肺門リンパ節転移あるいは胸腔外進展の有無が重要な治療前評価となる場合には,胸腹部CTやFDG-PET/CT検査などの画像診断に加え,以下の病期診断検査を行うことを考慮してもよい。(グレードC1)
a.縦隔鏡検査(Cervical mediastinoscopy;CM)
b.超音波気管支鏡下生検検査(EBUS-TBNA)
c.超音波内視鏡下穿刺吸引生検(食道)検査(EUS-FNA)
d.対側胸腔鏡検査
e.腹腔鏡検査
エビデンス
- a・b・c.
- 胸腔内リンパ節転移陽性中皮腫症例の手術治療成績は不良であり1)2),しかも臨床病期と病理病期の一致率が低いため2)3),治療前に肺門・縦隔リンパ節転移の有無を病理学的に評価して手術適応や治療法を決める病期診断検査が必要な場合がある。
CMは縦隔リンパ節(#2,#3a,#4,#7),EBUS-TBNAは縦隔・肺門リンパ節(#2,#3a,#4,#7,#10,#11)を,EUS-FNAは縦隔リンパ節(#5,#7,#8,横隔膜下リンパ節)を,検査することができる3)~6)。
CMは縦隔リンパ節のCT画像(短径10 mm以上陽性)に比べ転移診断の正診率を67%から93%まで改善したとする報告があり7),特に#4,#7,#10に限れば診断能は高い8)。FDG-PETおよびCT画像診断に加えCMを行うことで,さらに14%の症例で手術適応外の診断を得られたとする報告がある9)。
一方,EBUS-TBNA(あるいはEUS-FNA)は,CMに比べて広範囲の縦隔・肺門リンパ節(特にEUS-FNAでは横隔膜下リンパ節)を検査できるため,転移診断能は高いとする報告がある5)6)。したがって縦隔リンパ節転移の評価にCMのみでは不十分とする報告も多い5)6)。CMでリンパ節転移陰性と診断した19例中,EPP手術により10例が偽陰性であったとする報告がある10)。
縦隔転移陽性リンパ節の部位に加え,陽性リンパ節個数が外科治療成績に影響をもつとする報告があり2),これら検査時にはできるだけ複数箇所のリンパ節を採取することを勧める報告がある。 - d・e.
- 縦隔進展あるいは横隔膜進展症例では対側胸腔内あるいは腹腔内に及んでいる可能性があるため,対側胸腔鏡あるいは腹腔鏡を行って手術適応外を決める病期診断検査である。これら腔内進展の有無を評価する方法として,腔内洗浄細胞診の有用性が報告されている11)~13)。
〈併用検査〉
引用論文
- 1)Rusch VW, Venkatraman E. The importance of surgical staging in the treatment of malignant pleural mesothelioma. J Thorac Cardiovasc Surg. 1996; 111(4): 815-25; discussion 825-6. (IV)
- 2)Sugarbaker DJ, Richards WG, Bueno R. Extrapleural pneumonectomy in the treatment of epithelioid malignant pleural mesothelioma: novel prognostic implications of combined N1 and N2 nodal involvement based on experience in 529 patients. Ann Surg. 2014; 260(4): 577-80; discussion 580-2. (IV)
- 3)Nakas A, Black E, Entwisle J, et al. Surgical assessment of malignant pleural mesothelioma: have we reached a critical stage? Eur J Cardiothorac Surg. 2010; 37(6): 1457-63. (IV)
- 4)Bean SM, Eloubeidi MA, Cerfolio R, et al. Endoscopic ultrasound-guided fine needle aspiration is useful for nodal staging in patients with pleural mesothelioma. Diagn Cytopathol. 2008; 36(1): 32-7. (IV)
- 5)Rice DC, Steliga MA, Stewart J, et al. Endoscopic ultrasound-guided fine needle aspiration for staging of malignant pleural mesothelioma. Ann Thorac Surg. 2009; 88(3): 862-8; discussion 868-9. (IV)
- 6)Nakas A, Waller D, Lau K, et al. The new case for cervical mediastinoscopy in selection for radical surgery for malignant pleural mesothelioma. Eur J Cardiothorac Surg. 2012; 42(1): 72-6; discussion 76. (III)
- 7)Schouwink JH, Kool LS, Rutgers EJ, et al. The value of chest computer tomography and cervical mediastinoscopy in the preoperative assessment of patients with malignant pleural mesothelioma. Ann Thorac Surg. 2003; 75(6): 1 715-8; discussion 1718-9. (IV)
- 8)Pilling JE, Stewart DJ, Martin-Ucar AE, et al. The case for routine cervical mediastinoscopy prior to radical surgery for malignant pleural mesothelioma. Eur J Cardiothorac Surg. 2004; 25(4): 497-501. (IV)
- 9)Sørensen JB, Ravn J, Loft A, et al; Nordic Mesothelioma Group. Preoperative staging of mesothelioma by 18F-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography fused imaging and mediastinoscopy compared to pathological findings after extrapleural pneumonectomy. Eur J Cardiothorac Surg. 2008; 34(5): 1090-6. (IV)
- 10)de Perrot M, Uy K, Anraku M, et al. Impact of lymph node metastasis on outcome after extrapleural pneumonectomy for malignant pleural mesothelioma. J Thorac Cardiovasc Surg. 2007; 133(1): 111-6. (IV)
- 11)Rice DC, Erasmus JJ, Stevens CW, et al. Extended surgical staging for potentially resectable malignant pleural mesothelioma. Ann Thorac Surg. 2005; 80(6): 1988-92; discussion 1992-3. (IV)
- 12)Zielinski M, Hauer J, Hauer L, et al. Staging algorithm for diffuse malignant pleural mesothelioma. Interact Cardiovasc Thorac Surg. 2010; 10(2): 185-9. (IV)
- 13)Hasani A, Alvarez JM, Wyatt JM, et al. Outcome for patients with malignant pleural mesothelioma referred for Trimodality therapy in Western Australia. J Thorac Oncol. 2009; 4(8): 1010-6. (IV)