第1回肺癌術前治療に関する肺癌学会・PMDAワークショップ 開催報告
開催概要
日時:2019年7月15日(月、祝)10:00-16:15
場所:国立がん研究センター管理棟特別会議室
参加者:日本肺癌学会員119名、企業等関係団体45名
Steering Committee
代 表
光冨徹哉(近畿大学医学部外科学教室呼吸器外科部門)
事務局
堀之内秀仁(国立がん研究センター中央病院呼吸器内科)
肺癌学会事務局
外科
吉野一郎(千葉大学大学院医学研究院呼吸器病態外科学)
濱田顕(近畿大学医学部外科学教室呼吸器外科部門)
内科
弦間昭彦(日本医科大学大学院医学研究科呼吸器内科学分野)
堀之内秀仁(国立がん研究センター中央病院呼吸器内科)
放射線治療科
中山優子(国立がん研究センター中央病院放射線治療科)
原田英幸(静岡県立静岡がんセンター放射線治療科)
病理
谷田部恭(国立がん研究センター中央病院病理診断科)
元井紀子(国立がん研究センター中央病院病理診断科)
生物統計
山中竹春(横浜市立大学大学院医学研究科臨床統計学)
PMDA
清原宏眞(医薬品医療機器総合機構新薬審査第五部)
開催目的
①肺癌術前治療における治療開発の日本における現状、課題、今後の方向性を検討する
②関係する専門家、学会、PMDA、等各団体の間で認識の共有を目指す
③海外の動向を見据え、日本でのコンセンサス形成の一助となす
**********************************************
Session I: 術前治療のエビデンスと我が国の課題
司会:吉野一郎(千葉大学大学院医学研究院呼吸器病態外科学)
Lecture 1: 化学療法と化学放射線療法による導入療法のエビデンスと我が国の課題
原田英幸(静岡県立静岡がんセンター放射線治療科)
術前化学療法
1990年代、術前化学療法により無病生存期間(Disease-free survival、DFS)、全生存期間(Overall survival、OS)ともに延長するとする小規模なランダム化試験の結果が報告され術前治療への期待が高まった。(Rosell et al., NEJM 1994)しかし、日本国内で行われた試験、海外で行われたより規模の大きなランダム化試験では、同時期に術後化学療法が標準治療として確立したことから登録が中断する等したことも影響し、同様の結果が検証されることはなかった。
JCOG9209試験ではDFS、OSとも術前治療による改善を認めなかった。Depierreらにより、pN2群では術後放射線治療も実施した試験ではDFSの改善は認めたがOSは全体では改善を認めず、N0-1のサブセットでは全生存期間が良い傾向を認めたことが報告された。Scagliottiらが実施した試験でも全体でDFSは改善せず、IIB-IIIAのサブセットで術前化学療法群が良い傾向があったと報告されている。(Nagai et al., JTCVS 2003、Depierre et al., JCO 2002、Scagliotti et al., JCO 2012)
これらの術前化学療法、術後化学療法とOSの関係を検討したメタ解析の結果、術前、術後ともに同等の効果が示唆されている。(NSCLC Meta-analysis Collaborative Group Lancet 2010, Lancet 2014)これらの結果に基づき、Positiveな結果が報告されている術後化学療法が肺癌診療ガイドラインでは推奨されている。ただし、メタ解析の結果からは術前、術後でほぼ同等のOS改善を認めており、術前化学療法も標準治療のオプションのひとつとして評価可能である。
III期に対するCRTと手術を含む集学的治療
局所進行非小細胞肺癌に対して、化学放射線療法と、手術を含む集学的治療の比較試験が複数実施されてきた。INT-0139試験では、無増悪生存期間(Progression-free survival、PFS)では手術群が良好であったが、OSでは統計学的にはNegativeであった。サブセット解析として、ダウンステージが得られた患者、肺葉切除が実施できた患者では、手術群がよい傾向があったと報告されている。ただし、このサブセット解析では、肺葉切除、肺全摘を行った患者と比較された集団における化学放射線療法の有効性が異なり、手術を有効とする結論は得られていない。(Albain et al., Lancet 2009)同様の集団に対して、ドイツで行われたESPATUE試験においても、手術群、化学放射線療法群ともに同等のOSが報告されている。(Eberhardt et al., JCO 2015)
まとめ
これらのことから、現状での周術期治療については下記のように位置付けることができる。
・メタ解析の結果からは、IB-III期では術前、術後治療いずれも生存改善が示されている。
・術後治療として、化学療法が肺癌診療ガイドラインで推奨されている。
・肺癌診療ガイドラインで、術前治療が明確に推奨されているのは肺尖部胸壁浸潤癌(Superior sulcus tumor、SST)のみである。
Lecture 2: 免疫チェックポイント阻害剤と分子標的薬による導入療法のエビデンスと我が国の課題
濱田顕(近畿大学医学部外科学教室呼吸器外科部門)
免疫チェックポイント阻害剤による術前治療
基礎実験の結果に基づき、免疫チェックポイント阻害剤は術前治療として実施ことにより有効性が高まると報告されている。(Liu et al,, Cancer Discov 2016)これらの結果に基づき実施された術前治療としての免疫チェックポイント阻害剤の試験において、Major pathologic response(MPR)について報告されている。ニボルマブの術前投与によるMPRが43%であったと最初に報告されたのち、LCMC3試験でアテゾリズマブ術前治療のMPRが15%、NEOSTAR試験ではニボルマブ単剤でのMPRが17%、ニボルマブ+イピリムマブによるMPRが33%、Columbia studyではMPRが54.5%、NADIM試験ではカルボプラチン+パクリタキセル+ニボルマブによるMPRが85%と報告された。これらの探索的な試験の結果に基づき、免疫チェックポイント阻害剤による術前治療の有効性を検証する第III相試験が複数実施されている。
分子標的薬による術前治療
CTONG1103試験は、中国で実施されたエルロチニブによる術前導入療法の比較試験である。主要評価項目であるORRではエルロチニブが統計学的には有意ではなかったものの良い傾向を示していた。MPRについてはエルロチニブ群で10.7%であった。PFSではエルロチニブ群が良い結果であったが、OSでは差を認めなかった。現在も分子標的薬を用いた術前治療の試験が複数実施されている。
Lecture 3: 肺癌術前治療における病理学的効果判定の動向と我が国の課題
堀之内秀仁(国立がん研究センター中央病院呼吸器内科)
進行期肺癌において、免疫チェックポイント阻害剤、ドライバー遺伝子異常に伴うチロシンキナーゼ阻害剤の有効性が確立し、今後の治療開発は周術期治療に焦点があたっている。特に免疫チェックポイント阻害剤については、既に複数のAdjuvant/Neoadjuvantの大規模な企業治験が実施されている。治療開発の今後の方向性だけでなく、病理学的奏効などの代替エンドポイントによる早期承認等の可能性について、IASLCが主導する形で、2018年3月にIASLC-FDAワークショップ(WS)が開催され、その内容はJournal of Thoracic OncologyにもEarly publicationされた(Blumenthal et al., Current Status and Future Perspectives on Neoadjuvant Therapy in Lung Cancer, JTO Sep 2018)。日本においても周術期治療の位置づけは今後さらに重要性を増すと考えられ、肺癌学会が主導するかたちで、PMDA製薬企業等の情報共有とコンセンサス作りの場を提供する意義がある。
Luncheon seminar:
司会:元井紀子(国立がん研究センター中央病院病理診断科)
Lecture 4: 乳癌術前治療のエビデンスと効果判定に関する現状と課題
野口瑛美(国立がん研究センター中央病院乳腺・腫瘍内科)
NSABP B-18試験は、手術可能乳癌に対する術前もしくは術後AC療法の比較試験である。PFS、OSともに術前と術後で差がなく、術前で温存可能な割合が高いことが報告された。(JCO 1998 267)この試験も含まれるCochrane systematic reviewにおいても、DFS、OSについて術前と術後で差はないものの、乳房温存率は術前治療により向上することが報告されている。(Mieog et al., Cochrane Database Syst Rev 2007)
その後実施された、NOAH試験においては術前化学療法にトラスズマブを上乗せすることによりpCRが43%と報告され、DFS、OSも改善することが示された。(Gianni et al., Lancet 2010)NeoALTTO試験では、トラスツマブにラパチニブを加えることでpCRの割合が増加したことが報告されている。(Baselga et al., Lancet 2012)
これらの試験から、乳癌術前化学療法と、術後化学療法のメリット、デメリットが明らかにされた。術前化学療法のメリットとしては、乳房温存可能性の向上、病理学的効果が予後因子として判明する場合がある、pCRをエンドポイントとして実施すれば臨床試験が小規模・短期間で実施可能であることがあげられる。一方、デメリットとしては、治療前病期が不確実、バイオマーカーが不確実、Over treatmentの可能性があることがあげられる。術後化学療法のメリットとしては、病気が正確であり、バイオマーカーが化学療法前に正確に評価できることがあげられる。一方、デメリットとしては患者本人における化学療法の有効性が明らかにならないこと、乳房温存可能性は向上しないこと、DFS、OSがエンドポイントとなる試験となり大規模・長期間を要することがあげられる。
その後行われたALTTO試験において、pCRと生存の関係に疑義が提示されることとなった。(Piccart-Gebhart et al., JCO 2016)
CTNeoBCにおいて、試験レベルのpCR、EFSには弱い相関しか認めないことが報告された。ただし、この解析に含まれた試験のうち、分子標的薬を用いたものはNOAH試験のみであった点に限界がある。(Cortazar et al., Lancet 2014)
FDAは2012年にエンドポイントとしてのpCRに関するガイダンスを発出した。(N EnglJ Med 2012;366:2438-41)
このガイダンス後にはじめてpCRをエンドポイントとして実施された術前治療の試験がペルツズマブを用いたNEOSPHERE試験、TRYPHAENA試験である。(Amiri-Kordestani et al., Clin Cancer Res 2014、Gianni et al., Lancet Oncol 2012、Schneeweiss et al., Ann Oncol 2013)これらの試験では、5年DFS割合が試験治療群で3%改善するにとどまった。一方、進行乳癌を対象として同薬剤を用いたAFINITY試験の結果は統計学的にはIDFSでは有意であり、OSでは中間解析では有意差はなかったものの、FDAは通常承認した。(Gianni et al., Lancet Oncol 2016、von Minckwitz et al., N Engl J Med 2017)
これらの乳癌の経験から、術前治療により医薬品開発を行うことの利点、欠点が明らかにされてきた。利点としては、新薬の有効性に関する早期のシグナルを得るセッティングとして魅力的であること、治療後の手術検体を用いたバイオマーカー探索の基盤として重要であることがあげられる。欠点としては、pCRが集団におけるDFS、OSのサロゲートエンドポイントとして確立していないこと、再発後の治療の進歩により術前治療における新薬の効果上乗せを長期アウトカムでも検証することが難しくなっていること、術前治療のみでは長期の有害事象評価が不十分であること等があげられる。そのため、米国においても今後、術前化学療法の迅速承認を得ることは難しい可能性が高く、転移性乳癌および術前化学療法の双方の試験で、規制当局の承認を得る戦略が要求されると考えられる。また、検的証試験で結果がNegativeであったときに取り消せる米国と事情が異なり、検証的試験で結果が出なかった薬を承認整理することが日本でできるかもポイントとなってくる。
Session II: 術前治療の効果判定
司会:谷田部恭(国立がん研究センター中央病院病理診断科)
Lecture 5: 画像効果判定のエビデンスと我が国の課題
渡辺裕一(国立がん研究センター中央病院放射線診断科)
術前治療において、各種の画像と有効性の関連について検討が行われてきた。一般的に用いられるCTによる腫瘍縮小に比べ、PETにおけるSUV減少が病理学的奏効を関連することが報告されている。(Cerfolio et al., Ann Thorac Surg 2004、Zhang et al., Nucl Med Commun 2013)
さらに近年、CTの縮小と病理学的奏効は必ずしも関連していないことも報告されている。(William Jr., J Thorac Oncol 2013)
免疫チェックポイント阻害剤を術前治療に用いた試験では、NEOSTARとLCMC3でCT縮小と病理学的縮小に関連があるという報告が行われているが、PETの結果は現時点では報告されていない。
生存との関連という観点では、CTやPETのSUVの変動よりも、病理学的奏効の方が、関連性が高いことが報告されている。(Pottgen et al., Clin Cancer Res 2006、William Jr., J Thorac Oncol 2013)
今後、免疫チェックポイント阻害剤による術前治療を行う試験において、CT、PET、病理学的奏効、さらに生存のデータを組み合わせた解析が望まれる。
Lecture 6: 病理学的効果判定の実際と我が国の課題
元井紀子(国立がん研究センター中央病院病理診断科)
病理学的効果判定の実際
病理学的奏効の判定の際には、癌組織の範囲の定義がポイントとなる。
術前治療後の腫瘍残存面積が大きい方が予後不良であることが報告されている。(Yamane et al., J Thorac Oncol 2010)腫瘍残存10%とされる根拠としては、OSとの関連を解析した報告が存在する。(Junker et al., J Cancer Res Clin Oncol 1997)
日本の臨床・病理肺癌取り扱い規約第8版では、切除肺、剖検例において、治療前の組織・細胞学的所見が明らかな症例を対象に、腫瘍の中心をとおる最大割面を検索して治療効果判定を行う。治療効果判定基準は、Efスコアとして記載され、EF. 0が無効(治療による変性、壊死を認めない)、EF. 1aごく軽度の効果(癌組織に占める生存しうる癌細胞の比率2/3以上)、Ef. 1b軽度の効果(癌細胞の比率1/3以上2/3未満)、Ef. 2中等度の効果(1/3未満)、Ef.3著効(癌細胞がまったく認められないか、残存しても生存しえないと判断される)と分類されている。
癌細胞の治療による変化のパターンは多様で、病理診断医の診断基準の標準化が必要となる。
pCR(Complete pathologic response)についても、評価方法が試験により異なることが知られている。まず、評価対象患者の分母について、全患者とするか、切除可能であった患者とするかがポイントとなる。また、完全消失とするか、95%以上消失をもってpCRとするか等が試験によって定義が異なる。
pCRの頻度は従来の治療では0-16%と報告されており、予後との関連も示唆されているが頻度が少ないことから統計学的な解析においては限界も存在する。また、腫瘍内の反応性にも多様性を認めることがあり、留意する必要がある。(Hellmann et al. Lancet Oncol. 2014)
Majorpathologic response (MPR)の定義は、「残存する生存し得る腫瘍細胞が10%以下であること(NAC後のNSCLC)」とされている。(Hellmann et al. Lancet Oncol. 2014)
治療後の変化についての形態学的評価においては、生存しうる癌細胞と生存しえないがん細胞の区別を行うためにこれまでも検討が進められてきている。(Pataer et al., J Thorac Oncol 2012)
また、病理学的効果判定を実際に行おうとすると、病理診断医の労力は増大する。国立がん研究センター中央病院で実施している試験において、MPRを評価しようとした経験からは、評価対象のスライド枚数が通常15枚程度から、45枚程度まで増加し、観察時間も明らかに延長する。
MRRの評価方法においても、評価者間での一致率についても考慮が必要であり、また、腺癌と扁平上皮癌でもカットオフを変える必要含め検討を要する可能性も示唆されている。(Qu et al., J Thorac Oncol 2019)
まとめると、術前治療の病理学的評価には、肺癌取扱い規約規準、pCR, MPRの規準がある。今後の課題として
1)病理学的評価方法の標準化
2)従来の評価項目との相関性に関するエビデンスの構築
3)評価に必要とされる労力に対する対価を検討していく必要
などがあり、今後検討を要する。
Lecture 7: Molecular assayによる効果判定の可能性と我が国の課題
西尾和人(近畿大学)
Molecular assayによる効果判定において、もっとも活用されているものがctDNAである。
一般に、明白な転移のないがん患者の初期段階では、感度の高いctDNA検出系が必要となる。現時点で候補となりうる検出方法としては、デジタルPCR、ビーズエマルジョン増幅磁気(BEAMing)、セーフシーケンスシステム(Safe-SeqS)、ディープシーケンスによるがん個別プロファイリング(CAPP-Seq)、アンプリコンディープシーケンス(TAmSeq)などが存在する。これらの手法は、非ターゲットシーケンス手法よりも感度が高く、ctDNA検出限界は0.01%未満であるが、ゲノムワイドでctDNA分析を行うためには、高濃度のctDNAが必要であることや、全体のアッセイ感度が低い(1-5%以上)ことがあげられる。
ctDNA解析対象となる遺伝子によっても感度が様々であり、・乳癌におけるHER2のCNG、PIK3CAのSNV、大腸癌におけるKRASの検出が17.1%で可能、肺癌におけるモニタリングとしてはEGFRで4週後に検出不可になればPDはない等の報告が存在する。
Minimal residual disease(MRD)の考え方は造血期腫瘍で進んでおり、FDAは2018年にClono SEQ NGS法を承認し、さらに、造血器腫瘍に対する医薬品および生物学的製剤の開発にMRDを使用することに関して規制上の問題を示したガイダンスを公表した。
また、乳癌でのMRDモニタリングについても報告されている。そのなかでは、Personalized dPCRという手法を用いて手術後の55例で一連の血液サンプルを採取(全症例で術前化学療法あり)している。ctDNAの陽性率は転移性再発リスクの増加と相関しており、ctDNAの検出は臨床的再発の7.9か月前(リードタイム)であった。(Garcia-Murillas et al., Sci Transl Med 2015)
近年注目されているCAPP-Seq(Cancer Personalized Profiling by deep Sequencing)とは、分子バーコード法とCapture法をベースにした高感度遺伝子変異解析法である。解析対象の遺伝子数は197で、融合遺伝子、CNV、INDELも同時に検出することができる。必要サンプルは血漿で4ml、DNA量で10-50ngで、この検体で最小検出感度 0.001%程度から報告されている。
早期NSCLCにおける術後のctDNA測定についても小数例の報告が存在する。NSCLC I-III期40例を対象にCAPP-Seqを用いて128遺伝子のパネルを実施した結果、再発した患者の72%で再発前にctNDAが検出された。(Chaudhuri et al., Cancer Discov 2017)
ctDNAの検出能は採血量に依存している。早期NSCLCではctDNA含有量が少ないため、5-10mlの血液サンプルを解析しただけでは頑強な結果が得られない可能性がある。WJOG8014LTRでは1mlあたりのctDNA収量4014copiesであり、WJOG7612GTRでは1mlあたりのctDNA収量19198copiesであった。検出感度は投入したDNAコピー数に依存するため、大腸癌や乳癌では肺癌よりも高い感度で検出できることが知られている。
また、早期肺癌での検討では、腫瘍径が大きい方が検出されやすいことも報告されている。(Ohira et al., Cancer Science, Tumor volume determines the feasibility of cell-free DNA sequencing for mutation detection in NSCLC)
海外では液体生検アカデミー、液体生検協会等が設立されてすでに活動を開始しており、この分野の進歩のスピードが加速している。
まとめ
末梢血中のctDNAとCTCの半減期は数時間。したがって、治療後の数か月または数年後のctDNAまたはCTCの検出はMRDの持続を意味している。
ctDNAとCTCの濃度は非常に低く、それは超高感度検出技術の使用を必要とする
超高感度LBアッセイは現在、術前補助療法、補助化学療法の臨床試験で実施する必要があり、腫瘍再発の術後モニタリングに画像診断法を補完しうる
微小転移性再発の検出は、明らかな転移が起こる前に、新しいタイプの術後補助療法への介入につながる可能性がある
長期の追跡期間および補助療法に関する臨床試験の実質的な費用を減少させる可能性がある
MRDを標的としたがん治療の時代が到来しつつある
Session III: 術前治療の試験デザイン
司会:中山優子(国立がん研究センター中央病院放射線治療科)
Lecture 8: 術前治療のサロゲートエンドポイントにおける課題
山中竹春(横浜市立大学大学院医学研究科臨床統計学)
NSCLCの術前治療の短期指標としては、メジャーなものがすでに存在する。それらに加え病理学的な奏効が乳癌を中心に検討されている。病理学的奏効が術前治療における主要評価項目に採用できるとなれば、薬事承認前の薬剤においては術前治療による早期の効果指標に基づき早い段階で承認申請を考慮でき、市販後の薬剤ににおいては術前治療により新たなエビデンスを早く確立でき、製薬企業、研究者、患者いずれにとっても意義がある。
乳癌において、FDAは術前治療に関するPooled Analysisを実施し、短期の有効性指標にpCRを取り入れる方向で2014年にガイダンスを発行した。(Cortazar et al., Lancet 2014、https://www.fda.gov/downloads/drugs/guidances/ucm305501.pdf)そのような中実施されたNeo-ALLTO試験(1群150例)、ALLTO試験(1群1500例)の結果、pCR割合が高ければ、DFSが良いというロジックが成立しなかった。(Baselga et al., Lancet 2012、Piccart-Gebhart et al., JCO 2016)術前でT 29%、T+L 51%のpCR割合だったが、4年DFSは86%と88%でほぼ同等であった。この結果は生物統計家の間でもかなりの議論を引き起こした。(Donald Berry, https://cancerletter.com/articles/20140711_2/、George Sledge, https://cancerletter.com/articles/20140711_3/、Bossuyt et al., JAMA Oncol 2016、Buyse et al., Clin Cancer Res 2016)
ここで問題となるのが、OSなど真のエンドポイントに対する、短期のエンドポイントのサロガシーである。pCRは、個々の患者レベルで良好な生存を予測するサロガシーを有することが示されてきた。このpCRの群間差が、DFS、OS等の群間差と相関するかどうか、つまり試験レベルのサロガシーについては、示すためには多数のRCTが必要となる。乳癌の術前治療のRCTが29試験評価された研究でも、pCRの群間差とDFSの群間差が示されなかった。(Berruti et al., J Clin Oncol 2014)NeoALLTOとALLTO試験の結果も、試験レベルのサロガシーを示せなかったことを表している。(Baselga et al., Lancet 2012、Piccart-Gebhart et al., JCO 2016)
この点をよく示した記載が、乳癌診療ガイドライン2018年度版の「pCRが得られた場合、良好な予後が期待できるが、高いpCRが期待できる治療によって治療群全体の予後が改善するとはいえない」といえる。
非小細胞肺癌の早期サロゲート指標について、現時点で確立されたものは存在しない。というよりも、そもそも術前治療に関するRCTの数が不足しており、サロゲートかどうかを検討する状況にない。
2016年7月以前に出版されたサロゲートエンドポイントに関する論文をまとめたところ、肺癌に関する論文は17報で、大腸癌46報、乳癌35報に比べて少ない。さらに、試験の種類に基づく分類では、進行癌に関する解析が122報で最も多いのに対して、術前治療に関しては5報にとどまっている。(Savina et al., Crit Rev Oncol Hematol 2018)
病理学的奏効を腫瘍評価項目とした臨床試験の実施は、免疫チェックポイント阻害剤、TKIの登場により大きなモチベーションとなっている。薬事承認を前提とした際、世界のどの規制当局もOSそのものでの有効性の証明、またはOSへのサロガシーが証明された評価項目での有効性の証明があれば、承認しやすい。ただ、MPR/pCRとDFS/OSに関する試験レベルのサロガシーを示すためには、特に肺癌においては、膨大な年月がかかってしまう。世界のいくつかの規制当局は、OSへのサロガシーのありそうな評価項目で大きく勝ち切り、かつプラスαの事情もあれば、迅速承認し、その後に追加のRCTを要求するというパターンを採用している。ただ実際にといえば、FDAにおいても83の承認のうち、25が迅速承認、そのうち14は検証的な試験が実施されていない。(Yamanaka, Educational Presentation ESMO Asia 2017、Kim et al., Mayo Clin Proc 2016)
日本においては、条件付き早期承認制度(2017年開始)の運用をどうするかという規制当局側の課題が存在する。具体的には、OSの結果を後に提出する条件下で、MPR等を主要評価項目とする臨床試験の結果に基づく条件付き早期承認について、PMDAがどのような判断を行うのか、注目される。一方で、MPRを科学的に妥当なものかどうかについてアカデミア側も詰める必要がある。そのため、MPR/pCRを用いた術前治療の臨床試験が、条件付き早期承認制度の利活用に資するのか否かを評価していく上で、今回のようなWSは大変貴重な一歩といえる。
Lecture 9: 術前治療の効果判定の現状と課題:PMDA側からの観点
手塚瞬(医薬品医療機器総合機構新薬審査第五部)
「抗悪性腫瘍薬の臨床評価方法に関するガイドライン」(平成17年11月1日付け,薬食審査発第1101001号)に、PMDAの抗がん剤承認時の考え方が示されている。肺癌を代表とする患者数の多い癌腫を対象とした抗悪性腫瘍薬においては、延命効果等の明確な臨床的有用性の検証が必須と考えられる。非小細胞肺癌を対象とした第III相試験では、全生存期間(OS)を主要評価項目とすべきと考えている。但し、「延命効果等」と記載されているように、OSの結果を確認した上で、OS以外が設定された主要評価項目の結果に基づいて、有効性評価を行うことが可能なこともある。
例えば、アファチニブ、デュルバルマブ、オシメルチニブ、ダコミチニブは、下記の①及び②を踏まえ、承認された。
①主要評価項目に設定された無増悪生存期間(PFS)について、対照群に対する優越性が示され、かつ臨床的意義のある効果の大きさが認められたこと。
②OSについて、対照群と比較して短縮される傾向は認められなかったこと。
今回話題となったペルツズマブの審査に出された資料(Neo-peaks試験、APHINITY試験、NEOSPHERE試験、TRYPHAENA試験)においては、HER2陽性の早期乳癌の術前・術後薬物療法におけるペルツズマブの有効性及び安全性を評価する上で重要な臨床試験はAPHINITY試験であると判断し、当該試験を中心に評価した。(Amiri-Kordestani et al., Clin Cancer Res 2014、Gianni et al., Lancet Oncol 2012、Schneeweiss et al., Ann Oncol 2013、
Gianni et al., Lancet Oncol 2016、von Minckwitz et al., N Engl J Med 2017)
では、pCRの結果をどのように評価したかというと、乳癌診療ガイドライン 2018年版(国内ガイドライン)FQ3「病理学的完全奏効(pCR)は無再発生存期間や全生存期間の代替エンドポイントとなるか?」において、「一部のサブタイプを除いて病理学的奏効(pCR)は良好な予後予測因子である。しかし薬剤の効果を評価するうえでpCRは無再発生存期間や全生存期間の代替エンドポイントとして確立していない」とした、アカデミアのガイドラインを参照した。つまり、pCRの結果を基に評価することには限界があると判断したが、同時にpCRによらずとも評価できる治療体系が存在していた。具体的には、同ガイドラインにおいて、「周術期薬物療法の本来の目的である再発抑制効果は、術前化学療法と術後化学療法で同等である」と記載されている点がポイントとなった。そのため、術後患者を対象としたAPHINITY試験の成績を考慮し、術前治療におけるペルツズマブの有効性を説明することが可能と考えた。
・サマリー
①治療体系
術前治療の臨床的な意義が確立していること
術前薬物療法≒術後薬物療法
②既承認の手術不能・再発の乳癌患者の臨床試験成績
国際共同第Ⅲ相試験(CLEOPATRA試験)において、対照群に対するペルツズマブ群のOSの延長が示されていること
③早期乳癌の術後患者の臨床試験成績
APHINITY試験のIDFSについて、対照群に対するペルツズマブ群のIDFSの延長が示されていること
①②③とpCR率の結果への一定の理解の上、承認に至った。
これらの乳癌の状況に比べ、肺癌においてはアカデミアが示した見解に基づき、規制当局として術前治療を承認するためには課題が存在する。その中でも、術前治療の臨床的な意義がガイドラインで明示されていない点が最も重要である。肺癌診療ガイドライン 2018年版を参照する限り、術前治療が標準的な治療であると判断される記載ではない。さらに、術前治療により、乳癌のように乳房温存が可能等の具体的な利益も記載されておらず、術前治療を推進するアカデミア側の動機づけが明確ではない。そのため、病理組織学的な治療効果判定の評価項目(pCR又はmPR)の結果のみに基づく評価は、治療効果判定として確立しているかどうかが不明であり、OSの代替エンドポイントと判断し得るまでのエビデンスは得られていないのではないと考えられる。現時点では、PMDAとしては、病理組織学的な治療効果判定の評価項目に基づく一定の評価の可能性はあるものの、主要評価項目はOSとすべきであると考えている。
規制当局側が念頭においている課題について、アカデミア側からも相応の発信があることで、今後術前治療における病理学的奏効など早期のエンドポイントによる承認申請を検討できる可能性がある。
Lecture 10: 術前治療の効果判定の現状と課題:製薬企業側からの観点
高須賀剛(中外製薬株式会社)
乳癌においては、術前薬物療法と術後薬物療法で予後に有意差はないという認識が確立している。
(NASBP-B18、Wolmark et al., J Natl Cancer Inst 2001)乳房温存という考え方が広がったことがきっかけ、動因となり術前治療の考え方が広まった。その方向性を強化しうる併用療法として、トラスツズマブとペルツズマブの併用療法が検討されることになった。NeosphereとTRYPHAENA試験は、APHINITY試験の準備段階の試験という位置づけで実施された。
当初はNeosphereやTRYPHAENA試験で申請は考えていなかったが、FDAが術前治療における承認申請のガイドラインドラフトが出て状況が変化した。
(Amiri-Kordestani et al., Clin Cancer Res 2014、Gianni et al., Lancet Oncol 2012、Schneeweiss et al., Ann Oncol 2013、Gianni et al., Lancet Oncol 2016、von Minckwitz et al., N Engl J Med 2017)
具体的には、FDAのpCRのガイダンスが2012年にドラフト版、2014年に正式版が発出され、EMAについても2014年にガイダンスが示された。
(https://www.fda.gov/downloads/drugs/guidances/ucm305501.pdf、https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-role-pathological-complete-response-endpoint-neoadjuvant-breast-cancer-studies_en.pdf)
ドラフトが出た段階でNeosphere等の試験結果がちょうど得られたところであり、FDA、EMAに申請し、承認を得られた。一方日本においては、この段階でまだデータがなかったため、海外に遅れることになった。
日本ではNeopeaks試験を追加で実施し、APHINITY試験の結果を参考にしながら、術前、術後の治療が同等であるとされ、術前治療による乳房温存という患者への利益もあることが学会のガイドライン等に記載されており、承認につながった。
早期乳癌の治療開発のストラテジーとしては、術前治療のPhase IIの結果と、術後治療のPhase IIIの結果を合わせて承認申請する方法と、術前・術後を合わせたPhase IIIを実施する方法が存在する。
前者では、NeoのP2で有効性、安全性を確認してからP3に投資するかが判断できるというメリットがあり、後者ではpCRの成績が良好であれば同じ試験の中でのDFSの結果も良好である可能性が高いと予測できる点にメリットがある。
両者の中では、1本の試験で術前、術後双方について評価できる後者が、同じ患者さんでPCR、DFSを検討できるという意味でメリットがより大きいと考えられる。
別のストラテジーとしては、CREATE-X、KATHERINEのように、標準治療後の手術によりpCRが得られた場合には術後に標準治療を行い、得られなかった集団で新たな治療を評価するという方法が存在する。
(Masuda et al., N Engl J Med 2017、von Minckwitz et al., N Engl J Med 2019)
Consensus, Conclusions and Open Items
司会:光冨徹哉(近畿大学医学部外科学教室呼吸器外科部門)
肺癌学会会員アンケート結果
堀之内秀仁(国立がん研究センター中央病院呼吸器内科)
・術前治療を推進すべきか(n=86):推進すべき80、推進する必要はない6
・術前治療を実施しているか(n=76):施している56、実施していない20
・術前化学療法を実施しているか(n=58):実施している32、実施していない26
・術前化学放射線療法を実施しているか(n=58):実施している52、実施していない6
・術前免疫チェックポイント阻害剤を実施しているか(n=58):実施している8、実施していない50
・術前分子標的薬治療を実施しているか(n=58):実施している5、実施していない53
・術前治療の対象者
・術前治療後、手術前に効果判定を行うか(n=89):実施する29、実施しない60
・術前治療後、手術前にCTを実施するか(n=60):実施する58、実施しない2
・術前治療後、手術前にPETを実施するか(n=60):実施する27、実施しない33
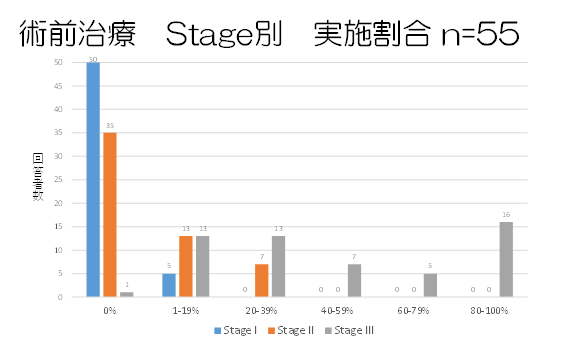
・術前治療後、手術前に病理学的効果判定するか(n=60):実施する5、実施しない55
・術後病理検体による効果判定を行うか(n=89):実施する58、実施しない31
・術後病理検体による癌取り扱い規約による効果判定を行うか(n=58):実施する54、実施しない4
・術後病理検体によるMPRによる効果判定を行うか(n=58):実施する18、実施しない40
・MPRによる効果判定を行っていない理由評価基準を知っているが実施していない(n=22)、複数回答
臨床からの要望がない:7
病理医人員不足:7
検査技師人員不足:3
病理医がしてくれない:1
・術前治療の結果で早期承認する取り組みについて(n=78):必要61、どちらともいえない17、不要0
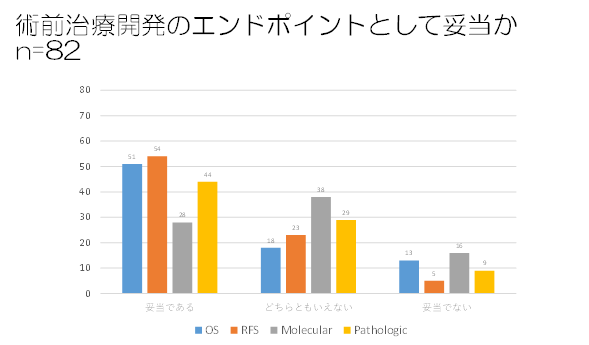
・術前治療のエンドポイント
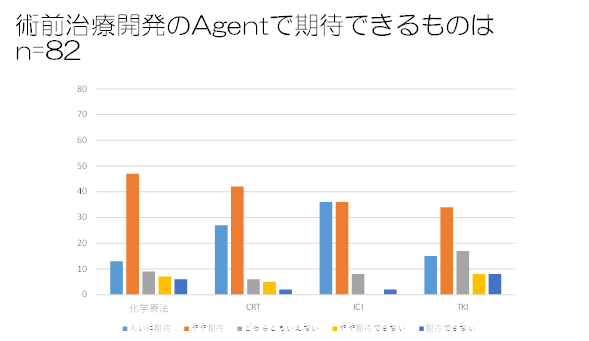
・術前治療開発で用いるAgentで期待しているものは
パネルディスカッション:肺癌術前治療に関するコンセンサス、今後の課題
パネリスト:弦間昭彦、吉野一郎、中山優子、谷田部恭、山中竹春、清原宏眞、高須賀剛
・対象となる患者集団
I-III期が対象となるが、I期については、Solidの比率等によりリスクベネフィットバランスを調整して対象集団に組み入れる必要がある。特に免疫チェックポイント阻害剤が加わる場合は、より安全性に考慮し予後良後集団を術前治療の対象に組み入れる際には留意が必要である。
まとめると、I期の予後不良が予測される集団、II期、III期が対象となる。III期のうち、N2についてはSingle stationについては術前治療の対象となるが、Multipleをどうするかは議論の余地がある。
・Agentは何か
TKIは病理学的奏効割合が低く、根治的な治療たりえないという意見が多く、現時点では周術期治療における位置づけは確立していないとのコンセンサス。もし、TKIを使うのであれば腫瘍縮小を期待して術前で使用したい。一方、Pneumonectomy相当のものが、Lobctomy相当になった場合に、本当にLobectomyでよいかは議論の余地がある。
IOについては、現在実施されている試験結果がポイントとなる。IOを術前治療に組み入れる場合、安全性についての観点がIV期よりも重要になる。特に、治療関連死等だけでなく、免疫関連の有害事象による手術時期の遅延等も問題になりうる。術前治療で免疫チェックポイント阻害剤を使用し、検体を用いた有効性、安全性に関する研究が推進されることは期待したい。
N2リンパ節陽性の場合、放射線治療を併用することが望ましい。N2の標準治療として、手術とは化学放射線療法の比較試験で手術が勝ったという知見も、化学放射線療法が手術に勝ったという結果も存在しない。また、免疫チェックポイント阻害剤と、放射線治療により、相乗作用も期待できる。
サロゲートマーカー
今回テーマとした病理学的奏効、特にMPRに関する、肺癌領域での知見は不足している。一方で、現在行われている術前治療の治験では、主要評価項目もしくは副次評価項目において、病理学的奏効が採用されている。乳癌においてもpCRが一般的に評価されている状況にあり、肺癌においても病理診断医との連携に基づき、評価できる体制を整えていく必要がある。それらの準備をしつつ、日本においても病理学的奏効、特にMPRやpCRについて評価できる体制を整えていく。
術前治療の位置づけ
PMDAが乳癌において検討した経過を参考にすると、肺癌学会のガイドラインにおいて、術前治療に関する記載が控えめなことが懸念される。規制当局側は、日本国内の臨床的な有用性を考える際に、ガイドラインの記載を考慮しており、肺癌学会の役割は大きい。ガイドラインの考え方としては、術前はPhase IIIで完結できたものが乏しく、PositiveとなったPhase IIIが複数存在するために術後に重きを置いている。肺癌診療ガイドラインにおいても、メタ解析の結果などもふまえ、術前治療と術後治療、双方について同等の評価を行い、アカデミアとしての情報発信を行っていく必要がある。
術前治療による薬剤承認の在り方
5年から10年のスパンで、周術期治療の標準治療が世界的に変わってくることが予測される。それに対応するために、日本での取り組み(臨床試験、アカデミアとPMDAの対話等)が必要となる。条件付き早期承認の制度は、海外と日本で状況が異なっている。いったん承認されたあとに、検証的な試験でよい結果が得られなかった場合、その薬剤の承認を取り消す、承認整理が日本で本当にできるのか、懸念がある。そのため、承認段階で厳密に評価してしっかりと世に送り出したいという動因が働く。そのため、術前治療においてもPhase IIIとは言わないまでも、十分な臨床的な有用性を構築することが重要である。近年運用されている最適使用推進ガイドラインで対象から外すということ等も今後は検討の余地があるかもしれない。
日本肺癌学会としての取り組み
病理学的奏効について日本からもエビデンスを創出するために、術前治療を受けた患者について、レトロスペクティブに病理学的奏効と治療経過についてのデータを集めることがひとつの方法となりうる。病理側としては、特定の切り出し方法を踏襲している施設であれば、レトロの研究でも一定の質の病理学的奏効のデータを示すことができる可能性があると考えている。IASLCにおいてもGlobalな病理学的奏効の評価に関するガイダンスを出す方向であり、そちらに基づいて国内症例で検討することは意義がある。そういった解析に基づき、まずは肺癌学会で患者レベルのサロガシーを確認することが望ましい。肺癌学会の病理委員会等でも検討する必要がある。

作成:2021/5/10 17:19:22 haigan 更新:2021/7/2 10:58:27 haigan
