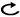1
Ⅱ.非小細胞肺癌
1-1.手術適応
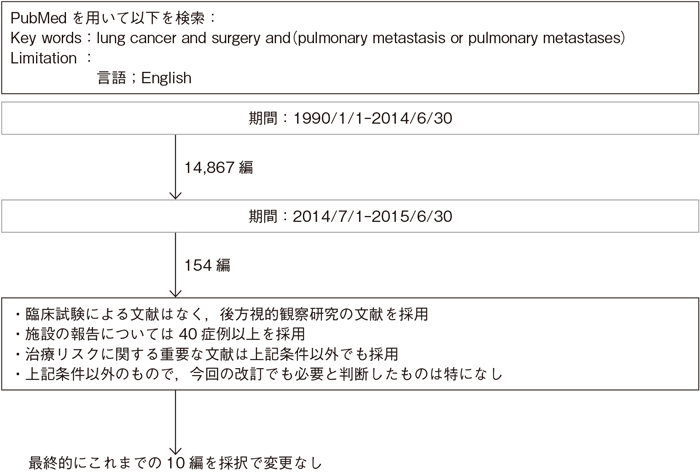
文献検索と採択
(術前呼吸機能・循環器機能評価)

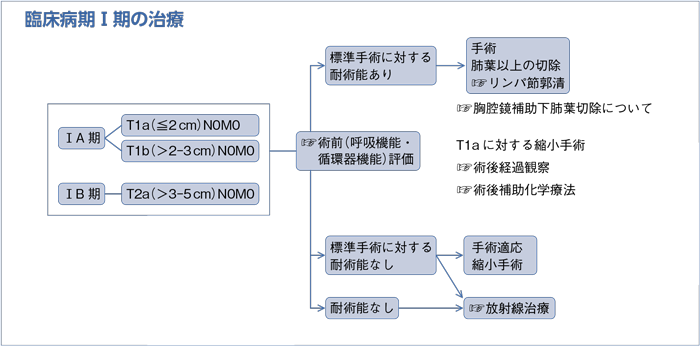
(臨床病期Ⅰ-Ⅱ期)

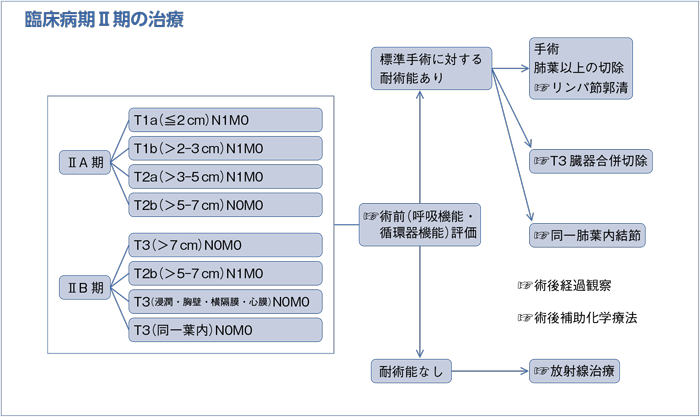
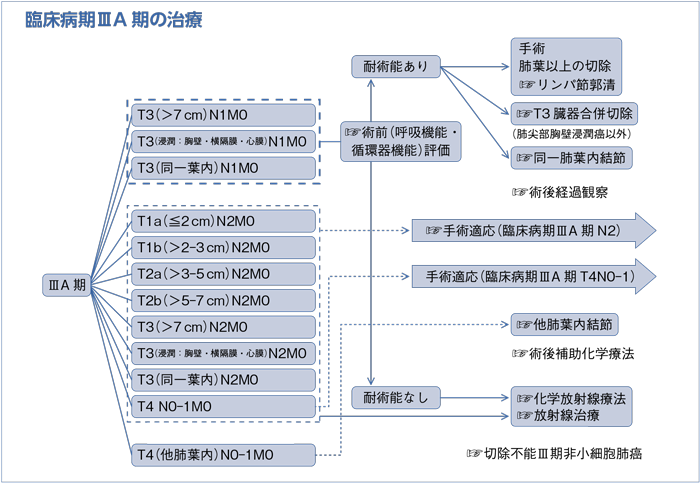
(臨床病期ⅢA期)

樹形図
- 推 奨
- 手術適応の決定には,以下の基本的な心肺機能検査をはじめ,血液・生化学所見や年齢などを総合的に評価・検討することが必要である。
a.呼吸機能評価(spirometry)(グレードA)
b.循環器機能評価(安静時心電図)(グレードA)
- a.
- 呼吸機能検査のspirometryは,拘束性障害や閉塞性障害を評価する方法として確立されている。術前肺機能評価と肺切除後のmortality,morbidityの関連については,1986年の海外からの報告があり1),その他にも術前肺機能評価との関連は検討されている2)が,単一の普遍的な指標はない。術後呼吸機能の評価として,術前呼吸機能評価(spirometry)と肺血流シンチグラフィや肺区域数を用いての予測術後肺機能は,術後実測値と良い相関を示したとの報告があり,術後予測1秒量(predicted postoperative FEV1.0;ppoFEV1.0)≧800 mlなどの指標が参考値として用いられている3)4)。さらに,ppo%FEV1.0およびppo%DLcoと術後の長期予後の強い相関を示した報告もある5)。リスク評価としては,① pre%FEV1.0,pre%DLco,② ppo%FEV1.0,ppo%DLco,③運動負荷試験を指標にアルゴリズムを示した報告がある6)。
- b.
- 術前検査としての循環器機能検査,特に安静時心電図については,基本的な機能評価として一般的に行われており,症例に応じて種々の負荷試験や超音波検査(心,血管など)などが行われている。これを推奨する根拠となる臨床試験はないものの,肺癌合同登録委員会の2004年手術例の調査では,併存疾患として負荷心電図陽性の虚血性心疾患を2.8%に認め,術後合併症として不整脈を3.3%に認めている7)。
このように,呼吸機能検査と安静時心電図については,臨床的有用性が高く,術前検査として不可欠である。
- 推 奨
a.臨床病期Ⅰ-Ⅱ期非小細胞肺癌で外科切除可能な患者には外科切除を行うよう勧められる。(グレードA)
b.臨床病期Ⅰ-Ⅱ期非小細胞肺癌で外科切除可能な患者に対する術式は,肺葉以上の切除を行うよう勧められる。(グレードA)
c.臨床病期ⅠA期,最大腫瘍径2 cm以下の非小細胞肺癌に対して,画像所見,病変の位置などを勘案したうえで縮小切除(区域切除または楔状切除)を行うことを考慮してもよい。(グレードC1)
d.臨床病期Ⅰ期非小細胞肺癌で外科切除が可能であるが肺葉以上の切除が不可能な患者には,縮小切除(区域切除または楔状切除)を行うことを考慮してもよい。(グレードC1)
- a.
- 臨床病期Ⅰ-Ⅱ期非小細胞肺癌に対して外科治療を放射線治療,または化学療法と無作為比較した臨床試験は報告されていない。外科治療が最も肺癌の治癒をもたらす治療であると考えられているのはこれまでの多くの後方視的研究による1)~3)。肺癌外科切除11,663例の検討によれば,全体の5年生存割合は69.6%であり,臨床病期ⅠA,ⅠB,ⅡA,ⅡB期ではそれぞれ82.0%,66.1%,54.5%,46.1%であった3)。最近の報告では定位照射と手術の比較が報告されているが,結果に一定の見解をみず,今後の検討が待たれる4)~6)。
- b.
- 米国Lung Cancer Study Groupによって臨床病期Ⅰ期非小細胞肺癌に対する肺葉切除と縮小切除を比較したランダム化比較試験が1995年に報告された7)。この研究によると肺葉切除に比べて縮小切除は局所再発が3倍となり,予後不良の傾向が認められた。人工呼吸器を要する呼吸不全などの重症合併症は肺葉切除に多かったものの,結論としては臨床病期Ⅰ期非小細胞肺癌に対する至適術式は肺葉切除であるとされた。肺葉切除と縮小切除の間で比較された手術死亡率に関する3,270例の外科切除例の検討では,両者に差は認められなかった8)。肺葉切除と区域切除を比較した最近の報告において短期的,長期的成績が同等であると報告されている9)。メタアナリシスでは肺葉切除が区域切除に予後の観点から勝る結果であったが,stageⅠAに限定すれば,同等であると報告された10)。Japan Clinical Oncology Group(JCOG)において縮小切除に関する2つの臨床試験がすでに終了した。第一の試験は胸部CT上,GGOを主体とする画像上の早期肺癌に対する広範囲楔状切除の妥当性を検証するもので,最終解析が行われている。第二の試験は2 cm以下の肺癌に対する肺葉切除と区域切除の無作為比較,第Ⅲ相試験で数年後に最終解析である。いずれの結果も公表が待たれるところである。
- c.
- 臨床病期Ⅰ期非小細胞肺癌に対する標準術式は肺葉切除であるが,これまでに2 cm以下の腫瘍径である肺癌に対して縮小切除を行った研究が報告されている。1つのメタアナリシスでは肺葉切除に対して縮小切除後の予後は劣らないとしているが,それぞれの報告の対象にばらつきがあり,結果に対する解釈に注意するよう結論付けられている11)。2 cm以下の肺癌に対する区域切除55例の報告では,5年生存割合81.8%,局所再発率4%と報告された12)。無作為ではないものの大規模な研究として567例の2 cm以下の肺癌に対して肺葉切除と縮小切除(主に区域切除)を比較したものがある13)。305例の縮小切除群のうち術中にリンパ節転移が認められるか,非完全切除に終わるかなどによって一部の症例は肺葉切除に転換され,その結果230例が縮小切除群に終わった。肺葉切除群と縮小切除群の局所再発と5年生存割合はそれぞれ6.9%,4.9%,そして89.6%,89.1%とほぼ同等の成績であった。また胸部CT上,広範囲にスリガラス濃度を呈する肺癌は病理学的に非浸潤癌であることが報告されており14),この対象に縮小切除を適応する研究も報告されている15)16)。これらスリガラス濃度を呈する肺癌は局所浸潤性に乏しく,縮小切除の中でも広範囲楔状切除でも極めて良好な予後が報告されている。一方で手術後5年以降に局所再発をきたした例も報告されており,現時点ではこれらの対象に縮小切除を適応するに十分な根拠はない17)。米国の肺癌切除例807,748例についての1988~1997年,1998~2004年,2005~2008年の3期間における検討では,縮小切除の生存が改善しているとの報告もある18)。
- d.
- 臨床病期Ⅰ期の非小細胞肺癌で術後1秒率40%以下である低肺機能患者に対して縮小切除を行った報告によれば,32例と症例は少ないものの,肺葉切除とほぼ同等の局所再発率と予後であった19)。95例の肺葉切除不能例に対する非外科治療に関する研究では,縮小切除または放射線治療を行うことで,3年生存割合65%と報告された20)。また同じ縮小切除でも広範囲楔状切除は区域切除などの解剖学的切除に比べて術後合併症が少ないことも報告されている21)。
- 推 奨
a.臨床病期ⅢA期非小細胞肺癌の治療方針は呼吸器外科医を含めた集学的治療グループで検討するよう勧められる。(グレードA)
b.臨床病期ⅢA期N2非小細胞肺癌の診断は組織学的に確認するよう勧められる。(グレードB)
c.臨床病期ⅢA期N2非小細胞肺癌に対して外科切除単独療法を行うよう勧められる科学的根拠が明確でない。(グレードC2)
d.臨床病期ⅢA期N2非小細胞肺癌に対して導入療法後に外科切除を行うことを考慮してもよい。(グレードC1)
- a.
- 臨床病期ⅢAは様々な集団に予後の観点から分けることができる母集団であり,その治療方針決定のためには呼吸器外科医を含む集学的治療チームによる治療方針の決定が勧められる1)。
- b.
- 大規模な後方視的研究で11,663例の肺癌切除例に関する検討が行われた2)3)。このうち800例が臨床病期ⅢA期N2非小細胞肺癌と診断されたが,病理学的にN2と診断された症例は436例(54.5%)にとどまった。病理学的にN0,N1と診断された症例はそれぞれ271例(34%),75例(9%)であった。つまり,およそ44%の症例では臨床病期N2というのがoverdiagnosisであったことになる。cN0-1であれば遠隔転移がない可能性が高く,少なからず外科切除の恩恵を被る可能性の高い集団である。したがってN2の組織学的診断をつけることが勧められる。
- c.
- 臨床病期ⅢA期N2非小細胞肺癌に対する外科治療単独により得られる5年生存割合は6~15%と報告されている4)~9)。導入化学療法後の手術において有意に予後が改善するという報告もある9)。一方で臨床病期ⅢA期N2非小細胞肺癌に対する化学放射線療法では同時照射の場合5年生存割合は16%10),最近の別の研究では17.5~19.8%と報告されており11),外科治療の単独適応は勧めるだけの根拠はない。
- d.
- ⅢA期N2非小細胞肺癌に対して外科切除を行う意義に関して北米で研究がなされた。化学放射線療法のあとに外科切除を加える群と加えない群を無作為に比較したものである12)。Primary endpointである全生存割合においていずれの研究でも外科切除によって改善を認めなかった。このため集学的治療に外科切除を加えることに明確な根拠はないといえる。North America Intergroup 0139では導入化学放射線療法後の外科切除は高い局所制御率を示したものの,致死的な合併症が多く,結果的に化学放射線療法群と同等の生存割合であった。しかしながらその後の探索的検討によると肺葉切除で完全切除された集団では予後良好の傾向が認められた12)。米国National Cancer Database(NCD)の83,913例のstage ⅢA N2非小細胞肺癌の治療成績に関する報告では,外科切除を含んだ集学的治療がそのほかの外科を含まない治療に比べて予後は良好であった13)。また別のNCDに基づく11,242例のⅢA N2非小細胞肺癌に関する報告では各種集学的治療の中で術前化学放射線療法後の肺葉切除群が予後良好であるとされた14)。同様の結果が後ろ向き研究でも報告されている15)。最近報告されたメタアナリシスでは集学的治療における外科切除を加える意義を報告している16)。
導入療法としての化学療法に関してはその有効性がメタアナリシスで示されている17)。Swissのグループが行った術前化学療法と術前化学放射線療法との無作為比較試験で予後に差を認めなかった18)。
術前呼吸機能・循環器機能評価
- 1)Gass GD, Olsen GN. Preoperative pulmonary function testing to predict postoperative morbidity and mortality. Chest. 1986; 89(1): 127-35. (IV)
- 2)Puri V, Crabtree TD, Bell JM, et al. National cooperative group trials of“high-risk”patients with lung cancer: are they truly“high-risk”? Ann Thorac Surg. 2014; 97(5): 1678-83; discussion 1683-5. (IV)
- 3)Olsen GN, Block AJ, Tobias JA. Prediction of postpneumonectomy pulmonary function using quantitative macroaggregate lung scanning. Chest. 1974; 66(1): 13-6. (IV)
- 4)Wernly JA, DeMeester TR, Kirchner PT, et al. Clinical value of quantitative ventilation-perfusion lung scans in the surgical management of bronchogenic carcinoma. J Thorac Cardiovasc Surg. 1980; 80(4): 535-43. (IV)
- 5)Ferguson MK, Watson S, Johnson E, et al. Predicted postoperative lung function is associated with all-cause long-term mortality after major lung resection for cancer. Eur J Cardiothorac Surg. 2014; 45(4): 660-4. (IV)
- 6)Sawabata N, Nagayasu T, Kadota Y, et al. Risk assessment of lung resection for lung cancer according to pulmonary function: republication of systematic review and proposals by guideline committee of the Japanese association for chest surgery 2014. Gen Thorac Cardiovasc Surg. 2015; 63(1): 14-21. (I)
- 7)Sawabata N, Fujii Y, Asamura H, et al. Lung cancer in Japan: Analysis of lung cancer registry cases resected in 2004. Nihon Kokyuki Gakkai Zasshi. 2011; 49(4): 327-42. (IV)
臨床病期Ⅰ-Ⅱ期
- 1)Asamura H, Goya T, Koshiishi Y, et al. A Japanese Lung Cancer Registry study: prognosis of 13,010 resected lung cancers. J Thorac Oncol. 2008; 3(1): 46-52. (IV)
- 2)Goya T, Asamura H, Yoshimura H, et al. Prognosis of 6644 resected non-small cell lung cancers in Japan: A Japanese lung cancer registry study. Lung Cancer. 2005; 50(2): 227-34. (IV)
- 3)Sawabata N, Miyaoka E, Asamura H, et al. Japanese lung cancer registry study of 11,663 surgical cases in 2004: demographic and prognosis changes over decade. J Thorac Oncol. 2011; 6(7): 1229-35. (IV)
- 4)Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stageⅠ non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol. 2015; 16(6): 630-7.
- 5)Hamaji M, Chen F, Matsuo Y, et al. Video-assisted thoracoscopic lobectomy versus stereotactic radiotherapy for stageⅠ lung cancer. Ann Thorac Surg. 2015; 99(4): 1122-9.
- 6)Shirvani SM, Jiang J, Chang JY, et al. Lobectomy, sublobar resection, and stereotactic ablative radiotherapy for early-stage non-small cell lung cancers in the elderly. JAMA Surg. 2014; 149(12): 1244-53.
- 7)Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg. 1995; 60(3): 615-22; discussion 622-3. (II)
- 8)Watanabe S, Asamura H, Suzuki K, et al. Recent results of postoperative mortality for surgical resections in lung cancer. Ann Thorac Surg. 2004; 78(3): 999-1002. (IV)
- 9)Landreneau RJ, Normolle DP, Christie NA, et al. Recurrence and survival outcomes after anatomic segmentectomy versus lobectomy for clinical stageⅠ non-small-cell lung cancer: a propensity-matched analysis. J Clin Oncol. 2014; 32(23): 2449-55. (IV)
- 10)Zhang L, Li M, Yin R, et al. Comparison of the oncologic outcomes of anatomic segmentectomy and lobectomy for early-stage non-small cell lung cancer. Ann Thorac Surg. 2015; 99(2): 728-37. (I)
- 11)Nakamura H, Kawasaki N, Taguchi M, et al. Survival following lobectomy vs limited resection for stageⅠ lung cancer: a meta-analysis. Br J Cancer. 2005; 92(6): 1033-7. (I)
- 12)Tsubota N, Ayabe K, Doi O, et al. Ongoing prospective study of segmentectomy for small lung tumors. Study Group of Extended Segmentectomy for Small Lung Tumor. Ann Thorac Surg. 1998; 66(5): 1787-90. (IV)
- 13)Okada M, Koike T, Higashiyama M, et al. Radical sublobar resection for small-sized non-small cell lung cancer: a multicenter study. J Thorac Cardiovasc Surg. 2006; 132(4): 769-75. (III)
- 14)Suzuki K, Koike T, Asakawa T, et al. A prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer(Japan Clinical Oncology Group 0201). J Thorac Oncol. 2011; 6(4): 751-6. (IV)
- 15)Yamato Y, Tsuchida M, Watanabe T, et al. Early results of a prospective study of limited resection for bronchioloalveolar adenocarcinoma of the lung. Ann Thorac Surg. 2001; 71(3): 971-4. (IV)
- 16)Yoshida J, Nagai K, Yokose T, et al. Limited resection trial for pulmonary ground-glass opacity nodules: fifty-case experience. J Thorac Cardiovasc Surg. 2005; 129(5): 991-6. (IV)
- 17)Yoshida J, Ishii G, Yokose T, et al. Possible delayed cut-end recurrence after limited resection for ground-glass opacity adenocarcinoma, intraoperatively diagnosed as Noguchi type B, in three patients. J Thorac Oncol. 2010; 5(4): 546-50. (IV)
- 18)Yendamuri S, Sharma R, Demmy M, et al. Temporal trends in outcomes following sublobar and lobar resections for small(≤2 cm)non-small cell lung cancers--a Surveillance Epidemiology End Results database analysis. J Surg Res. 2013; 183(1): 27-32. (IV)
- 19)Martin-Ucar AE, Nakas A, Pilling JE, et al. A case-matched study of anatomical segmentectomy versus lobectomy for stageⅠ lung cancer in high-risk patients. Eur J Cardiothorac Surg. 2005; 27(4): 675-9. (III)
- 20)Hsie M, Morbidini-Gaffney S, Kohman LJ, et al. Definitive treatment of poor-risk patients with stageⅠ lung cancer: a single institution experience. J Thorac Oncol. 2009; 4(1): 69-73. (III)
- 21)Linden PA, D’Amico TA, Perry Y, et al. Quantifying the safety benefits of wedge resection: a society of thoracic surgery database propensity-matched analysis. Ann Thorac Surg. 2014; 98(5): 1705-11; discussion 1711-2.
臨床病期ⅢA期
- 1)Ruckdeschel JC. Combined modality therapy of non-small cell lung cancer. Semin Oncol. 1997; 24(4): 429-39. (IV)
- 2)Sawabata N, Miyaoka E, Asamura H, et al. Japanese lung cancer registry study of 11,663 surgical cases in 2004: demographic and prognosis changes over decade. J Thorac Oncol. 2011; 6(7): 1229-35. (IV)
- 3)Yoshino I, Yoshida S, Miyaoka E, et al. Surgical outcome of stage ⅢA- cN2/pN2 non-small-cell lung cancer patients in Japanese lung cancer registry study in 2004. J Thorac Oncol. 2012; 7(5): 850-5. (IV)
- 4)Andre F, Grunenwald D, Pignon JP, et al. Survival of patients with resected N2 non-small-cell lung cancer: evidence for a subclassification and implications. J Clin Oncol. 2000; 18(16): 2981-9. (IV)
- 5)Martini N, Flehinger BJ, Zaman MB, et al. Results of resection in non-oat cell carcinoma of the lung with mediastinal lymph node metastases. Ann Surg. 1983; 198(3): 386-97. (IV)
- 6)Naruke T, Goya T, Tsuchiya R, et al. The importance of surgery to non-small cell carcinoma of lung with mediastinal lymph node metastasis. Ann Thorac Surg. 1988; 46(6): 603-10. (IV)
- 7)Pearson FG, DeLarue NC, Ilves R, et al. Significance of positive superior mediastinal nodes identified at mediastinoscopy in patients with resectable cancer of the lung. J Thorac Cardiovasc Surg. 1982; 83(1): 1-11. (IV)
- 8)Suzuki K, Nagai K, Yoshida J, et al. The prognosis of surgically resected N2 non-small cell lung cancer: the importance of clinical N status. J Thorac Cardiovasc Surg. 1999; 118(1): 145-53. (IV)
- 9)Okada M, Tsubota N, Yoshimura M, et al. Induction therapy for non-small cell lung cancer with involved mediastinal nodes in multiple stations. 2000. Chest. 2009; 136(5 Suppl): e30. (IV)
- 10)Furuse K, Fukuoka M, Kawahara M, et al. Phase Ⅲ study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage Ⅲ non-small-cell lung cancer. J Clin Oncol. 1999; 17(9): 2692-9. (II)
- 11)Yamamoto N, Nakagawa K, Nishimura Y, et al. Phase Ⅲ study comparing second- and third-generation regimens with concurrent thoracic radiotherapy in patients with unresectable stage Ⅲ non-small-cell lung cancer: West Japan Thoracic Oncology Group WJTOG0105. J Clin Oncol. 2010; 28(23): 3739-45. (II)
- 12)Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small-cell lung cancer: a phase Ⅲ randomised controlled trial. Lancet. 2009; 374(9687): 379-86. (II)
- 13)Hancock J, Rosen J, Moreno A, et al. Management of clinical stage ⅢA primary lung cancers in the National Cancer Database. Ann Thorac Surg. 2014; 98(2): 424-32. (IV)
- 14)Koshy M, Fedewa SA, Malik R, et al. Improved survival associated with neoadjuvant chemoradiation in patients with clinical stage ⅢA(N2)non-small-cell lung cancer. J Thorac Oncol. 2013; 8(7): 915-22. (III)
- 15)Aggarwal C, Li L, Borghaei H, et al. Multidisciplinary therapy of stage ⅢA non-small-cell lung cancer: long-term outcome of chemoradiation with or without surgery. Cancer Control. 2014; 21(1): 57-62. (IV)
- 16)McElnay PJ, Choong A, Jordan E, et al. Outcome of surgery versus radiotherapy after induction treatment in patients with N2 disease: systematic review and meta-analysis of randomised trials. Thorax. 2015; 70(8): 764-8. (I)
- 17)NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. 2014; 383(9928): 1561-71. (II)
- 18)Pless M, Stupp R, Ris HB, et al; SAKK Lung Cancer Project Group. Induction chemoradiation in stage ⅢA/N2 non-small-cell lung cancer: a phase 3 randomised trial. Lancet. 2015; 386(9998): 1049-56. (II)
1-2.リンパ節郭清
文献検索と採択

- 推 奨
- 切除可能な非小細胞肺癌に対しては,肺門縦隔リンパ節の郭清を行い,病理学的評価を行うように勧められる。(グレードB)
リンパ節郭清とサンプリングを比較したランダム化試験1)~3)を引用した848例の小規模なメタアナリシスの結果,リンパ節郭清による予後の改善が証明された(HR 0.78,95%CI:0.65-0.93)4)。しかし,最近発表されたAmerican College of Surgery Oncology Group(ACOSOG)がT1-2N0-1(肺門部リンパ節を除く)症例を対象に行った系統的リンパ節郭清とサンプリングのランダム化比較試験では,系統的リンパ節郭清群vs系統的サンプリング群の生存期間中央値と無再発5年生存率はそれぞれ,8.5年vs 8.1年,68%vs 69%で,系統的リンパ節郭清による有意な改善は認められなかった5)。また系統的リンパ節郭清の手術時間はサンプリングに比べ,15分程度長いに過ぎず,術後の合併症発生率や手術関連死亡率にも差がなかった6)。さらに近年発表された,ACOSOGのランダム化比較試験を含めたメタアナリシスでは,全生存率,局所再発率,遠隔転移率,合併症発生率で有意差を認めていない7)。しかしながら,各試験において,症例数や試験デザインに議論の余地があり,リンパ節郭清の予後に与える影響については科学的根拠が明確であるとはいえない。また近年,国内で広く行われているLobe-specific lymph node dissection(いわゆる選択的リンパ節郭清)については,単一施設からの非無作為比較研究結果が報告されているが8)9),前向き比較試験がなく,その妥当性についての科学的根拠は十分とはいえない。
一方,ACOSOGのランダム化比較試験にてサンプリングではN2の4%が見落とされており6),正確な病理病期の決定のためにはリンパ節郭清を行うように勧められるためグレードBとした。
- 1)Izbicki JR, Passlick B, Pantel K, et al. Effectiveness of radical systematic mediastinal lymphadenectomy in patients with resectable non-small cell lung cancer: results of a prospective randomized trial. Ann Surg. 1998; 227(1): 138-44. (II)
- 2)Sugi K, Nawata K, Fujita N, et al. Systematic lymph node dissection for clinically diagnosed peripheral non-small-cell lung cancer less than 2 cm in diameter. World J Surg. 1998; 22(3): 290-4. (II)
- 3)Wu Yl, Huang ZF, Wang SY, et al. A randomized trial of systematic nodal dissection in resectable non-small cell lung cancer. Lung Cancer. 2002; 36(1): 1-6. (II)
- 4)Wright G, Manser RL, Byrnes G, et al. Surgery for non-small cell lung cancer: systematic review and meta-analysis of randomised controlled trials. Thorax. 2006; 61(7): 597-603. (I)
- 5)Darling GE, Allen MS, Decker PA, et al. Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1(less than hilar)non-small cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg. 2011; 141(3): 662-70. (II)
- 6)Allen MS, Darling GE, Pechet TT, et al. Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer: initial results of the randomized, prospective ACOSOG Z0030 trial. Ann Thorac Surg. 2006; 81(3): 1013-9. (II)
- 7)Huang X, Wang J, Chen Q, et al. Mediastinal lymph node dissection versus mediastinal lymph node sampling for early stage non-small cell lung cancer: a systematic review and meta-analysis. PLoS One. 2014; 9(10): e109979. (I)
- 8)Okada M, Sakamoto T, Yuki T, et al. Selective mediastinal lymphadenectomy for clinico-surgical stageⅠ non-small cell lung cancer. Ann Thorac Surg. 2006; 81(3): 1028-32. (IV)
- 9)Ishiguro F, Matsuo K, Fukui T, et al. Effect of selective lymph node dissection based on patterns of lobe-specific lymph node metastases on patient outcome in patients with resectable non-small cell lung cancer: a large-scale retrospective cohort study applying a propensity score. J Thorac Cardiovasc Surg. 2010; 139(4): 1001-6. (IV)
1-3.T3臓器合併切除(肺尖部胸壁浸潤癌以外)
文献検索と採択

- 推 奨
a.臨床病期T3N0-1M0の胸壁浸潤非小細胞肺癌には,胸壁合併切除術を行うよう勧められる。(グレードB)
b.横隔膜,心膜に浸潤した臨床病期T3N0-1M0非小細胞肺癌には,それぞれの合併切除を行うことを考慮してもよい。(グレードC1)
- a.
- 肺癌取扱い規約(第7版,2010年)には,胸壁浸潤はpT3a:壁側胸膜まで浸潤,pT3b:胸内筋膜まで浸潤,pT3c:肋骨または胸壁軟部組織まで浸潤,と区別されており,胸壁合併切除術には壁側胸膜切除術と骨性胸壁切除術がある。胸壁合併切除術の手術死亡率は0~7.8%で1)~6),合併症発生率は19~44%と報告されている1)~3)。胸壁合併切除術を施行した肺癌の予後因子として,完全切除,リンパ節転移,胸壁浸潤の程度が挙げられている。完全切除症例は不完全切除症例より予後が良好である3)~6)。胸壁浸潤肺癌334例の検討で,完全切除例(n=175)の5年生存率が32%であったのに対し,非完全切除例(n=94)では4%と報告されている4)。完全切除可能であれば壁側胸膜切除と骨性胸壁切除の差はないとする報告が多い3)4)7)8)。リンパ節転移に関しては,pN0症例の5年生存率は25~67%であるのに対し,pN1では症例数が少ないものの20~100%,pN2症例では6.2~20.5%と報告されている1)~8)。日本肺癌登録合同委員報告では胸壁浸潤407例の5年生存率はpN0 49.1%(n=299),pN1 36.5%(n=43),pN2 20.5%(n=65)で,pN2がpN0に比較して有意に予後不良であった8)。胸壁浸潤の程度に関しては,壁側胸膜のみの浸潤例が胸壁軟部組織や骨性胸郭浸潤例より良好であるという報告もあるが1)5),pN0症例では胸壁浸潤の程度は予後に影響しない報告されている8)。なお,上記文献はいずれも術後病理病期で記載されており,臨床病期で検討されている論文はない。本症を対象とした手術以外の治療法との直接の比較試験はないが,他の治療法との差異は明かであるため臨床病期T3N0-1M0症例の胸壁合併切除術は推奨グレードBとした。ただし,縦隔リンパ節転移を有すると考えられる症例,特に術前病理検査にてN2と判明した症例については,その予後不良が予測されることより,手術単独療法は施行すべきではない。
- b.
- 横隔膜合併切除例の5年生存率は19~42.6%であり8)~11),手術死亡率は1.6~4.4%10)12),合併症発生率は14.7%と報告されている12)。横隔膜切除術を施行した肺癌の予後に影響する因子として,完全切除10)12),リンパ節転移の有無9)10)がある。JCOG肺癌外科グループの報告では,完全切除例の5年生存率は22.6%であったのに対し,非完全切除例では0%,またリンパ節転移に関しては,pN0の5年生存率は28%であるのに対して,pN1では20%,pN2では0%であった10)。最近の日本肺癌登録合同委員報告では横隔膜浸潤31例の5年生存率は42.6%,pN0(n=22)で55.0%と比較的良好であった8)。心膜合併切除例の5年生存率は15.1~54.2%であり8)11)13),pT3に限れば比較的良好な報告もある。しかし91例の心膜浸潤症例の後方視的研究では,全体の5年生存率15.1%と予後不良であった13)。うち32例が心膜単独浸潤(T3)で59例は肺静脈,心房浸潤(T4)を伴っていたが,T3,T4間に予後の差を認めなかった。N0は12例(13.2%)N1は31例(34.1%),N2は48例(52.8%)と,心膜浸潤症例ではリンパ節転移の頻度が極めて高く,肺全摘の頻度も高かった。なお,上記文献はいずれも術後病理病期で記載されており,臨床病期で検討されている論文はない。臨床病期T3N0-1M0横隔膜,心膜浸潤肺癌切除例の予後は,最近の報告で改善はみられるものの依然不良であり,推奨グレードはC1とした。ただし,縦隔リンパ節転移を有すると考えられる症例,特に術前病理検査にてN2と判明した症例については,その予後不良が予測されることより,手術単独療法は施行すべきではない。
- 1)Facciolo F, Cardillo G, Lopergolo M, et al. Chest wall invasion in non-small cell lung carcinoma: a rationale for en bloc resection. J Thorac Cardiovasc Surg. 2001; 121(4): 649-56. (IV)
- 2)Burkhart HM, Allen MS, Nichols FC 3rd, et al. Results of en bloc resection for bronchogenic carcinoma with chest wall invasion. J Thorac Cardiovasc Surg. 2002; 123(4): 670-5. (IV)
- 3)Matsuoka H, Nishio W, Okada M, et al. Resection of chest wall invasion in patients with non-small cell lung cancer. Eur J Cardiothorac Surg. 2004; 26(6): 1200-4. (IV)
- 4)Downey RJ, Martini N, Rusch VW, et al. Extent of chest wall invasion and survival in patients with lung cancer. Ann Thorac Surg. 1999; 68(1): 188-93. (IV)
- 5)Magdeleinat P, Alifano M, Benbrahem C, et al. Surgical treatment of lung cancer invading the chest wall: results and prognostic factors. Ann Thorac Surg. 2001; 71(4): 1094-9. (IV)
- 6)Pitz CC, Brutel de la Rivière A, Elbers HR, et al. Surgical treatment of 125 patients with non-small cell lung cancer and chest wall involvement. Thorax. 1996; 51(8): 846-50. (IV)
- 7)Doddoli C, D’Journo B, Le Pimpec-Barthes F, et al. Lung cancer invading the chest wall: a plea for en-bloc resection but the need for new treatment strategies. Ann Thorac Surg. 2005; 80(6): 2032-40. (IV)
- 8)Kawaguchi K, Miyaoka E, Asamura H, et al. Modern surgical results of lung cancer involving neighboring structures: a retrospective analysis of 531 pT3 cases in a Japanese Lung Cancer Registry Study. J Thorac Cardiovasc Surg. 2012; 144(2): 431-7. (IV)
- 9)Rocco G, Rendina EA, Meroni A, et al. Prognostic factors after surgical treatment of lung cancer invading the diaphragm. Ann Thorac Surg. 1999; 68(6): 2065-8. (IV)
- 10)Yokoi K, Tsuchiya R, Mori T, et al. Results of surgical treatment of lung cancer involving the diaphragm. J Thorac Cardiovasc Surg. 2000; 120(4): 799-805. (IV)
- 11)Sakakura N, Mori S, Ishiguro F, et al. Subcategorization of resectable non-small cell lung cancer involving neighboring structures. Ann Thorac Surg. 2008; 86(4): 1076-83. (IV)
- 12)Riquet M, Porte H, Chapelier A, et al. Resection of lung cancer invading the diaphragm. J Thorac Cardiovasc Surg. 2000; 120(2): 417-8. (IV)
- 13)Riquet M, Grand B, Arame A, et al. Lung cancer invading the pericardium: quantum of lymph nodes. Ann Thorac Surg. 2010; 90(6): 1773-7. (IV)
1-4.気管支・肺動脈形成
文献検索と採択

- 推 奨
- 気管支・肺動脈形成が可能であれば,肺全摘を避けるために行うよう勧める。(グレードB)
Wedge切除の局所再発率は8.9%,BPFは1.6%,術死は3.7%で管状切除と変わらないとの報告がある9)。
肺動脈形成は単独および気管支形成同時であっても,安全性・有効性が報告されている6)8)10)~12)。
肺全摘を避けるために行う複雑気管支形成術の有効性も報告されている7)13)~15)。
Induction後の気管支形成の安全性・有効性が報告されている15)~18)。術前化学療法群15)~18)と化学放射線療法群15)16)と通常の気管支形成群との比較で,術死亡,術後合併症,また吻合部合併症に差がないという報告がある15)~18)。また予後に関しては,Induction群で全摘症例やInductionのない症例より良好という報告がある17)18)。術前放射線治療が術死,吻合合併症に影響したという報告もある6)。
- 1)Deslauriers J, Grégoire J, Jacques LF, et al. Sleeve lobectomy versus pneumonectomy for lung cancer: a comparative analysis of survival and sites or recurrences. Ann Thorac Surg. 2004; 77(4): 1152-6. (IV)
- 2)Ludwig C, Stoelben E, Olschewski M, et al. Comparison of morbidity, 30-day mortality, and long-term survival after pneumonectomy and sleeve lobectomy for non-small cell lung carcinoma. Ann Thorac Surg. 2005; 79(3): 968-73. (IV)
- 3)Berry MF, Worni M, Wang X, et al. Sleeve lobectomy for non-small cell lung cancer with N1 nodal disease does not compromise survival. Ann Thorac Surg. 2014; 97(1): 230-5. (IV)
- 4)Zhao LL, Zhou FY, Dai CY, et al. Prognostic analysis of the bronchoplastic and broncho-arterioplastic lobectomy of non-small cell lung cancers-10-year experiences of 161 patients. J Thorac Dis. 2015; 7(12): 2288-99. (IV)
- 5)Chen C, Bao F, Zheng H, et al. Local extension at the hilum region is associated with worse long-term survival in stageⅠ non-small cell lung cancers. Ann Thorac Surg. 2012; 93(2): 389-96. (IV)
- 6)Rea F, Marulli G, Schiavon M, et al. A quarter of a century experience with sleeve lobectomy for non-small cell lung cancer. Eur J Cardiothorac Surg. 2008; 34(3): 488-92. (IV)
- 7)Yamamoto K, Miyamoto Y, Ohsumi A, et al. Sleeve lung resection for lung cancer: analysis according to the type of procedure. J Thorac Cardiovasc Surg. 2008; 136(5): 1349-56. (IV)
- 8)Nagayasu T, Matsumoto K, Tagawa T, et al. Factors affecting survival after bronchoplasty and broncho-angioplasty for lung cancer: single institutional review of 147 patients. Eur J Cardiothorac Surg. 2006; 29(4): 585-90. (IV)
- 9)Park SY, Lee HS, Jang HJ, et al. Wedge bronchoplastic lobectomy for non-small cell lung cancer as an alternative to sleeve lobectomy. J Thorac Cardiovasc Surg. 2012; 143(4): 825-831. (IV)
- 10)D’Andrilli A, Maurizi G, Andreetti C, et al. Pulmonary artery reconstruction with pulmonary vein conduit for lung cancer: medium-term results. Ann Thorac Surg. 2014; 98(3): 990-5. (IV)
- 11)Kojima F, Yamamoto K, Matsuoka K, et al. Factors affecting survival after lobectomy with pulmonary artery resection for primary lung cancer. Eur J Cardiothorac Surg. 2011; 40(1): e13-20. (IV)
- 12)Okada M, Tsubota N, Yoshimura M, et al. Extended sleeve lobectomy for lung cancer: the avoidance of pneumonectomy. J Thorac Cardiovasc Surg. 1999; 118(4): 710-3. (IV)
- 13)Okada M, Nishio W, Sakamoto T, et al. Sleeve segmentectomy for non-small cell lung carcinoma. J Thorac Cardiovasc Surg. 2004; 128(3): 420-4. (IV)
- 14)Berthet JP, Paradela M, Jimenez MJ, et al. Extended sleeve lobectomy: one more step toward avoiding pneumonectomy in centrally located lung cancer. Ann Thorac Surg. 2013; 96(6): 1988-97. (IV)
- 15)Gonzalez M, Litzistorf Y, Krueger T, et al. Impact of induction therapy on airway complications after sleeve lobectomy for lung cancer. Ann Thorac Surg. 2013; 96(1): 247-52. (IV)
- 16)Ohta M, Sawabata N, Maeda H, et al. Efficacy and safety of tracheobronchoplasty after induction therapy for locally advanced lung cancer. J Thorac Cardiovasc Surg. 2003; 125(1): 96-100. (IV)
- 17)Bagan P, Berna P, Brian E, et al. Induction chemotherapy before sleeve lobectomy for lung cancer: immediate and long-term results. Ann Thorac Surg. 2009; 88(6): 1732-5. (IV)
- 18)Maurizi G, D’Andrilli A, Anile M, et al. Sleeve lobectomy compared with pneumonectomy after induction therapy for non-small-cell lung cancer. J Thorac Oncol. 2013; 8(5): 637-43. (IV)
1-5.同一肺葉内結節
文献検索と採択
- 推 奨
- 同一肺葉内結節で転移(PM1)もしくは多発肺癌を疑うcN0症例においては,手術を行うよう勧められる。(グレードB)
肺癌登録合同委員会で登録された1994年の肺癌手術症例7,408例のうち,6,525例の非小細胞肺癌の解析(ver. 6)が行われ,同一肺葉内転移(PM1)317例,他肺葉転移(PM2)128例の予後解析が報告された1)。5年生存率は,PM0(n=6,080)55.1%に対し,PM1は26.8%,PM2は22.5%であった。PM1症例について,リンパ節転移の有無別に解析すると,N0,N1,N2症例での5年生存率は,45.8%,25.3%,11.1%であり,N0群とN1群(P=0.0176),N1群とN2群(P=0.0114)に有意差が認められた1)。同様に40例以上の解析がなされた報告では,PM1の術後5年生存率は30~58%と報告され2)~9),特にリンパ節転移陰性症例では概ね50%以上であることが報告され5)6),比較的予後が期待できる集団と考えられる。
これらは術後の病理病期での解析であるが,術前検査において同一肺葉内転移が疑われる症例において,手術の結果その結節が転移でない場合も少なからず認められ10),正確な診断のためにも手術が勧められる。また,多発癌との鑑別が困難なこともあり,リンパ節転移のない症例においては,手術を行うよう勧められる。これらは比較試験ではなく,エビデンスレベルとしてはⅣであるが,肺癌登録合同委員会から出された大規模な後方視的観察研究の臨床的有用性は高く,推奨グレードBとした。
なお,リンパ節転移を有すると考えられる症例,特に術前検査にて組織学的N2と判明した症例については,その予後不良が予測されることより,手術単独療法は施行すべきではない。
- 1)Nagai K, Sohara Y, Tsuchiya R, et al. Prognosis of resected non-small cell lung cancer patients with intrapulmonary metastases. J Thorac Oncol. 2007; 2(4): 282-6. (IV)
- 2)Fukuse T, Hirata T, Tanaka F, et al. Prognosis of ipsilateral intrapulmonary metastases in resected nonsmall cell lung cancer. Eur J Cardiothorac Surg. 1997; 12(2): 218-23. (IV)
- 3)Okumura T, Asamura H, Suzuki K, et al. Intrapulmonary metastasis of non-small cell lung cancer: a prognostic assessment. J Thorac Cardiovasc Surg. 2001; 122(1): 24-8. (IV)
- 4)Naruke T, Tsuchiya R, Kondo H, et al. Prognosis and survival after resection for bronchogenic carcinoma based on the 1997 TNM-staging classification: the Japanese experience. Ann Thorac Surg. 2001; 71(6): 1759-64. (IV)
- 5)Port JL, Korst RJ, Lee PC, et al. Surgical resection for multifocal(T4)non-small cell lung cancer: is the T4 designation valid? Ann Thorac Surg. 2007; 83(2): 397-400. (IV)
- 6)Zell JA, Ou SH, Ziogas A, et al. Survival improvements for advanced stage nonbronchioloalveolar carcinoma-type nonsmall cell lung cancer cases with ipsilateral intrapulmonary nodules. Cancer. 2008; 112(1): 136-43. (IV)
- 7)Trousse D, D’Journo XB, Avaro JP, et al. Multifocal T4 non-small cell lung cancer: a subset with improved prognosis. Eur J Cardiothorac Surg. 2008; 33(1): 99-103. (IV)
- 8)Pennathur A, Lindeman B, Ferson P, et al. Surgical resection is justified in non-small cell lung cancer patients with node negative T4 satellite lesions. Ann Thorac Surg. 2009; 87(3): 893-9. (IV)
- 9)Lee JG, Lee CY, Kim DJ, et al. Non-small cell lung cancer with ipsilateral pulmonary metastases: prognosis analysis and staging assessment. Eur J Cardiothorac Surg. 2008; 33(3): 480-4. (IV)
1-6.他肺葉内結節
文献検索と採択

- 推 奨
a.他肺葉内結節で,多発原発性肺癌を疑う症例においては,外科手術を考慮してもよい。(グレードC1)
b.他肺葉内結節で肺内転移(PM2,3)を疑う症例においては,手術を勧める科学的根拠が明確でない。(グレードC2)
- a.
- 肺癌登録合同委員会で登録された1994年の非小細胞肺癌6,525例(ver. 6)のうち,同一肺葉内転移(PM1)317例,他肺葉転移(PM2)128例の5年生存率は,PM0(n=6,080)55.1%に対し,PM1は26.8%,PM2は22.5%であった。多発肺癌と肺内転移の鑑別診断基準には,多くの論文においてMartini and Melamedの基準が用いられている1)。複数の後方視的検討で縦隔リンパ節転移がない症例については5年生存率が29~69.6%と比較的良好な成績の報告もある2)~4)。また,他肺葉内結節で,多発原発性肺癌を疑う症例においては,5年生存率が23.4~69.6%と外科手術が良好な成績を得たとの報告もある4)~6)。しかしながら,術前診断において特に同じ組織型の場合には,転移との鑑別は必ずしも容易ではない。近年の遺伝子診断技術の向上により,臨床的鑑別診断に加え,分子生物学的診断によるclonalityの評価がなされつつあるが7)~12),確立するには至っていない。
- b.
- PM2を除いたM1症例の5年生存率は20.5%であり,PM2症例と有意差は認められなかった(P=0.434)13)。また,その他の報告においても,他肺葉の肺内転移(PM2,3)の症例に対する切除成績は,PM1に比較し予後不良である報告が多く14)~16),手術を勧める科学的根拠は明確でない。
- 1)Martini N, Melamed MR. Multiple primary lung cancers. J Thorac Cardiovasc Surg. 1975; 70(4): 606-12. (IV)
- 2)Fabian T, Bryant AS, Mouhlas AL, et al. Survival after resection of synchronous non-small cell lung cancer. J Thorac Cardiovasc Surg. 2011; 142(3): 547-53. (IV)
- 3)Shah AA, Barfield ME, Kelsey CR, et al. Outcomes after surgical management of synchronous bilateral primary lung cancers. Ann Thorac Surg. 2012; 93(4): 1055-60. (IV)
- 4)Yu-YC, Hsu PK, Yeh YC, et al. Surgical results of synchronous multiple primary lung cancers: similar to the stage-matched solitary primary lung cancers? Ann Thorac Surg 2013; 96(6): 1966-74. (IV)
- 5)Jiang L, He J, Shi X, et al. Prognosis of synchronous and metachronous multiple primary lung cancers: systematic review and meta-analysis. Lung Cancer. 2015; 87(3): 303-10. (IV)
- 6)Riquet M, Cazes A, Pfeuty K, et al. Multiple lung cancers prognosis: what about histology? Ann Thorac Surg. 2008; 86(3): 921-6. (IV)
- 7)Chang YL, Wu CT, Lin SC, et al. Clonality and prognostic implications of p53 and epidermal growth factor receptor somatic aberrations in multiple primary lung cancers. Clin Cancer Res. 2007; 13(1): 52-8. (IV)
- 8)Girard N, Ostrovnaya I, Lau C, et al. Genomic and mutational profiling to assess clonal relationships between multiple non-small cell lung cancers. Clin Cancer Res. 2009; 15(16): 5184-90. (IV)
- 9)Shimizu S, Yatabe Y, Koshikawa T, et al. High frequency of clonally related tumors in cases of multiple synchronous lung cancers as revealed by molecular diagnosis. Clin Cancer Res. 2000; 6(10): 3994-9. (IV)
- 10)Huang J, Behrens C, Wistuba I, et al. Molecular analysis of synchronous and metachronous tumors of the lung: impact on management and prognosis. Ann Diagn Pathol. 2001; 5(6): 321-9. (IV)
- 11)Hiroshima K, Toyozaki T, Kohno H, et al. Synchronous and metachronous lung carcinomas: molecular evidence for multicentricity. Pathol Int. 1998; 48(11): 869-76. (IV)
- 12)Wu CT, Lin MW, Hsieh MS, et al. New aspects of the clinicopathology and genetic profile of metachronous multiple lung cancers. Ann Surg. 2014 May; 259(5): 1018-24. (IV)
- 13)Nagai K, Sohara Y, Tsuchiya R, et al. Prognosis of resected non-small cell lung cancer patients with intrapulmonary metastases. J Thorac Oncol. 2007; 2(4): 282-6. (IV)
- 14)Fukuse T, Hirata T, Tanaka F, et al. Prognosis of ipsilateral intrapulmonary metastases in resected nonsmall cell lung cancer. Eur J Cardiothorac Surg. 1997; 12(2): 218-23. (IV)
- 15)Okumura T, Asamura H, Suzuki K, et al. Intrapulmonary metastasis of non-small cell lung cancer: a prognostic assessment. J Thorac Cardiovasc Surg. 2001; 122(1): 24-8. (IV)
- 16)Zell JA, Ou SH, Ziogas A, et al. Survival improvements for advanced stage nonbronchioloalveolar carcinoma-type nonsmall cell lung cancer cases with ipsilateral intrapulmonary nodules. Cancer. 2008; 112(1): 136-43. (IV)
1-7.異時性多発癌
文献検索と採択

- 推 奨
- 異時性多発肺癌に対しては,耐術能があれば外科治療を考慮してよい。(グレードC1)
- 1)Lee BE, Port JL, Stiles BM, et al. TNM stage is the most important determinant of survival in metachronous lung cancer. Ann Thorac Surg. 2009; 88(4): 1100-5. (IV)
- 2)Yang J, Liu M, Fan J, et al. Surgical treatment of metachronous second primary lung cancer. Ann Thorac Surg. 2014; 98(4): 1192-8. (IV)
- 3)Riquet M, Cazes A, Pfeuty K, et al. Multiple lung cancers prognosis: what about histology? Ann Thorac Surg. 2008; 86(3): 921-6. (IV)
- 4)Battafarano RJ, Force SD, Meyers BF, et al. Benefits of resection for metachronous lung cancer. J Thorac Cardiovasc Surg. 2004; 127(3): 836-42. (IV)
- 5)Zuin A, Andriolo LG, Marulli G, et al. Is lobectomy really more effective than sublobar resection in the surgical treatment of second primary lung cancer? Eur J Cardiothorac Surg. 2013; 44(2): e120-5. (IV)
- 6)Jiang L, He J, Shi X, et al. Prognosis of synchronous and metachronous multiple primary lung cancers: systematic review and meta-analysis. Lung Cancer. 2015; 87(3): 303-10. (IV)
- 7)Hattori A, Suzuki K, Takamochi K, et al. Clinical features of multiple lung cancers based on thin-section computed tomography: what are the appropriate surgical strategies for second lung cancers? Surg Today. 2015; 45(2): 189-96. (IV)
- 8)Hamaji M, Ali SO, Burt BM. A meta-analysis of resected metachronous second non-small cell lung cancer. Ann Thorac Surg. 2015; 99(4): 1470-8. (IV)
- 9)Girard N, Ostrovnaya I, Lau C, et al. Genomic and mutational profiling to assess clonal relationships between multiple non-small cell lung cancers. Clin Cancer Res. 2009; 15(16): 5184-90. (IV)
- 10)van Rens MT, Eijken EJ, Elbers JR, et al. p53 mutation analysis for definite diagnosis of multiple primary lung carcinoma. Cancer. 2002; 94(1): 188-96. (IV)
- 11)Huang J, Behrens C, Wistuba I, et al. Molecular analysis of synchronous and metachronous tumors of the lung: impact on management and prognosis. Ann Diagn Pathol. 2001; 5(6): 321-9. (IV)
- 12)Wu CT, Lin MW, Hsieh MS, et al. New aspects of the clinicopathology and genetic profile of metachronous multiple lung cancers. Ann Surg. 2014; 259(5): 1018-24. (IV)
- 13)Creach KM, Bradley JD, Mahasittiwat P, et al. Stereotactic body radiation therapy in the treatment of multiple primary lung cancers. Radiother Oncol. 2012; 104(1): 19-22. (IV)
- 14)Nishiyama K, Kodama K, Teshima T, et al. Stereotactic body radiotherapy for second pulmonary nodules after operation for an initial lung cancer. Jpn J Clin Oncol. 2015; 45(10): 947-52. (IV)
1-8.胸腔鏡補助下肺葉切除
文献検索と採択

- 推 奨
- 臨床病期Ⅰ期非小細胞肺癌に対する胸腔鏡補助下肺葉切除は,科学的根拠は十分ではないが行うことを考慮してもよい。(グレードC1)
前方視的研究としては,VATS肺葉切除術の妥当性を検討した多施設共同試験(CALGB39802)の結果が報告されている7)。1998~2001年に3 cm以下の肺癌128例が集積され,VATS肺葉切除術が完遂されたものは86.5%(96例)であった。30日以内の手術死亡は3例(2.7%)でVATS手技に関連するものはないことから,VATS肺葉切除は受け入れられると結論した。また,サンプル例は66例と少ないが,肺葉切除における系統的リンパ節郭清について開胸とVATSを比較したランダム化比較試験が報告されている8)。2008~2011年に単一施設で臨床Ⅰ期非小細胞肺癌の系統的リンパ節郭清を行い,郭清個数は差がなかったが,手術時間はVATS 187分,開胸158分と手術時間はVATSで有意に長かった。これにより縦隔郭清は開胸と同じくVATSでも十分行うことができ,視野はむしろVATSのほうが良好である。
多施設における解析としてSociety of Thoracic Surgeons(STS)databaseをもととしたVATSと開胸手術の比較が報告されている9)。2002~2007年の手術例6,323例を後方視的に解析している。死亡率の差はないものの合併症発生率,すなわち術後不整脈,再挿管,輸血,在院日数,ドレナージ期間は開胸手術群に比べてVATS群で有意に少なかった。同じくSTS databaseを用いてnodal upstagingと予後について報告されている10)。2007~2011年までの臨床病期Ⅰ期で肺葉切除を受けた非小細胞肺癌症例1,513例のうち,18.6%(281例)でnodal upstagingを認めたが,開胸群で有意に高頻度であった(開胸24.6% vs VATS 11.9%)。OSは有意差はなかった。さらに周術期合併症について,上述のSTS databaseおよびESTS databaseからVATSと開胸を比較した報告がある。いずれもVATS群で周術期合併症が有意に少なく,在院日数も少なかった11)12)。
その他の後方視的な報告として,臨床病期ⅠA期非小細胞肺癌に対する肺葉切除術後の再発と第二癌の発生をVATS群520例と開胸群652例で比較検討したものがある13)。年齢,病期,性別,組織型,腫瘍存在部位,同時多発癌を調整した場合にはVATS群で再発が有意に少なかった(オッズ比;0.65,P=0.01)。その他の比較的大規模な検討でも心房細動,無気肺,肺瘻,肺炎などの術後合併症の頻度がVATSで少なく,胸腔ドレーン挿入期間,術後在院日数が短いとの報告がみられる14)~16)。
長期予後についての検討も多数報告されている。MD Andersonからの報告では臨床病期Ⅰ期のconsecutiveな肺葉切除症例(VATS 307例,開胸656例)において短期,長期予後を検討し,VATS群で周術期合併症が少なかったが,OS,DFSには差がなかった17)。Duke大学の肺葉切除症例(VATS 610例,開胸477例)の検討では,開胸群のほうが腫瘍径が大きく,stageも進んでいた。多変量解析では開胸,年齢,病理病期,男性が予後不良因子であった。propensity matchingによると術式はOSに影響せず,予後不良因子は年齢,病理病期,男性となった18)。これらの報告からVATSは長期予後において開胸手術と変わらないと結論される。
治療リスクに関するものとして,低肺機能患者の肺葉切除におけるVATSと開胸の比較について報告されている19)。前述のSTS databaseで2009~2011年に施行された肺葉切除症例13,376例(開胸6,802例,VATS 6,574例)で予測残存1秒量または予測残存DLCOが低値の場合,合併症率や死亡率は開胸群で高くなる(propensity matched,4,125例ずつ)。よってVATS lobectomyは開胸と比較して低肺機能の患者においてmorbidity,mortalityを下げる。一方,VATSのほうがリスクが高いという報告もある20)。HCUP-NIS databaseを用いた後方視的研究で2007~2010年までに肺葉切除をした24,253例(開胸19,030例,VATS 5,223例)における周術期死亡に対する術後合併症のタイプを検討し,VATSにおいて心血管系の合併症が死亡率に強く関係しているという結果であった(OR 2.19,P=0.001)。VATS lobectomyにおいて術後心血管合併症をきたした場合は,開胸術後よりもさらに慎重に対応すべきと思われる。
VATS手術における術中の重篤な合併症に関して報告がある。ヨーロッパの6つのセンターでのprospective studyでは3,076例のVATS肺切除症例を解析した21)。術死3例,在院死43例(1.4%)で,重篤な合併症は46例(1.5%)認め,気管支血管を誤って切離,消化管損傷,中枢気道損傷,追加の手術を要するような合併症,生命に危険が及ぶ合併症などであった。在院死の23%は術中の重篤な合併症に関連していた。VATSから開胸へのconversionは5.5%(170例)に認め,その理由としては腫瘍学的(22%),手技的(30%),合併症(49%)であった。血管損傷は2.9%(88例)あり,そのうち70例がcoversionした。Washington大学からの報告では2004~2012年の肺癌肺葉切除症例1,227例のうち,VATS完遂群517例(42%),VATSから開胸した群(conversion)87例(7%),開胸群623例(51%)となり,3群間で比較した22)。Conversionの原因は出血(25%),癒着/腫瘍(64%),リンパ節(9%)であった。また韓国からのVATS lobectomy施行中の予期せぬconversionを要した症例の検討では,conversionの原因はリンパ節の固着(28%),血管損傷(20%),腫瘍の浸潤(11%)であった23)。Conversionを要した69例とVATS例を1:3で割付し2群間を比較,術後合併症や在院死亡に差はなかったが,呼吸器合併症はconversion群で多く認めた。これらの報告からVATS手術中に腫瘍学的または手技的に困難であれば開胸へのconversionは躊躇せず,速やかに行うべきである。
さらに新しい手技としてrobotic surgery24)やsingle port VATS25)の報告が増えている。
臨床病期Ⅰ期非小細胞肺癌に対するVATS肺葉切除術について混乱を生じているのは,VATSアプローチの定義自体があいまいな点である。そのアプローチにはモニター視のみの完全鏡視下と,直視を併用するもの,いわゆるHybrid VATSがある26)。皮切長,皮切の数,肋間開大(開胸器併用)の有無など様々な方法が施設毎に採用され,完全鏡視下であっても手術の質向上のために直視下触診を用いるものもある。その手術成績などについては,その区別なく論じられている場合がほとんどである。さらにVATSが開胸手術に比較して,予後,侵襲性,安全性に関して,同等ないし優れていると肯定的な研究は多いものの,これらの報告の多くは単施設の後方視的な解析に基づくものであり,十分な症例数を有したランダム化比較試験はなく,確定的な結論は出ていない。VATSアプローチの定義が難しいため,今後も大規模なランダム化比較試験の実施は困難であると予想される。2009年の日本胸部外科学会年次調査結果によれば,肺癌に対する23,520例の全肺葉切除術の50%以上,12,008例にVATS肺葉切除術が施行されている27)。このように臨床病期Ⅰ期非小細胞肺癌に対するVATS肺葉切除術は,実地医療の場ではランダム化比較試験を経ずに頻用されており,その推奨グレードをC1とした。
- 1)Kirby TJ, Mack MJ, Landreneau RJ, et al. Lobectomy--video-assisted thoracic surgery versus muscle-sparing thoracotomy. A randomized trial. J Thorac Cardiovasc Surg. 1995; 109(5): 997-1002. (II)
- 2)Sugi K, Kaneda Y, Esato K. Video-assisted thoracoscopic lobectomy achieves a satisfactory long-term prognosis in patients with clinical stage IA lung cancer. World J Surg. 2000; 24(1): 27-30. (II)
- 3)Yan TD, Black D, Bannon PG, et al. Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer. J Clin Oncol. 2009; 27(15): 2553-62. (I)
- 4)Taioli E, Lee DS, Lesser M, et al. Long-term survival in video-assisted thoracoscopic lobectomy vs open lobectomy in lung-cancer patients: a meta-analysis. Eur J Cardiothorac Surg. 2013; 44(4): 591-7. (I)
- 5)Cai YX, Fu XN, Xu QZ, et al. Thoracoscopic lobectomy versus open lobectomy in stageⅠ non-small cell lung cancer: a meta-analysis. PLoS One. 2013; 8(12): e82366. (I)
- 6)Zhang R, Ferguson MK. Video-Assisted versus Open Lobectomy in Patients with Compromised Lung Function: A Literature Review and Meta-Analysis. PLoS One. 2015; 10(7): e0124512. (I)
- 7)Swanson SJ, Herndon JE 2nd, D’Amico TA, et al. Video-assisted thoracic surgery lobectomy: report of CALGB 39802--a prospective, multi-institution feasibility study. J Clin Oncol. 2007; 25(31): 4993-7. (III)
- 8)Palade E, Passlick B, Osei-Agyemang T, et al. Video-assisted vs open mediastinal lymphadenectomy for StageⅠ non-small-cell lung cancer: results of a prospective randomized trial. Eur J Cardiothorac Surg. 2013; 44(2): 244-9. (II)
- 9)Paul S, Altorki NK, Sheng S, et al. Thoracoscopic lobectomy is associated with lower morbidity than open lobectomy: a propensity-matched analysis from the STS database. J Thorac Cardiovasc Surg. 2010; 139(2): 366-78. (IV)
- 10)Licht PB, Jørgensen OD, Ladegaard L, et al. A national study of nodal upstaging after thoracoscopic versus open lobectomy for clinical stageⅠ lung cancer. Ann Thorac Surg. 2013; 96(3): 943-9. (IV)
- 11)Boffa DJ, Dhamija A, Kosinski AS, et al. Fewer complications result from a video-assisted approach to anatomic resection of clinical stageⅠ lung cancer. J Thorac Cardiovasc Surg. 2014; 148(2): 637-43. (IV)
- 12)Falcoz PE, Puyraveau M, Thomas PA, et al; ESTS Database Committee and ESTS Minimally Invasive Interest Group. Video-assisted thoracoscopic surgery versus open lobectomy for primary non-small-cell lung cancer: a propensity-matched analysis of outcome from the European Society of Thoracic Surgeon database. Eur J Cardiothorac Surg. 2016; 49(2): 602-9. (IV)
- 13)Flores RM, Ihekweazu UN, Rizk N, et al. Patterns of recurrence and incidence of second primary tumors after lobectomy by means of video-assisted thoracoscopic surgery(VATS)versus thoracotomy for lung cancer. J Thorac Cardiovasc Surg. 2011; 141(1): 59-64. (IV)
- 14)Yamamoto K, Ohsumi A, Kojima F, et al. Long-term survival after video-assisted thoracic surgery lobectomy for primary lung cancer. Ann Thorac Surg. 2010; 89(2): 353-9. (IV)
- 15)Villamizar NR, Darrabie MD, Burfeind WR, et al. Thoracoscopic lobectomy is associated with lower morbidity compared with thoracotomy. J Thorac Cardiovasc Surg. 2009; 138(2): 419-25. (IV)
- 16)McKenna RJ Jr, Houck W, Fuller CB. Video-assisted thoracic surgery lobectomy: experience with 1,100 cases. Ann Thorac Surg. 2006; 81(2): 421-5. (IV)
- 17)Stephens N, Rice D, Correa A, et al. Thoracoscopic lobectomy is associated with improved short-term and equivalent oncological outcomes compared with open lobectomy for clinical StageⅠ non-small-cell lung cancer: a propensity-matched analysis of 963 cases. Eur J Cardiothorac Surg. 2014; 46(4): 607-13. (IV)
- 18)Berry MF, D’Amico TA, Onaitis MW, et al. Thoracoscopic approach to lobectomy for lung cancer does not compromise oncologic efficacy. Ann Thorac Surg. 2014; 98(1): 197-202. (IV)
- 19)Burt BM, Kosinski AS, Shrager JB, et al. Thoracoscopic lobectomy is associated with acceptable morbidity and mortality in patients with predicted postoperative forced expiratory volume in 1 second or diffusing capacity for carbon monoxide less than 40% of normal. J Thorac Cardiovasc Surg. 2014; 148(1): 19-28. (IV)
- 20)Law TD, Boffa DJ, Detterbeck FC, et al. Lethality of cardiovascular events highlights the variable impact of complication type between thoracoscopic and open pulmonary lobectomies. Ann Thorac Surg. 2014; 97(3): 993-9. (IV)
- 21)Decaluwe H, Petersen RH, Hansen H, et al; ESTS Minimally Invasive Thoracic Surgery Interest Group(MITIG). Major intraoperative complications during video-assisted thoracoscopic anatomical lung resections: an intention-to-treat analysis. Eur J Cardiothorac Surg. 2015; 48(4): 588-98. (IV)
- 22)Puri V, Patel A, Majumder K, et al. Intraoperative conversion from video-assisted thoracoscopic surgery lobectomy to open thoracotomy: a study of causes and implications. J Thorac Cardiovasc Surg. 2015 Jan; 149(1): 55-61. (IV)
- 23)Byun CS, Lee S, Kim DJ, et al. Analysis of Unexpected Conversion to Thoracotomy During Thoracoscopic Lobectomy in Lung Cancer. Ann Thorac Surg. 2015; 100(3): 968-73. (IV)
- 24)Nakamura H, Suda T, Ikeda N, et al. Initial results of robot-assisted thoracoscopic surgery in Japan. Gen Thorac Cardiovasc Surg. 2014; 62(12): 720-5. (IV)
- 25)Hsu PK, Lin WC, Chang YC, et al. Multiinstitutional analysis of single-port video-assisted thoracoscopic anatomical resection for primary lung cancer. Ann Thorac Surg. 2015; 99(5): 1739-44. (IV)
- 26)Okada M, Sakamoto T, Yuki T, et al. Hybrid surgical approach of video-assisted minithoracotomy for lung cancer: significance of direct visualization on quality of surgery. Chest. 2005; 128(4): 2696-701. (IV)
- 27)Committee for Scientific Affairs, Sakata R, Fujii Y, Kuwano H. Thoracic and cardiovascular surgery in Japan during 2009: annual report by the Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg. 2011; 59(9): 636-67. (IV)
1-9.術後経過観察
文献検索と採択

- 推 奨
a.外科切除後の非小細胞肺癌に対しては定期的な経過観察を行うよう勧められる。(グレードB)
b.非小細胞肺癌術後の患者には禁煙と禁煙の支援が強く勧められる。
- a.
- 肺癌術後経過観察は科学的根拠に則り,経済的影響を十分に考慮しながら行う必要がある。しかし臨床研究の結果に乏しく科学的根拠に基づいた観察法は示されていない。
肺癌術後再発予後は経過観察法,すなわちintensiveに経過を追うかどうかによっては改善されないとの報告がなされている1)~3)。Virgoらの1995年の論文は単一施設でintensive群とnonintensive群を後方視的に解析した研究であるが,intensive群のほうがnonintensive群に比べ0.53年生存期間が延長していたものの,有意差はなかった2)。一方でintensiveに経過観察した場合,生存率が改善するとの報告4)もある。さらにintensiveな経過観察により他疾患の治療が容易になるとの立場もある3)。しかし肺癌完全切除後に無症状で再発が発見される症例は9.2%,さらに治療が行われたのが全体のわずか3%未満という結果から,無症状症例に積極的なスクリーニングを行うのは,費用対効果の面からも必要ないとの研究もある3)。
明確に推奨する根拠はないものの術後経過観察は日常診療としてなされ,患者のニーズが明確に存在する。また受診による術後合併症の発見,患者の状態の把握,精神的支援などの側面もある。さらに異時多発癌は病理病期Ⅰ期においても1.99/100人年で発生し,切除例の予後は非切除例より良好であった(P=0.003)との報告5)があり,その点も考慮し推奨グレードをBにした。経過観察期間に関しては5年以降では再発は減少6)し,予後は良好7)との報告がある一方で,スリガラス陰影を呈する肺癌でも5年以降に再発したとの報告8)もあり,今後の検討を要する。
CTについては海外の複数のガイドラインではCTを推奨しており9)~11),経過観察には低線量らせんCTが有用との報告12)や,半年毎に胸部CTを行った群の予後が良好であったとの報告13)があるが,術後経過観察における術後CTの予後に対する影響は明らかではない。PETについても術後再発の検出に有用か否か検討が不十分である14)15)。 - b.
- 術後の禁煙については強固なエビデンスは存在しないが,禁煙は肺癌のみならず,あらゆる疾患の予防のためにも,肺癌学会として強く推奨する。
- 1)Walsh GL, O’Connor M, Willis KM, et al. Is follow-up of lung cancer patients after resection medically indicated and cost-effective? Ann Thorac Surg. 1995; 60(6): 1563-70. (IV)
- 2)Virgo KS, McKirgan LW, Caputo MC, et al. Post-treatment management options for patients with lung cancer. Ann Surg. 1995; 222(6): 700-10. (IV)
- 3)Younes RN, Gross JL, Deheinzelin D. Follow-up in lung cancer: how often and for what purpose? Chest. 1999; 115(6): 1494-9. (IV)
- 4)Westeel V, Choma D, Clément F, et al. Relevance of an intensive postoperative follow-up after surgery for non-small cell lung cancer. Ann Thorac Surg. 2000; 70(4): 1185-90. (IV)
- 5)Rice D, Kim HW, Sabichi A, et al. The risk of second primary tumors after resection of stageⅠ nonsmall cell lung cancer. Ann Thorac Surg. 2003; 76(4): 1001-7. (IV)
- 6)Okada M, Nishio W, Sakamoto T, et al. Long-term survival and prognostic factors of five-year survivors with complete resection of non-small cell lung carcinoma. J Thorac Cardiovasc Surg 2003; 126: 558-62. (IV)
- 7)Martini N, Rusch VW, Bains MS, et al. Factors influencing ten-year survival in resected stagesⅠ to Ⅲa non-small cell lung cancer. J Thorac Cardiovasc Surg. 1999; 117(1): 32-8. (IV)
- 8)Yoshida J, Ishii G, Yokose T, et al. Possible delayed cut-end recurrence after limited resection for ground-glass opacity adenocarcinoma, intraoperatively diagnosed as Noguchi type B, in three patients. J Thorac Oncol. 2010; 5(4): 546-50. (V)
- 9)Crinò L, Weder W, van Meerbeeck J, et al. Early stage and locally advanced(non-metastatic)non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2010; 21 Suppl 5: v103-15. (VI)
- 10)National Comprehensive Cancer Network. Guidelines for surveillance following therapy for non-small cell lung cancer Ver 2.2013. Available at: www.nccn.com. (VI)
- 11)Colt HG, Murgu SD, Korst RJ, et al. Follow-up and surveillance of the patient with lung cancer after curative-intent therapy: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143:(5 Suppl): e437S-e454S. (VI)
- 12)Chiu CH, Chern MS, Wu MH, et al. Usefulness of low-dose spiral CT of the chest in regular follow-up of postoperative non-small cell lung cancer patients: Preliminary report. J Thorac Cardiovasc Surg. 2003; 125(6): 1300-5. (IV)
- 13)Nakamura R, Kurishima K, Kobayashi N, et al. Postoperative follow-up for patients with non-small cell lung cancer. Onkologie. 2010; 33(1-2): 14-8. (IV)
- 14)Weder W, Schmid RA, Bruchhaus H, et al. Detection of extrathoracic metastases by positron emission tomography in lung cancer. Ann Thorac Surg. 1998; 66(3): 886-93. (IV)
- 15)Cho S, Lee EB. A follow-up of integrated positron emission tomography/computed tomography after curative resection of non-small-cell lung cancer in asymptomatic patients. J Thorac Cardiovasc Surg. 2010; 139(6): 1447-51. (IV)
1-10.低悪性度肺腫瘍(カルチノイド,粘表皮癌,腺様嚢胞癌)
文献検索と採択

- 推 奨
- 切除可能な低悪性度肺腫瘍(カルチノイド,粘表皮癌,腺様嚢胞癌)は,非小細胞肺癌に準じた外科治療を行うよう勧められる。(グレードA)
非定型カルチノイドのみを集積した検討では,浸潤性が高いため標準切除とリンパ節郭清が重要とする報告や5)~7),335例の手術で3年生存率までは肺葉切除と縮小手術との差がない一方で,放射線照射は死亡率が高いとする報告もあり8),手術が一般的に推奨されている。
最近のSEERデータベースでは,生検でカルチノイドとされたN0症例4,110例において,全5年生存率が肺葉切除で93%,縮小手術で92%,非切除で69%,疾患特異的生存率は肺葉切除で97%,縮小手術で98%,非切除で88%であった。非切除群の疾患特異的生存率も良かったため,高リスク患者では,無症状例の経過観察や,中枢発生有症状例の気管支鏡処置は考慮してよいと報告されている9)。気管支カルチノイドでは112例の初回経気管支鏡的処置例(全例観察期間5年以上)において,42%の患者が再発を認めず手術を回避し得たため,との報告がある10)。
粘表皮癌は肺癌全体の0.1~0.2%を占める稀な腫瘍である。組織学的に低悪性度腫瘍,高悪性度腫瘍に分類される11)。一般的に低悪性度のものは予後良好で,高悪性度のものは予後不良とされている。Vadaszらは低悪性度腫瘍5例の5年生存率は80%,高悪性度腫瘍では44%にリンパ節転移が認められ,5年生存率は31%であったと報告している12)。またChinら13)は完全切除症例の10年生存率は87.5%であったのに対し,不完全切除症例では長期生存は認められなかったと報告している。
腺様嚢胞癌は完全切除での5年生存率が73~91%と報告され14)~16),後方視的研究ではあるが手術例は非切除例よりも良好な成績で,さらに不完全切除の場合でも非切除例より予後が良好であり,完全切除と差がないとする報告もある15)16)。
これらの腫瘍は前方視的比較試験の結果がないものの,一般に手術が行われており推奨グレードをAとした。
- 1)Travis WD, Giroux DJ, Chansky K, et al. The IASLC Lung Cancer Staging Project: proposals for the inclusion of broncho-pulmonary carcinoid tumors in the forthcoming(seventh)edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2008; 3(11): 1213-23. (IV)
- 2)García-Yuste M, Matilla JM, Cueto A, et al. Typical and atypical carcinoid tumours: analysis of the experience of the Spanish Multi-centric Study of Neuroendocrine Tumours of the Lung. Eur J Cardiothorac Surg. 2007; 31(2): 192-7. (IV)
- 3)Yendamuri S, Gold D, Jayaprakash V, et al. Is sublobar resection sufficient for carcinoid tumors? Ann Thorac Surg. 2011; 92(5): 1774-9. (IV)
- 4)Fox M, Van Berkel V, Bousamra M 2nd, et al. Surgical management of pulmonary carcinoid tumors: sublobar resection versus lobectomy. Am J Surg. 2013; 205(2): 200-8. (IV)
- 5)Cañizares MA, Matilla JM, Cueto A, et al.; EMETNE-SEPAR Members. Atypical carcinoid tumours of the lung: prognostic factors and patterns of recurrence. Thorax. 2014; 69(7): 648-53. (IV)
- 6)Caplin ME, Baudin E, Ferolla P, et al.; ENETS consensus conference participants. Pulmonary neuroendocrine(carcinoid)tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol. 2015; 26(8): 1604-20. (I)
- 7)Filosso PL, Rena O, Guerrera F, et al; ESTS NETs-WG Steering Committee. Clinical management of atypical carcinoid and large-cell neuroendocrine carcinoma: a multicentre study on behalf of the European Association of Thoracic Surgeons(ESTS)Neuroendocrine Tumours of the Lung Working Group†. Eur J Cardiothorac Surg. 2015; 48(1): 55-64. (IV)
- 8)Steuer CE, Behera M, Kim S, et al. Atypical carcinoid tumor of the lung: a surveillance, epidemiology, and end results database analysis. J Thorac Oncol. 2015; 10(3): 479-85. (IV)
- 9)Raz DJ, Nelson RA, Grannis FW, et al. Natural history of typical pulmonary carcinoid tumors: a comparison of nonsurgical and surgical treatment. Chest. 2015; 147(4): 1111-7. (IV)
- 10)Brokx HA, Paul MA, Postmus PE, et al. Long-term follow-up after first-line bronchoscopic therapy in patients with bronchial carcinoids. Thorax. 2015; 70(5): 468-72. (IV)
- 11)Yousem SA, Hochholzer L. Mucoepidermoid tumors of the lung. Cancer. 1987 15; 60(6): 1346-52. (V)
- 12)Vadasz P, Egervary M. Mucoepidermoid bronchial tumors: a review of 34 operated cases. Eur J Cardiothorac Surg. 2000; 17(5): 566-9. (V)
- 13)Chin CH, Huang CC, Lin MC, et al. Prognostic factors of tracheobronchial mucoepidermoid carcinoma--15 years experience. Respirology. 2008; 13(2): 275-80. (V)
- 14)Regnard JF, Fourquier P, Levasseur P. Results and prognostic factors in resections of primary tracheal tumors: a multicenter retrospective study. The French Society of Cardiovascular Surgery. J Thorac Cardiovasc Surg. 1996; 111(4): 808-13. (V)
- 15)Maziak DE, Todd TR, Keshavjee SH, et al. Adenoid cystic carcinoma of the airway: thirty-two-year experience. J Thorac Cardiovasc Surg. 1996; 112(6): 1522-31. (V)
- 16)Kanematsu T, Yohena T, Uehara T, et al. Treatment outcome of resected and nonresected primary adenoid cystic carcinoma of the lung. Ann Thorac Cardiovasc Surg. 2002; 8(2): 74-7. (V)