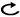6
Ⅱ.非小細胞肺癌
文献検索と採択

本文中に用いた略語および用語の解説
| CDDP | シスプラチン | PEM | ペメトレキセド |
|---|---|---|---|
| DTX | ドセタキセル | VNR | ビノレルビン |
| IFM | イホスファミド | ||
| プラチナ製剤 | シスプラチンとカルボプラチンの総称 |
|---|---|
| 第1・2世代のEGFR-TKI | ゲフィチニブ・エルロチニブ・アファチニブの総称 |
| PD-1阻害剤 | ペムブロリズマブ,ニボルマブの総称 |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
|---|---|---|
| BSC | best supportive care | 緩和治療,ベストサポーティブケア |
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| mPFS | median PFS | 無増悪生存期間中央値 |
| MST | median survival time | 生存期間中央値 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 一般状態 |
| QOL | quality of life | 生活の質 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害剤 |
樹形図
以上より,非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明),扁平上皮癌におけるエルロチニブ単剤は有効性と間質性肺障害のリスクなどから臨床的有用性は低いと考えられ削除した。
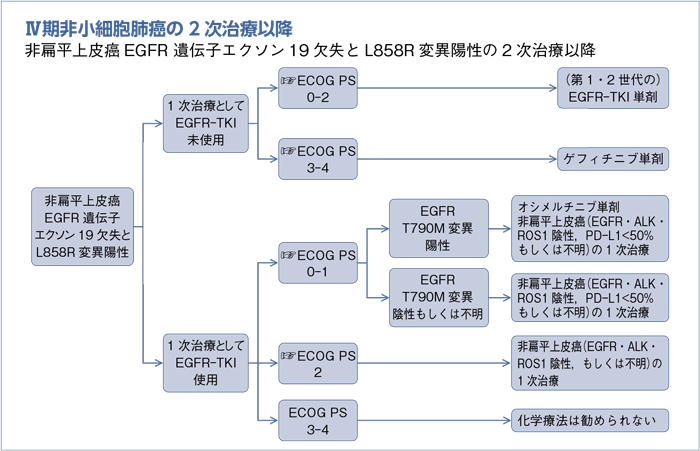
1次治療としてEGFR-TKI未使用の2次治療以降:PS 0-2
- 推 奨
- (第1・2世代の)EGFR-TKI単剤を行うよう勧められる。(グレードA)
EGFR遺伝子変異陽性例に対するEGFR-TKI単剤の最適な投与順序に関しては,現時点で明確な結論はないが,EGFR遺伝子変異陽性患者に対してはEGFR-TKI単剤による治療を逸しないことが推奨される。以上より,(第1・2世代の)EGFR-TKI単剤の推奨グレードをAとした。
1次治療としてEGFR-TKI未使用の2次治療以降:PS 3-4
- 推 奨
- ゲフィチニブ単剤を行うことを考慮してもよい。(グレードC1)
1次治療としてEGFR-TKI使用の2次治療以降:PS 0-1
- 推 奨
a.EGFR T790M変異陽性ではオシメルチニブ単剤を行うよう勧められる。(グレードA)
b.非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
〈オシメルチニブ単剤〉
- a.
- オシメルチニブは活性型EGFR遺伝子変異と耐性変異であるEGFR T790M変異の両方を阻害する第3世代EGFR-TKIである。第1・2世代のEGFR-TKI治療後に病勢進行を認めたEGFR遺伝子変異陽性非小細胞肺癌のうち,再生検によってEGFR T790M陽性と診断されたPS 0-1の症例を対象として,オシメルチニブと化学療法(プラチナ製剤+PEM)を比較する第Ⅲ相試験が報告された。主要評価項目であるPFSはオシメルチニブ群が10.1カ月,標準化学療法群が4.4カ月(HR 0.30, 95%CI:0.23-0.41, P<0.001)とオシメルチニブ群で有意に良好であった。Grade 3以上の有害事象はオシメルチニブ群が化学療法群より低く(6% vs 34%),オシメルチニブ群における毒性の種類は下痢・皮疹・爪囲炎など従来のEGFR-TKIと同様で,間質性肺疾患の頻度は3%であった13)。なお,同様の対象について行われた第Ⅰ・Ⅱ相試験において,日本人81人のサブグループ解析では間質性肺疾患が5人(6%)に生じており,そのうち重篤なものは3人(4%)であった14)。
以上より,本対象におけるオシメルチニブの推奨グレードをA,プラチナ併用療法の推奨グレードをBとした。
〈非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメン〉
- b.
- 複数の1次治療の第Ⅲ相試験においてEGFR-TKI単剤はプラチナ併用療法に対して有意なOSの延長がなかった。このことは大半の症例で後治療でのクロスオーバーがなされたことが影響していると考えられている。EGFR-TKI後の治療における最適な化学療法の詳細な検討がなされていない現状では,非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療に準じて治療を行う。
一方,EGFR-TKI耐性後のEGFR-TKIの継続投与に関しては,初回治療のゲフィチニブに耐性となったEGFR遺伝子変異陽性進行非小細胞肺癌を対象に,CDDP+PEM併用療法にゲフィチニブの継続投与を行う群と行わない群を比較する第Ⅲ相試験が行われ,主要評価項目であるPFSは両群ともに5.4カ月(HR 0.86,P=0.27)と差を認めず,OSにおいてはゲフィチニブの継続投与群で14.8カ月,継続投与なし群で17.2カ月であり(HR 1.62,P=0.03),継続投与群でOSを下回る結果であった15)。
以上より,EGFR-TKI耐性後に化学療法に併用したEGFR-TKIの継続投与による有用性は示されておらず勧められない。
1次治療としてEGFR-TKI使用の2次治療以降:PS 2
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
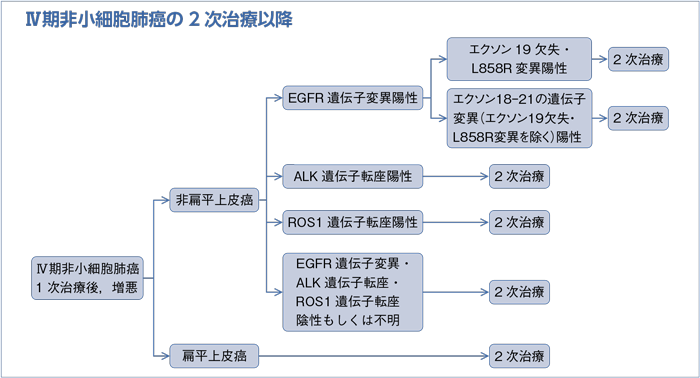
1次治療としてEGFR-TKI未使用の2次治療以降:PS 0-2
- 推 奨
a.非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の2次治療以降で推奨されるレジメンを行うよう勧められる。(グレードB)
b.(第1・2世代の)EGFR-TKI単剤を行うことを考慮してもよい。(グレードC1)
- a・b.
- EGFR遺伝子変異の約90%をエクソン19欠失とL858R変異が占め,その他の遺伝子変異はuncommon mutationと称され,エクソン18-21にわたりE709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異などが報告されている。
EGFR遺伝子変異陽性の未治療進行非小細胞肺癌を対象にした第1・2世代のEGFR-TKI単剤とプラチナ製剤併用療法の比較第Ⅲ相試験において,EGFR遺伝子変異の大部分はエクソン19欠失もしくはL858R変異であり,エクソン18-21の遺伝子変異陽性例に対するEGFR-TKIの有効性に関しては限られたデータしかない。サブグループ解析やレトロスペクティブな報告からは,T790Mとエクソン20の挿入変異以外のエクソン18-21の遺伝子変異に対するEGFR-TKIはORR 48~71%,PFS 5.0~10.7カ月と報告されており,有効性はエクソン19欠失やL858R変異と比べると劣ることが示されている16)17)。アファチニブに関してはORR 71.1%,PFS 10.7カ月とゲフィチニブやエルロチニブより良好な成績が示されている17)。
以上より,エクソン18-21の遺伝子変異陽性例に対して第1・2世代のEGFR-TKI単剤は,ある程度の効果が期待できると考えられるが,データは限られており,非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の2次治療以降で推奨されるレジメンの推奨グレードをBとし,第1・2世代のEGFR-TKI単剤の推奨グレードはC1とした。
1次治療としてEGFR-TKI使用の2次治療以降:PS 0-1
- 推 奨
a.EGFR T790M変異陽性ではオシメルチニブ単剤を行うよう勧められる。(グレードA)
b.非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
〈オシメルチニブ単剤〉
- a.
- オシメルチニブは活性型EGFR遺伝子変異と耐性変異であるEGFR T790M変異の両方を阻害する第3世代EGFR-TKIである。第1・2世代のEGFR-TKI治療後に病勢進行を認めたEGFR遺伝子変異陽性非小細胞肺癌のうち,再生検によってEGFR T790M陽性と診断されたPS 0-1の症例を対象として,オシメルチニブと化学療法(プラチナ製剤+PEM)を比較する第Ⅲ相試験が報告された。主要評価項目であるPFSはオシメルチニブ群が10.1カ月,標準化学療法群が4.4カ月(HR 0.30, 95%CI:0.23-0.41, P<0.001)とオシメルチニブ群で有意に良好であった。Grade 3以上の有害事象はオシメルチニブ群が化学療法群より低く(6% vs 34%),オシメルチニブ群における毒性の種類は下痢・皮疹・爪囲炎など従来のEGFR-TKIと同様で,間質性肺疾患の頻度は3%であった13)。なお,同様の対象について行われた第Ⅰ・Ⅱ相試験において,日本人81人のサブグループ解析では間質性肺疾患が5人(6%)に生じており,そのうち重篤なものは3人(4%)であった14)。
以上より,本対象におけるオシメルチニブの推奨グレードをA,プラチナ併用療法の推奨グレードをBとした。
〈非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメン〉
- b.
- 複数の1次治療の第Ⅲ相試験においてEGFR-TKI単剤はプラチナ併用療法に対して有意なOSの延長がなかった。このことは大半の症例で後治療でのクロスオーバーがなされたことが影響していると考えられている。EGFR-TKI後の治療における最適な化学療法の詳細な検討がなされていない現状では,非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療に準じて治療を行う。
一方,EGFR-TKI耐性後のEGFR-TKIの継続投与に関しては,初回治療のゲフィチニブに耐性となったEGFR遺伝子変異陽性進行非小細胞肺癌を対象に,CDDP+PEM併用療法にゲフィチニブの継続投与を行う群と行わない群を比較する第Ⅲ相試験が行われ,主要評価項目であるPFSは両群ともに5.4カ月(HR 0.86,P=0.27)と差を認めず,OSにおいてはゲフィチニブの継続投与群で14.8カ月,継続投与なし群で17.2カ月であり(HR 1.62,P=0.03),継続投与群でOSを下回る結果であった15)。
以上より,EGFR-TKI耐性後に化学療法に併用したEGFR-TKIの継続投与による有用性は示されおらず勧められない。
1次治療としてEGFR-TKI使用の2次治療以降:PS 2
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
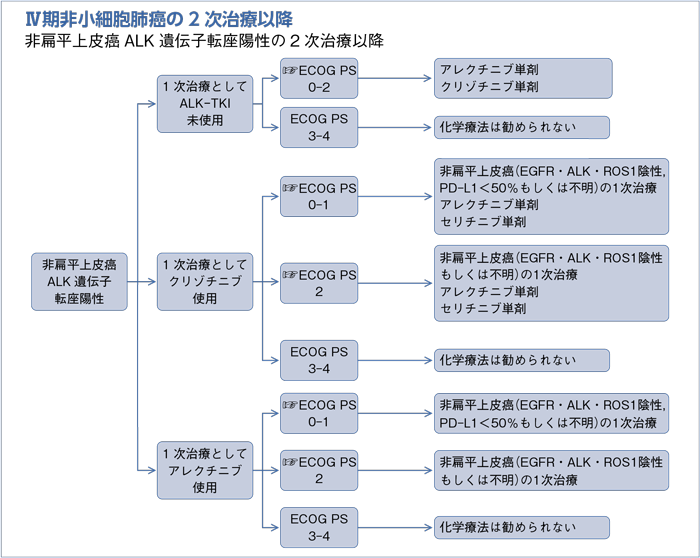
1次治療としてALK-TKI未使用の2次治療以降:PS 0-2
- 推 奨
a.アレクチニブ単剤を行うよう勧められる。(グレードA)
b.クリゾチニブ単剤を行うよう勧められる。(グレードB)
〈アレクチニブ単剤〉
- a.
- アレクチニブは,ALK-TKI未治療のALK遺伝子転座陽性進行非小細胞肺癌を対象とした第Ⅰ-Ⅱ相試験においてORR 93.5%の良好な結果を示し18),その後のフォローアップにて29カ月以上のPFSが推定されている19)。また,本邦においてALK-TKI未治療のALK遺伝子転座陽性患者を対象としたアレクチニブとクリゾチニブの比較第Ⅲ相試験が行われ,主要評価項目であるPFSはアレクチニブ群で有意な延長を認め(未到達vs 10.2カ月:HR 0.34,P<0.001),Grade 3以上の毒性もアレクチニブ群で少なかった(26% vs 51%)20)。
以上より,アレクチニブ単剤を行うよう勧められ,推奨グレードはAとした。
〈クリゾチニブ単剤〉
- b.
- プラチナ製剤治療歴のあるALK遺伝子転座陽性例を対象とし,2次治療以降としてクリゾチニブと標準化学療法(PEMまたはDTX)を比較する第Ⅲ相試験が報告され,主要評価項目であるPFSはクリゾチニブ群が7.7カ月,標準化学療法群が3.0カ月(HR 0.49,95%CI:0.37-0.64,P<0.001)とクリゾチニブ群で有意に良好であった21)。
以上より,クリゾチニブ単剤を行うよう勧められるが,上述のアレクチニブとクリゾチニブの比較第Ⅲ相試験において主要評価項目であるPFSはアレクチニブ群で有意に良好であり,クリゾチニブの推奨グレードはBとした。
1次治療としてクリゾチニブ使用の2次治療以降:PS 0-1
- 推 奨
a.非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
b.アレクチニブ単剤を行うよう勧められる。(グレードB)
c.セリチニブ単剤を行うよう勧められる。(グレードB)
〈非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメン〉
- a.
- 1次治療としてALK遺伝子転座陽性の進行非小細胞肺癌を対象にしたクリゾチニブとプラチナ製剤併用療法の比較第Ⅲ相試験22)におけるOSは十分な観察期間が得られていないが,現時点では差がなく,クロスオーバーされていることが原因と考えられていること,現時点で報告されている耐性機序は化学療法と異なることより,非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療に準じて治療を行う。
〈アレクチニブ単剤〉
- b.
- クリゾチニブ耐性後のALK遺伝子転座陽性進行非小細胞肺癌を対象とし,アレクチニブを投与するⅠ-Ⅱ相試験ならびに第Ⅱ相試験が海外で行われ,ORR 48~50%,PFS 8.1~8.9カ月の良好な成績が報告されている23)~25)。少数例の検討ではあるが,日本で行われたクリゾチニブ既治療の23例に対してアレクチニブを投与した試験では,ORR 65%,PFSは12.9カ月であった26)。プラチナ製剤併用療法と比較したデータはないものの,少なくとも同程度の有効性は期待できると考え,推奨グレードはBとした。
〈セリチニブ単剤〉
- c.
- ALK遺伝子転座陽性進行非小細胞肺癌を対象としセリチニブを投与する第Ⅰ相試験が行われ,expansion phaseでのサブグループ解析において,クリゾチニブ既治療の80例でORR 56%,PFS 6.9カ月の成績が報告された27)。主な毒性は悪心(82%),下痢(75%),嘔吐(65%),倦怠感(47%),肝機能障害(35%)であった。また,クリゾチニブならびにプラチナ併用療法後に増悪したALK遺伝子転座陽性例を対象とした単アームの第Ⅱ相試験において,ORR 38.6%,PFS 5.7カ月の成績が報告されている28)。本邦で行われた第Ⅰ相試験においては,クリゾチニブ既治療の9例中5例でPRの効果が得られた29)。
アレクチニブ同様,プラチナ製剤併用療法と比較したデータはないものの,少なくとも同程度の有効性は期待できると考え,推奨グレードはBとした。
1次治療としてクリゾチニブ使用の2次治療以降:PS 2
- 推 奨
a.非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
b.アレクチニブ単剤を行うよう勧められる。(グレードB)
c.セリチニブ単剤を行うよう勧められる。(グレードB)
〈非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメン〉
- a.
- 1次治療としてALK遺伝子転座陽性の進行非小細胞肺癌を対象にしたクリゾチニブとプラチナ製剤併用療法の比較第Ⅲ相試験22)におけるOSは十分な観察期間が得られていないが,現時点では差がなくクロスオーバーされていることが原因と考えられていること,現時点で報告されている耐性機序は化学療法と異なることより,非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療に準じて治療を行う。
〈アレクチニブ単剤〉
- b.
- クリゾチニブ耐性後のALK遺伝子転座陽性進行非小細胞肺癌を対象とし,アレクチニブを投与するⅠ-Ⅱ相試験ならびに第Ⅱ相試験が海外で行われ,ORR 48~50%,PFS 8.1~8.9カ月の良好な成績が報告されている23)~25)。少数例の検討ではあるが,本邦で行われたクリゾチニブ既治療の23例に対してアレクチニブを投与した試験では,ORR 65%,PFSは12.9カ月であった26)。プラチナ製剤併用療法と比較したデータはないものの,少なくとも同程度の有効性は期待できると考え,推奨グレードはBとした。
〈セリチニブ単剤〉
- c.
- ALK遺伝子転座陽性進行非小細胞肺癌を対象としセリチニブを投与する第Ⅰ相試験が行われ,expansion phaseでのサブグループ解析において,クリゾチニブ既治療の80例でORR 56%,PFS 6.9カ月の成績が報告された27)。主な毒性は悪心(82%),下痢(75%),嘔吐(65%),倦怠感(47%),肝機能障害(35%)であった。また,クリゾチニブならびにプラチナ併用療法後に増悪したALK遺伝子転座陽性例を対象とした単アームの第Ⅱ相試験において,ORR 38.6%,PFS 5.7カ月の成績が報告されている28)。本邦で行われた第Ⅰ相試験においては,クリゾチニブ既治療の9例中5例でPRの効果が得られた29)。
アレクチニブ同様,プラチナ製剤併用療法と比較したデータはないものの,少なくとも同程度の有効性は期待できると考え,推奨グレードはBとした。
1次治療としてアレクチニブ使用の2次治療以降:PS 0-1
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
アレクチニブ使用例に対するクリゾチニブ使用については前向き試験での検討はなされていない。
1次治療としてアレクチニブ使用の2次治療以降:PS 2
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療 :PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
アレクチニブ使用例に対するクリゾチニブ使用については前向き試験での検討はなされていない。
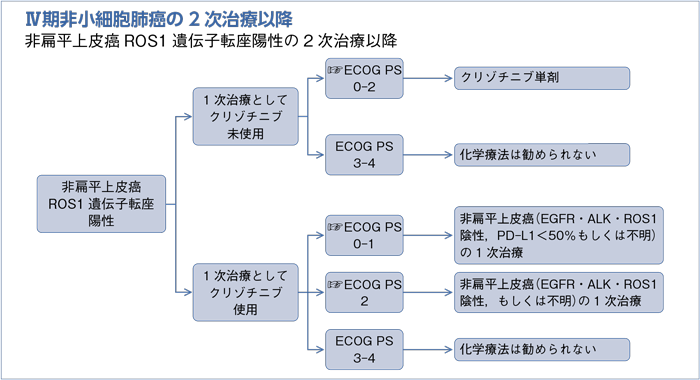
1次治療としてクリゾチニブ未使用の2次治療以降:PS 0-2
- 推 奨
- クリゾチニブ単剤を行うよう勧められる。(グレードA)
その後,日本を含む東アジアにおいて前治療の化学療法が3レジメン以下のROS1遺伝子転座陽性進行非小細胞肺癌に対する第Ⅱ相試験が行われ,主要評価項目であるORRは69.3%でCRが11%に認められ,PFSは13.4カ月と良好な結果が報告されている31)。
以上,ROS1遺伝子転座陽性例に対するクリゾチニブ単剤はプラチナ併用療法との比較試験はないが,第Ⅰ/Ⅱ相試験において非常に高い有効性が示されており,ドライバー遺伝子に対する薬剤の特性と併せて,推奨グレードはAとした。
1次治療としてクリゾチニブ使用の2次治療以降:PS 0-1
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
1次治療としてクリゾチニブ使用の2次治療以降:PS 2
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
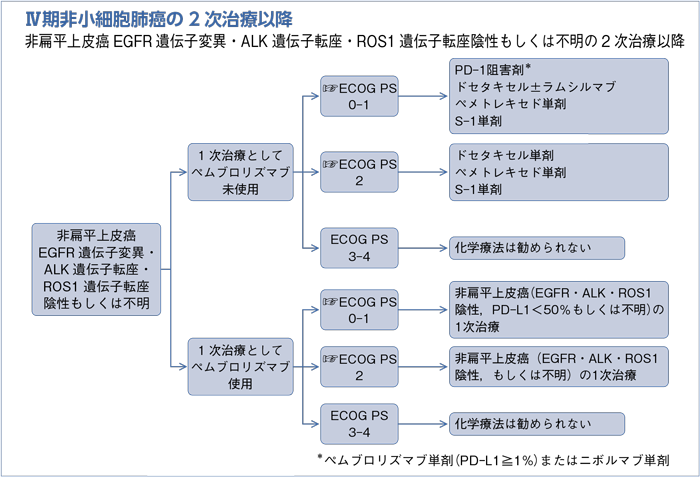
1次治療としてペムブロリズマブ未使用の2次治療以降:PS 0-1
- 推 奨
a.PD-1阻害剤を行うよう勧められる。(グレードA)
b.ラムシルマブは適応と考えられる症例においてドセタキセルに追加するよう勧められる。(グレードB)
c.ドセタキセル単剤を行うよう勧められる。(グレードB)
d.ペメトレキセド単剤を行うよう勧められる。(グレードB)
e.S-1単剤を行うよう勧められる。(グレードB)
〈PD-1阻害剤〉
a-1.ペムブロリズマブ単剤
その後,プラチナ併用療法を含む治療後に再発し腫瘍細胞のPD-L1陽性細胞≧1%の進行非小細胞肺癌を対象とし,ペムブロリズマブ単剤とDTX単剤を比較するランダム化比較Ⅱ/Ⅲ相試験が行われ,1,034例がペムブロリズマブ2mg/kg群,ペムブロリズマブ10mg/kg群,DTX群の3群に割り付けられた。主要評価項目は全集団ならびにPD-L1陽性細胞≧50%の症例におけるOSとPFSであった。全集団のOSは,それぞれ10.4カ月,12.7カ月,8.5カ月であり,DTX群に対して2mg/kg群でHR 0.71(P=0.0008),10mg/kgでHR 0.61(P<0.0001)と有意な延長を示した。PFSはそれぞれ3.9カ月,4.0カ月,4.0カ月と差を認めなかったが,ORRはそれぞれ18%,18%,9%とペムブロリズマブ群で有意に良好であった。PD-L1陽性細胞≧50%の症例におけるOSは,ペムブロリズマブ2mg/kg群で14.9カ月,10mg/kg群で17.3カ月,DTX群で8.2カ月であり,DTX群に対して2mg/kg群でHR 0.54(P=0.0002),10mg/kgでHR 0.50 (P<0.0001) と有意な延長を示し,PFSにおいてもそれぞれ5.0カ月(HR 0.59,P=0.0001),5.2カ月(HR 0.59,P<0.0001),4.1カ月とペムブロリズマブ群で有意に良好であった。ORRもそれぞれ30%,29%,8%とペムブロリズマブ群で有意に良好であり, PD-L1陽性細胞≧50%の症例においてOS,PFS,ORRともにDTX単剤との差は顕著であった。毒性に関しては,Grade 3以上の毒性はペムブロリズマブ2mg/kg群で13%,10mg/kg群で16%,DTX群で35%とペムブロリズマブ群で頻度が低く,ペムブロリズマブの免疫関連の毒性として甲状腺機能障害,肺臓炎,皮膚障害などが認められた。また,この試験においてペムブロリズマブ2mg/kg群と10mg/kg群での有効性や毒性の差は認めなかったことが報告されている33)。
以上より,PD-L1陽性細胞≧1%の症例においてペムブロリズマブ単剤を行うよう勧められ,推奨グレードはAとした。
a-2.ニボルマブ単剤
また,本邦において再発非小細胞肺癌を対象としたニボルマブ単剤の第Ⅱ相試験が行われ,非扁平上皮癌でORR 19.7%,PFS 2.8カ月の成績が報告された。主な毒性は発熱,倦怠感,食欲低下,発疹などであり,Grade 3以上の毒性は16.2%と忍容性は良好であったが,間質性肺合併症(間質性肺炎+肺障害)が7.2%(Grade 3以上が3.6%)に認められた35)。
以上より,ニボルマブ単剤を行うよう勧められ,推奨グレードはAとした。
前回,ニボルマブ単剤の推奨グレードはBであったが,今回は同じPD-1阻害剤であるペムブロリズマブ単剤の比較試験においてもDTX単剤と比較し有意なOSの延長という同様の結果が得られ,忍容性も良好であることより,両薬剤の推奨グレードはAとした。
〈ドセタキセル+ラムシルマブ併用療法〉
- b.
- プラチナ併用療法後に増悪した進行非小細胞肺癌症例を対象とし,ラムシルマブ+DTX併用療法とDTX単剤を比較する第Ⅲ相試験が行われ,主要評価項目であるOSは,ラムシルマブ併用群で有意な延長を認めた(10.5カ月vs 9.1カ月,HR 0.86,P=0.023)。また,ラムシルマブ併用群において,PFS(4.5カ月vs 3.0カ月,HR 0.76,P<0.0001),ORR(23% vs 14%,P<0.0001)も有意に良好であった。毒性に関しては,ラムシルマブ併用群でGrade 3/4の好中球減少,発熱性好中球減少,全Gradeの血小板減少,口内炎がより高頻度であったが,Grade 3以上の高血圧は6%で出血性イベントの多くはGrade 1/2であった36)。また,本邦においてラムシルマブ+DTX併用療法とDTX単剤のランダム化比較第Ⅱ相試験が行われ,ラムシルマブ併用群においてPFS(5.22カ月vs 4.21カ月,HR 0.83),OS(15.15カ月vs 13.93カ月,HR 0.77),ORR(28.9% vs 18.5%)ともに良好な結果が示された。毒性に関しては,ラムシルマブ併用群において発熱性好中球減少の頻度が高く(34% vs 19%),低アルブミン血症,血小板減少,口内炎,鼻出血,蛋白尿などもDTX単剤よりも高頻度であったが,ほとんどはGrade 1/2であった37)。ラムシルマブにおいてもベバシズマブと同様に出血リスクには注意が必要であり,投与に際してはその適応を十分検討する必要がある。
以上より,ラムシルマブは適応と考えられる症例においてDTXに追加するよう勧められる。効果と発熱性好中球減少をはじめとする有害事象のバランスを考慮し,推奨グレードはBとした。
〈ドセタキセル単剤〉
- c.
- プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤の第Ⅲ相試験が2つ報告されている。1つはDTX(100mg/m2 or 75mg/m2) vs VNR or IFMの比較試験でMSTでは有意差を認めないもののDTX 75mg/m2群でコントロール群と比較してORR,26週PFS率,1年生存率の有意な改善を認めた38)。また,DTX(100mg/m2 or 75mg/m2)とBSCの比較ではMST,1年生存率は,DTX 75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でDTX群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた39)。いずれの試験においても,DTX 75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはDTX 75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,MST 7.8カ月と上記2つの第Ⅲ相試験のDTX 75mg/m2と同等の効果を有する結果を報告した40)。
以上より,DTX単剤を行うよう勧められる。従来DTX単剤の推奨グレードはAであったが,今回3つの第Ⅲ相試験においてDTX単剤はペムブロリズマブ単剤,ニボルマブ単剤,DTX+ラムシルマブ療法にOSで有意に劣っていたことから,推奨グレードはBとした。
〈ペメトレキセド単剤〉
- d.
- 2004年に再発非小細胞肺癌の2次治療におけるPEM単剤とDTX単剤のランダム化比較第Ⅲ相試験が報告され,ORR,MSTはPEM群で9.1%,8.3カ月,DTX単剤群で8.8%,7.9カ月であり,主要評価項目であるMSTで同等の効果が報告された。毒性に関しては,Grade 3/4の好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がDTX群で有意に高かった41)。同試験を組織学的にレトロスペクティブに解析した結果,OSは非扁平上皮癌でそれぞれ9.3カ月と8.0カ月(HR 0.78,P=0.047)であるのに対し,扁平上皮癌でそれぞれ6.2カ月と7.4カ月(HR 1.56,P=0.018)であり,扁平上皮癌で有意差をもってDTX群で良好であった。また,mPFSにおいても,非扁平上皮癌でそれぞれ3.1カ月と3.0カ月(HR 0.82,P=0.076)と有意差を認めないものの,扁平上皮癌でそれぞれ2.3カ月と2.7カ月(HR 1.40,P=0.046)であり有意にDTX群が良好であったと報告された42)。一方本邦において,既治療非小細胞肺癌を対象にPEM 500mg/m2と1,000mg/m2のランダム化比較第Ⅱ相試験が行われ,用量による有意な効果と毒性の差を認めなかった43)。さらに,既治療非小細胞肺癌を対象にPEM 500mg/m2と900mg/m2のランダム化比較第Ⅲ相試験が行われ,ORR,MST,PFSは,500mg/m2群で7.1%,6.7カ月,2.6カ月,900mg/m2群で4.3%,6.9カ月,2.8カ月と統計学的に有意差を認めず,Grade 3/4の毒性は両群とも5%未満で900mg/m2群にて毒性の頻度が高い傾向にあったと報告された44)。
以上より,PEM単剤を行うよう勧められる。従来PEM単剤の推奨グレードはAであったが,DTX単剤と同様の理由で推奨グレードはBとした。
〈S-1単剤〉
- e.
- プラチナ既治療の再発非小細胞肺癌,PS 0-2を対象とし,S-1単剤とDTX単剤を比較する第Ⅲ相試験が日本を含むアジアで行われ,全生存期間中央値はS-1群で12.75カ月,DTX群で12.52カ月(HR 0.945, P=0.3818)であり,主要評価項目であるOSにおいてS-1単剤のDTX単剤に対する非劣性が示された。PFSはS-1群 2.86カ月,DTX群 2.89カ月(HR 1.033)で両群に差を認めず,ORRはS-1群8.3%,DTX群9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった45)。
以上より,S-1単剤はDTX単剤に対する非劣性が示されており行うよう勧められ,推奨グレードはBとした。
1次治療としてペムブロリズマブ未使用の2次治療以降:PS 2
- 推 奨
a.ドセタキセル単剤を行うよう勧められる。(グレードA)
b.ペメトレキセド単剤を行うよう勧められる。(グレードA)
c.S-1単剤を行うよう勧められる。(グレードA)
〈ドセタキセル単剤〉
- a.
- プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤の第Ⅲ相試験が2つ報告されている。1つはDTX(100mg/m2 or 75mg/m2)vs VNR or IFMの比較試験でMSTでは有意差を認めないもののDTX 75mg/m2群でコントロール群と比較してORR,26週PFS率,1年生存率の有意な改善を認めた38)。また,DTX(100mg/m2 or 75mg/m2)とBSCの比較ではMST,1年生存率は,DTX 75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でDTX群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた39)。いずれの試験においても,DTX 75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはDTX 75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,MST 7.8カ月と上記2つの第Ⅲ相試験のDTX 75mg/m2と同等の効果を有する結果を報告した40)。
以上より,DTX単剤を行うよう勧められ,推奨グレードはAとした。
〈ペメトレキセド単剤〉
- b.
- 2004年に再発非小細胞肺癌の2次治療におけるPEM単剤とDTX単剤のランダム化比較第Ⅲ相試験が報告され,ORR,MSTはPEM群で9.1%,8.3カ月,DTX群で8.8%,7.9カ月であり,主要評価項目であるMSTで同等の効果が報告された。毒性に関しては,Grade 3/4の好中球減少,発熱性好中球減少,全Gradeの脱毛の発現率がDTX群で有意に高かった41)。同試験を組織学的にレトロスペクティブに解析した結果,OSは非扁平上皮癌でそれぞれ9.3カ月と8.0カ月(HR 0.78,P=0.047)であるのに対し,扁平上皮癌でそれぞれ6.2カ月と7.4カ月(HR 1.56,P=0.018)であり,扁平上皮癌で有意差をもってDTX群で良好であった。また,mPFSにおいても,非扁平上皮癌でそれぞれ3.1カ月と3.0カ月(HR 0.82,P=0.076)と有意差を認めないものの,扁平上皮癌でそれぞれ2.3カ月と2.7カ月(HR 1.40,P=0.046)であり有意にDTX群が良好であったと報告された42)。一方本邦において,既治療非小細胞肺癌を対象にPEM 500mg/m2と1,000mg/m2のランダム化比較第Ⅱ相試験が行われ,用量による有意な効果と毒性の差を認めなかった43)。さらに,既治療非小細胞肺癌を対象にPEM 500mg/m2と900mg/m2のランダム化比較第Ⅲ相試験が行われ,ORR,MST,mPFSは,500mg/m2群で7.1%,6.7カ月,2.6カ月,900mg/m2群で4.3%,6.9カ月,2.8カ月と統計学的に有意差を認めず,Grade 3/4の毒性は両群とも5%未満で900mg/m2群にて毒性の頻度が高い傾向にあったと報告された44)。
以上より,PEM単剤を行うよう勧められ,推奨グレードはAとした。
〈S-1単剤〉
- c.
- プラチナ既治療の再発非小細胞肺癌,PS 0-2を対象とし,S-1単剤とDTX単剤を比較する第Ⅲ相試験が日本を含むアジアで行われ,全生存期間中央値はS-1群で12.75カ月,DTX群で12.52カ月(HR 0.945, P=0.3818)であり,主要評価項目であるOSにおいてS-1単剤のDTX単剤に対する非劣性が示された。PFSはS-1群2.86カ月,DTX群2.89カ月(HR 1.033)で両群に差を認めず,ORRはS-1群8.3%,DTX群9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった45)。
以上より,S-1単剤はDTX単剤に対する非劣性が示されており行うよう勧められ,推奨グレードはAとした。
1次治療としてペムブロリズマブ使用の2次治療以降:PS 0-1
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性,PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
1次治療としてペムブロリズマブ使用の2次治療以降:PS 2
- 推 奨
- 非扁平上皮癌(EGFR・ALK・ROS1陰性もしくは不明)の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
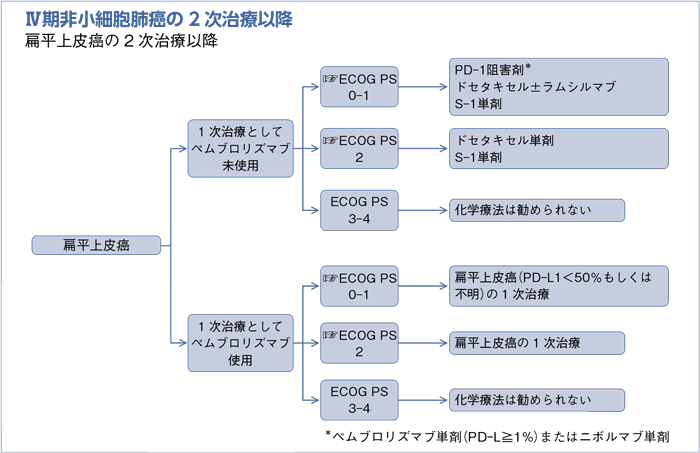
1次治療としてペムブロリズマブ未使用の2次治療以降:PS 0-1
- 推 奨
a.PD-1阻害剤を行うよう勧められる。(グレードA)
b.ラムシルマブは適応と考えられる症例においてドセタキセルに追加するよう勧められる。(グレードB)
c.ドセタキセル単剤を行うよう勧められる。(グレードB)
d.S-1単剤を行うよう勧められる。(グレードB)
〈PD-1阻害剤〉
a-1.ペムブロリズマブ単剤
その後,プラチナ併用療法を含む治療後に再発し腫瘍細胞のPD-L1陽性細胞≧1%の進行非小細胞肺癌を対象とし,ペムブロリズマブ単剤とDTX単剤を比較するランダム化比較Ⅱ/Ⅲ相試験が行われ,1,034例がペムブロリズマブ2mg/kg群,ペムブロリズマブ10mg/kg群,DTX群の3群に割り付けられた。主要評価項目は全集団ならびにPD-L1陽性細胞≧50%の症例におけるOSとPFSであった。全集団のOSは,それぞれ10.4カ月,12.7カ月,8.5カ月であり,DTX群に対して2mg/kg群でHR 0.71(P=0.0008),10mg/kgでHR 0.61(P<0.0001)と有意な延長を示した。PFSはそれぞれ3.9カ月 ,4.0カ月 ,4.0カ月と差を認めなかったが,ORRはそれぞれ18%,18%,9%とペムブロリズマブ群で有意に良好であった。PD-L1陽性細胞≧50%の症例におけるOSは,ペムブロリズマブ2mg/kg群で14.9カ月,10mg/kg群で17.3カ月,DTX群で8.2カ月であり,DTX群に対して2mg/kg群でHR 0.54(P=0.0002),10mg/kgでHR 0.50 (P<0.0001) と有意な延長を示し,PFSにおいてもそれぞれ5.0カ月(HR 0.59,P=0.0001),5.2 カ月(HR 0.59,P<0.0001),4.1カ月とペムブロリズマブ群で有意に良好であった。ORRもそれぞれ30%,29%,8%とペムブロリズマブ群で有意に良好であり,PD-L1陽性細胞≧50%の症例においてOS,PFS,ORRともにDTX単剤との差は顕著であった。毒性に関しては,Grade 3以上の毒性はペムブロリズマブ2mg/kg群で13%,10mg/kg群で16%,DTX群で35%とペムブロリズマブ群で頻度が低く,ペムブロリズマブの免疫関連の毒性として甲状腺機能障害,肺臓炎,皮膚障害などが認められた。また,この試験においてペムブロリズマブ2mg/kg群と10mg/kg群での有効性や毒性の差は認めなかったことが報告されている33)。
以上より,PD-L1陽性細胞≧1%の症例においてペムブロリズマブ単剤を行うよう勧められ,推奨グレードはAとした。
a-2.ニボルマブ単剤
また,本邦において再発非小細胞肺癌を対象としたニボルマブ単剤の第Ⅱ相試験が行われ,扁平上皮癌でORR 25.7%,mPFS 4.2カ月の成績が報告された。主な毒性は発熱,倦怠感,食欲低下,発疹などであり,Grade 3以上の毒性は16.2%と忍容性は良好であったが,間質性肺合併症(間質性肺炎+肺障害)が7.2%(Grade 3以上が3.6%)に認められた35)。
以上より,ニボルマブ単剤を行うよう勧められ,推奨グレードはAとした。
〈ドセタキセル+ラムシルマブ併用療法〉
- b.
- プラチナ併用療法後に増悪した進行非小細胞肺癌症例を対象とし,ラムシルマブ+DTX併用療法とDTX単剤を比較する第Ⅲ相試験が行われ,主要評価項目であるOSは,ラムシルマブ併用群で有意な延長を認めた(MST 10.5カ月vs 9.1カ月,HR 0.86,P=0.023)。また,ラムシルマブ併用群において,PFS(mPFS 4.5カ月vs. 3.0カ月,HR 0.76,P<0.0001),ORR(23% vs 14%,P<0.0001)も有意に良好であった。毒性に関しては,ラムシルマブ併用群でGrade 3/4の好中球減少,発熱性好中球減少,全Gradeの血小板減少,口内炎がより高頻度であったが,Grade 3以上の高血圧は6%で出血性イベントの多くはGrade 1/2であった36)。また,本邦においてラムシルマブ+DTX併用療法とDTX単剤のランダム化比較第Ⅱ相試験が行われ,ラムシルマブ併用群においてPFS(mPFS 5.22カ月vs 4.21カ月,HR 0.83),OS(MST 15.15カ月vs 13.93カ月,HR 0.77),ORR(28.9% vs 18.5%)ともに良好な結果が示された。毒性に関しては,ラムシルマブ併用群において発熱性好中球減少の頻度が高く(34% vs 19%),低アルブミン血症,血小板減少,口内炎,鼻出血,蛋白尿などもDTX単剤よりも高頻度であったが,ほとんどはGrade 1/2であった37)。ラムシルマブにおいてもベバシズマブと同様に出血リスクには注意が必要であり,投与に際してはその適応を十分検討する必要がある。
以上より,ラムシルマブは適応と考えられる症例においてDTXに追加するよう勧められる。効果と発熱性好中球減少をはじめとする有害事象のバランスを考慮し,推奨グレードはBとした。
〈ドセタキセル単剤〉
- c.
- プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤の第Ⅲ相試験が2つ報告されている。1つはDTX(100mg/m2 or 75mg/m2)vs VNR or IFMの比較試験でMSTでは有意差を認めないもののDTX 75mg/m2群でコントロール群と比較してORR,26週PFS率,1年生存率の有意な改善を認めた38)。また,DTX(100mg/m2 or 75mg/m2)とBSCの比較ではMST,1年生存率は,DTX 75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でDTX群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた39)。いずれの試験においても,DTX 75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはDTX 75mg/m2の有用性が確立された。本邦における承認用量は60 mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,MST 7.8カ月と上記2つの第Ⅲ相試験のDTX 75mg/m2と同等の効果を有する結果を報告した40)。
以上より,DTX単剤を行うよう勧められる。従来DTX単剤の推奨グレードはAであったが,今回3つの第Ⅲ相試験においてDTX単剤はペムブロリズマブ単剤,ニボルマブ単剤,DTX+ラムシルマブ療法にOSで有意に劣っていたことから推奨グレードはBとした。
〈S-1単剤〉
- d.
- プラチナ既治療の再発非小細胞肺癌,PS 0-2を対象とし,S-1単剤とDTX単剤を比較する第Ⅲ相試験が日本を含むアジアで行われ,全生存期間中央値はS-1群で12.75カ月,DTX群で12.52カ月(HR 0.945, P=0.3818)であり,主要評価項目であるOSにおいてS-1単剤のDTX単剤に対する非劣性が示された。PFSはS-1群 2.86カ月,DTX群 2.89カ月(HR 1.033)で両群に差を認めず,ORRはS-1群8.3%,DTX群9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった45)。
以上より,S-1単剤はDTX単剤に対する非劣性が示されており行うよう勧められ,推奨グレードはBとした。
1次治療としてペムブロリズマブ未使用の2次治療以降:PS 2
- 推 奨
a.ドセタキセル単剤を行うよう勧められる。(グレードA)
b.S-1単剤を行うよう勧められる。(グレードA)
〈ドセタキセル単剤〉
- a.
- プラチナ製剤を含む化学療法無効または奏効後に再発した非小細胞肺癌患者を対象としたDTX単剤の第Ⅲ相試験が2つ報告されている。1つはDTX(100 mg/m2 or 75 mg/m2)vs VNR or IFMの比較試験で,MSTでは有意差を認めないもののDTX 75mg/m2群でコントロール群と比較してORR,26週PFS率,1年生存率の有意な改善を認めた38)。また,DTX(100mg/m2 or 75mg/m2)とBSCの比較ではMST,1年生存率は,DTX 75mg/m2,BSC群でそれぞれ7.5カ月と37%,4.6カ月と19%でDTX群で有意に優れ(P=0.010,P=0.003),QOLの改善も認められた39)。いずれの試験においても,DTX 75mg/m2群が最も治療成績が優れており,プラチナ製剤を含む治療後の不応ないし再発例に対する非小細胞癌の化学療法としてはDTX 75mg/m2の有用性が確立された。本邦における承認用量は60mg/m2であるが,本邦で行われたこの用量における第Ⅱ相試験でORR 18.2%,MST 7.8カ月と上記2つの第Ⅲ相試験のDTX 75mg/m2と同等の効果を有する結果を報告した40)。
以上より,DTX単剤を行うよう勧められ,推奨グレードはAとした。
〈S-1単剤〉
- b.
- プラチナ既治療の再発非小細胞肺癌,PS 0-2を対象とし,S-1単剤とDTX単剤を比較する第Ⅲ相試験が日本を含むアジアで行われ,全生存期間中央値はS-1群で12.75カ月,DTX群で12.52カ月(HR 0.945, P=0.3818)であり,主要評価項目であるOSにおいてS-1単剤のDTX単剤に対する非劣性が示された。PFSはS-1群 2.86カ月,DTX群 2.89カ月(HR 1.033)で両群に差を認めず,ORRはS-1群 8.3%,DTX群 9.9%であった。毒性に関しては,発熱性好中球減少ならびにGrade 3以上の好中球減少の頻度はDTX群で高く(0.9% vs 13.6%,5.4% vs 47.7%),全Gradeの下痢と口腔粘膜障害の頻度はS-1群で高かったが(37.2% vs 18.2%,23.9% vs 14.5%),Grade 3以上の頻度は低く忍容性は良好であった45)。
以上より,S-1単剤はDTX単剤に対する非劣性が示されており行うよう勧められ,推奨グレードはAとした。
1次治療としてペムブロリズマブ使用の2次治療以降:PS 0-1
- 推 奨
- 扁平上皮癌(PD-L1陽性細胞<50%もしくは不明)の1次治療:PS 0-1で推奨されるレジメンを行うよう勧められる。(グレードB)
ペムブロリズマブ後の化学療法に関するデータは少なく,現時点では今まで蓄積されたデータを参考とし,扁平上皮癌(PD-L1陽性細胞<50%もしくは不明)PS 0-1の1次治療に準じて治療を行う。
1次治療としてペムブロリズマブ使用の2次治療以降:PS 2
- 推 奨
- 扁平上皮癌の1次治療:PS 2で推奨されるレジメンを行うよう勧められる。(グレードB)
ペムブロリズマブ後の化学療法に関するデータは少なく,現時点では今まで蓄積されたデータを参考とし,扁平上皮癌 PS 2の1次治療に準じて治療を行う。
- 1)Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8. (II)
- 2)Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8. (II)
- 3)Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42. (II)
- 4)Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46. (II)
- 5)Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013; 31(27): 3327-34. (II)
- 6)Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22. (II)
- 7)Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naïve non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002). Ann Oncol. 2013; 24(1): 54-9. (II)
- 8)Zhou C, Wu YL, Chen G, et al. Final overall survival results from a randomised, phase III study of erlotinib versus chemotherapy as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer(OPTIMAL, CTONG-0802). Ann Oncol. 2015; 26(9): 1877-83. (II)
- 9)Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67. (III)
- 10)Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400. (III)
- 11)Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer: a cohort and nested case-control study. Am J Respir Crit Care Med. 2008; 177(12): 1348-57. (IV)
- 12)Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006; 24(16): 2549-56. (IV)
- 13)Mok T, Wu YL, Ahn MJ, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M Positive Lung Cancer. N Engl J Med. 2016, epub ahead of print. (II)
- 14)Satouchi M, Hirashima T, Hida T, et al. Osimertinib in Pre-treated Patients with T790M-positive Advanced NSCLC: Updated Phase 1 and Pooled Phase 2 Results. JSMO annual meeting 2016. (III)
- 15)Soria JC, Wu YL, Nakagawa K, et al. Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib(IMPRESS): a phase 3 randomised trial. Lancet Oncol. 2015; 16(8): 990-8. (II)
- 16)Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on“uncommon”epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res. 2011; 17(11): 3812-21. (IV)
- 17)Yang JC, Seguist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8. (IV)
- 18)Seto T, Kiura K, Nishio M, et al. CH5424802(RO5424802)for patients with ALK-rearranged advanced non-small-cell lung cancer(AF-001JP study): a single-arm, open-label, phase 1-2 study. Lancet Oncol. 2013; 14(7): 590-8. (III)
- 19)Ohe Y, Nishio M, Kiura K, et al. A phase I/II study with a CNS-penetrant, selective ALK inhibitor alectinib in ALK-rearranged non-small cell lung cancer patients: Updates on progression free survival and safety results from AF-001JP. J Clin Oncol. 2015; 33(suppl; abstr 8061). (III)
- 20)Nokihara H, Hida T, Kondo M, et al. Alectinib(ALC)versus crizotinib(CRZ)in ALK-inhibitor naive ALK-positive non-small cell lung cancer(ALK+NSCLC): Primary results from the J-ALEX study. J Clin Oncol. 2016; 34(suppl; abstr 9008). (II)
- 21)Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med. 2013; 368(25): 2385-94. (II)
- 22)Solomon BJ, Mok T, Kim DW, et al; PROFILE 1014 Investigators. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77. (II)
- 23)Gadgeel SM, Gandhi L, Riely GJ, et al. Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer(AF-002JG): results from the dose-finding portion of a phase 1/2 study. Lancet Oncol. 2014; 15(10): 1119-28. (III)
- 24)Ou SH, Ahn JS, De Petris L, et al. Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer:A Phase II Global Study. J Clin Oncol. 2016;34(7):661-8. (III)
- 25)Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer:a single-group, multicentre, phase 2 trial. Lancet Oncol. 2016;17(2):234-42. (III)
- 26)Hotta K, Hida T, Nakagawa K, et al. Updated data from JP28927 study of alectinib in ALK+NSCLC patients with or without history of ALK inhibitor treatment. J Thorac Oncol. 2015; 10(9): suppl 2; P3.01-020. (III)
- 27)Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 370(13): 1189-97. (III)
- 28)Crinò L, Ahn MJ, De Marinis F, et al. Multicenter Phase II Study of Whole--Body and Intracranial Activity With Ceritinib in Patients With ALK-Rearranged Non-Small-Cell Lung Cancer Previously Treated With Chemotherapy and Crizotinib:Results From ASCEND-2. J Clin Oncol. 2016;34(24):2866-73. (III)
- 29)Nishio M, Murakami H, Horiike A, et al. Phase I Study of Ceritinib(LDK378)in Japanese Patients with Advanced, Anaplastic Lymphoma Kinase-Rearranged Non-Small-Cell Lung Cancer or Other Tumors. J Thorac Oncol. 2015; 10(7): 1058-66. (III)
- 30)Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014;371(21):1963-71.(III)
- 31)Goto K, Yang JC, Kim DW, et al. Phase II study of crizotinib in east Asian patients(pts)with ROS1-positive advanced non-small cell lung cancer(NSCLC). J Clin Oncol. 2016;34(suppl;abstr 9022).(III)
- 32)Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med. 2015;372(21):2018-28.(III)
- 33)Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial. Lancet. 2016;387(10027):1540-50.(II)
- 34)Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(17): 1627-39. (II)
- 35)Nishio M, Hida T, Nakagawa K, et al. Phase II studies of nivolumab(anti-PD-1, BMS-936558, ONO-4538)in patients with advanced squamous(sq)or nonsquamous(non-sq)non-small cell lung cancer(NSCLC). J Clin Oncol. 2015; 33(suppl; abstr 8027). (III)
- 36)Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy(REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet. 2014; 23; 384(9944): 665-73. (II)
- 37)Hosomi Y, Yoh K, Kasahara K, et al. Docetaxel+ramucirumab(DR)versus docetaxel+placebo(D)as second-line treatment for advanced non-small cell lung cancer(NSCLC): A randomized, phase II, double-blind, multicenter trial in Japan. J Clin Oncol. 2015; 33(suppl; abstr 8054). (II)
- 38)Fossella FV, DeVore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol. 2000; 18(12): 2354-62. (II)
- 39)Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol. 2000; 18(10): 2095-103. (II)
- 40)Mukohara T, Takeda K, Miyazaki M, et al. Japanese experience with second-line chemotherapy with low-dose(60 mg/M2)docetaxel in patients with advanced non-small-cell lung cancer. Cancer Chemother Pharmacol. 2001; 48(5): 356-60. (IV)
- 41)Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol. 2004; 22(9): 1589-97. (II)
- 42)Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase III studies. Oncologist. 2009; 14(3): 253-63. (II)
- 43)Ohe Y, Ichinose Y, Nakagawa K, et al. Efficacy and safety of two doses of pemetrexed supplemented with folic acid and vitamin B12 in previously treated patients with non-small cell lung cancer. Clin Cancer Res. 2008; 14(13): 4206-12. (II)
- 44)Cullen MH, Zatloukal P, Sörenson S, et al. A randomized phase III trial comparing standard and high-dose pemetrexed as second-line treatment in patients with locally advanced or metastatic non-small-cell lung cancer. Ann Oncol. 2008; 19(5): 939-45. (IV)
- 45)Nishio M, Mok T, Nakagawa K, et al. EAST-LC:Randomized controlled phase III trial of S-1 versus docetaxel in patients with non-small-cell lung cancer who had received a platinum-based treatment. Annals of Oncol. 2016;27(Suppl 6)1218PD.(II)
- 46)Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016.[Epub ahead of print](II)
- 47)Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015; 373(2): 123-35. (II)
レジメン:Ⅳ期非小細胞肺癌の2次治療以降
単剤療法
| ペムブロリズマブ | 投与方法は添付文書を参照 | |
| ニボルマブ | 3 mg/kg, on day 1 | q2w |
| DTX | 60 mg/m2, on day 1 | q3w |
| ラムシルマブ | 10 mg/kg, on day 1 | |
| DTX | 60 mg/m2, on day 1 | q3w |
| PEM | 500 mg/m2, on day 1 | q3w |
※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,本剤の投与を中止または終了する場合には,本剤最終投与日から22日目まで可能なかぎり葉酸を投与する。
②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,本剤投与期間中および投与中止後22日目まで9週ごと(3コースごと)に1回投与する。
内服療法
| S-1 | 80-120 mg/body, on days 1-28 | 1日2回,q6w |
| ゲフィチニブ | 250 mg/日 1錠 | 1日1回 |
| エルロチニブ | 150 mg/日 1錠 | 1日1回 |
| アファチニブ | 40 mg/日 1錠 | 1日1回 |
| オシメルチニブ | 80 mg/日 1錠 | 1日1回 |
| クリゾチニブ | 500 mg/日,250 mg 2錠(1回1錠) | 1日2回 |
| アレクチニブ | 600 mg/日,150 mg 4錠(1回2錠) | 1日2回 |
| セリチニブ | 750 mg/日,150 mg 5錠 | 1日1回 |