5
Ⅱ.非小細胞肺癌
文献検索と採択

本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | nab-PTX | ナブパクリタキセル |
|---|---|---|---|
| CDDP | シスプラチン | PEM | ペメトレキセド |
| CPT-11 | イリノテカン | PTX | パクリタキセル |
| DTX | ドセタキセル | VNR | ビノレルビン |
| GEM | ゲムシタビン | ||
| プラチナ製剤 | CDDPとCBDCAの総称 | |
|---|---|---|
| 第1・2世代のEGFR-TKI | ゲフィチニブ・エルロチニブ・アファチニブの総称 | |
| ALK | anaplastic lymphoma kinase | 未分化リンパ腫キナーゼ |
| ECOG | eastern cooperative oncology group | 米国東海岸癌臨床試験グループ |
| EGFR | epidermal growth factor receptor | 上皮成長因子受容体 |
| ORR | objective response rate | 客観的奏効率 |
| OS | overall survival | 全生存期間 |
| PFS | progression free survival | 無増悪生存期間 |
| PS | performance status | 一般状態 |
| QOL | quality of life | 生活の質 |
| TKI | tyrosine kinase inhibitor | チロシンキナーゼ阻害剤 |
| Score | 定 義 |
|---|---|
| 0 | 全く問題なく活動できる。 発病前と同じ日常生活が制限なく行える。 |
| 1 | 肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる。例:軽い家事、事務作業 |
| 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。 日中の50%以上はベッド外で過ごす。 |
| 3 | 限られた自分の身の回りのことしかできない。 日中の50%以上をベッドか椅子で過ごす。 |
| 4 | 全く動けない。 自分の身の回りのことは全くできない。 完全にベッドか椅子で過ごす。 |
出典:Common Toxicity Criteria Version2.0 Publish Date April 30, 1999
(JCOGホームページhttp://www.jcog.jp/より引用)
しかしながら,日本の臨床試験においては75歳以上の患者が除外されていることが多く,75歳以上の高齢者のデータは少ない。また,近年の70歳以上の高齢者を対象とした第3世代抗癌剤単剤とプラチナ製剤併用療法を比較した2編の第Ⅲ相試験において両試験とも登録された患者の多くが75歳以上であった。
以上より,本ガイドラインでは「75歳以上」を高齢者と定義する。
- Switch maintenance:プラチナ併用化学療法による導入療法後,導入療法で使用した薬剤とは別の薬剤に切り替えて投与する方法。
- Continuation maintenance:プラチナ併用化学療法による導入療法後,プラチナ製剤と併用した薬剤を継続して投与する方法。
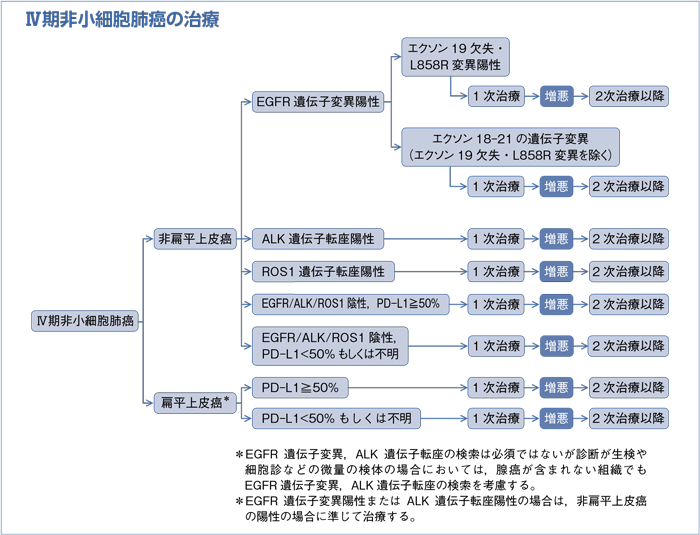
樹形図
- 推 奨
- ECOG PS 0-2で全身状態良好なⅣ期非小細胞肺癌患者に対する化学療法は生存期間を延長し,QOLも改善することから,行うよう勧められる。(グレードA)
毒性については,別のメタアナリシスで進行非小細胞肺癌における化学療法の治療関連死が1.26%であったと報告されており,その内訳は発熱性好中球減少,虚血や血栓などの心血管系の毒性,肺炎や間質性肺障害などの肺毒性であった3)。
QOLに関しては,第3世代抗癌剤単剤は緩和治療と比較してQOLが改善することが報告されている4)。GEMとCBDCA+GEMの第Ⅲ相試験では,後者がOS・PFS延長を示すと同時にQOLは同等であったとしている5)。ゲフィチニブ単剤はEGFR遺伝子変異陽性患者を対象としたCBDCA+PTXとの第Ⅲ相試験においてQOL指標の一部が有意に優れていたことが示されている6)。
以上より,ECOG PS 0-2で全身状態良好なⅣ期非小細胞肺癌患者に対する化学療法は,治療関連死を含む毒性のリスクはあるが生存期間を延長しQOLを改善することより行うよう勧められる。
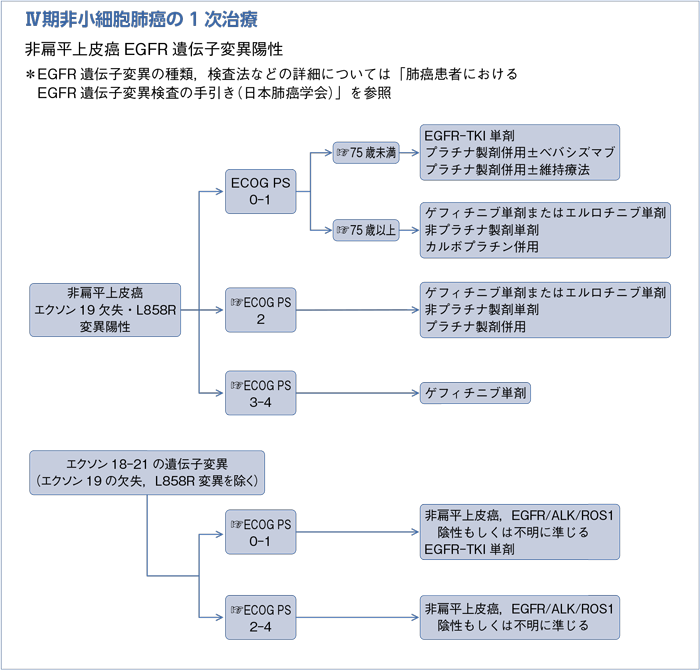
- 推 奨
a.EGFR-TKI単剤(ゲフィチニブ,エルロチニブ,アファチニブのいずれか)を行うよう勧められる。(グレードA)
b.1次治療で推奨される細胞障害性抗癌剤を行うよう勧められる。(グレードB)
c.エルロチニブ+ベバシズマブを行うように考慮してもよい。(グレードC1)
- a・b・c.
- EGFR遺伝子変異の約90%を占めるエクソン19の欠失変異とエクソン21のL858R変異はEGFR-TKIの感受性を高める7)。進行非小細胞肺癌を対象にしたEGFR-TKI単剤(ゲフィチニブ,エルロチニブ,アファチニブ)とプラチナ製剤併用療法の比較第Ⅲ相試験におけるEGFR遺伝子変異の患者はエクソン19の欠失変異とL858R変異に限定されているか8)~10),大部分を占めていた11)~13)。すべての試験において一貫してEGFR-TKI単剤のプラチナ製剤併用療法に対するPFSの有意な延長が報告され,QOL指標の一部が改善することも示されている6)。以上より,PS 0-1,75歳未満に対しては,EGFR-TKI単剤を推奨グレードAとし,1次治療で推奨される細胞障害性抗癌剤を推奨グレードBとした。
EGFR-TKI単剤のプラチナ製剤併用療法に対するOSの差は示されていない10)14)。大規模研究において,1次から3次治療のエルロチニブ単剤のPFSに有意差を認めないことが報告されている15)。ただしアファチニブの2つの第Ⅲ相試験の統合解析ではエクソン19の欠失変異を有する患者はアファチニブがプラチナ製剤併用療法に対してOSの差を示した13)。EGFR遺伝子変異陽性患者において,全治療期間におけるEGFR-TKI単剤と細胞障害性抗癌剤の投与順序に関しては,現時点で明確な結論はないが,EGFR遺伝子変異陽性患者に対してはEGFR-TKI単剤による治療を逸しないことが推奨される。
EGFR-TKI同士を直接比較した第Ⅲ相試験はない。ランダム化第Ⅱ相試験では,アファチニブがゲフィチニブに対して,エルロチニブ+ベバシズマブがエルロチニブに対して,PFSの延長が示されたものの,毒性はより高度であった16)17)。後者の試験において,ORRは69% vs 64%と差がなかったものの,PFSは16.0カ月vs 9.7カ月(HR 0.54, P=0.0015)と延長していた。毒性については併用群でベバシズマブ関連の有害事象が認められている。現時点で第Ⅱ相試験1本の結果であり,OSなどの長期データが不十分であることから,推奨グレードはC1とする。
EGFR-TKIの主な毒性は,下痢,皮疹,爪囲炎,肝機能障害などであり,各々の薬剤で毒性の頻度や重症度が異なることが報告されているが,休薬や減量を行うことで長期間の服用が可能であることが示されている8)9)12)13)18)。
- 推 奨
a.ゲフィチニブ単剤またはエルロチニブ単剤を行うよう勧められる。(グレードA)
b.1次治療で推奨される細胞障害性抗癌剤を行うよう勧められる。(グレードB)
- a・b.
- 75歳以上のEGFR遺伝子変異陽性進行非小細胞肺癌を対象とした国内でのゲフィチニブ単剤の第Ⅱ相試験において,ORR 74%,PFS 12.3カ月と若年者と同等の有効性と安全性が報告されている18)。エルロチニブ単剤については国内での第Ⅱ相試験において,75歳超と75歳以下で同等の有効性が示されている19)。アファチニブ単剤に関しては第Ⅲ相試験におけるサブグループ解析において,65歳以上は65歳未満と同等の有効性が報告されているが,75歳以上の高齢者における安全性の検討は十分ではない12)20)。以上より,PS 0-1,75歳以上の高齢者に対しては,ゲフィチニブ単剤またはエルロチニブ単剤を推奨グレードAとし,1次治療で推奨される細胞障害性抗癌剤を推奨グレードBとした。
EGFR-TKIの主な毒性は,下痢,皮疹,爪囲炎,肝機能障害などであり,各々の薬剤で毒性の頻度や重症度が異なることが報告されているが,休薬や減量を行うことで長期間の服用が可能であることが示されている8)9)11)12)20)21)。一方,高齢は間質性肺炎発症の危険因子であることが報告されており注意が必要である22)。
- 推 奨
a.ゲフィチニブ単剤またはエルロチニブ単剤を行うよう勧められる。(グレードA)
b.1次治療で推奨される細胞障害性抗癌剤を行うよう勧められる。(グレードB)
- a・b.
- EGFR遺伝子変異陽性の進行非小細胞肺癌を対象としたエルロチニブ単剤とプラチナ製剤併用療法の2つの第Ⅲ相試験において,PS 2は各々7%,14%含まれておりPS 0-1と同等の有効性が示されている9)21)。また,ゲフィチニブ単剤はPS不良例に対する有効性が報告されている18)23)。アファチニブ単剤に関しては,PS 2に対する安全性・有効性の検討は十分ではない12)20)。以上より,PS 2に対しては,ゲフィチニブ単剤またはエルロチニブ単剤を推奨グレードAとし,1次治療で推奨される細胞障害性抗癌剤を推奨グレードBとした。
EGFR-TKIの主な毒性は,下痢,皮疹,爪囲炎,肝機能障害などであり,各々の薬剤で毒性の頻度や重症度が異なることが報告されているが,休薬や減量を行うことで長期間の服用が可能であることが示されている8)9)11)12)20)21)。一方,PS 2以上は間質性肺炎発症の危険因子であることが報告されており注意が必要である22)24)。
- 推 奨
- ゲフィチニブ単剤を行うよう考慮してもよい。(グレードC1)
- 推 奨
a.1次治療で推奨される細胞障害性抗癌剤を行うよう勧められる。(グレードA)
b.エクソン18-21の遺伝子変異(エクソン19欠失・L858R変異を除く)にはEGFR-TKI(ゲフィチニブ,エルロチニブ,アファチニブ)による治療を考慮してもよい。(グレードC1)
- a.
- EGFR遺伝子変異の約90%をエクソン19の欠失変異,エクソン21のL858R変異が占める7)。その他の遺伝子変異はuncommon mutationと称され,エクソン18-21にわたり(E709X,G719X,S768I,P848L,L861Q,エクソン19の挿入変異など)が報告されている。これらの変異でもEGFR-TKIの感受性を上げるが奏効率はやや劣ると報告されている25)。第Ⅲ相試験の多くは,これらの変異を除外したり8)~10),1割程度しか占めていない11)~13)。奏効率もエクソン19の欠失変異やL858Rと比べると相対的に低いことから,細胞障害性抗癌剤をグレードAとした。
- b.
- T790Mとエクソン20の挿入変異以外のuncommon mutationではEGFR-TKIにても48~71%の奏効率が得られている25)26)。なかでもアファチニブの奏効率は71.1%とゲフィチニブやエルロチニブより高い傾向にあった26)。以上からEGFR-TKIによる治療を考慮してもよいと考えグレードC1とした。EGFR-TKI同士の優越を比較した試験はないために,薬剤による効果の違いは推奨度に加味していない。
エクソン20のT790Mと挿入変異はEGFR遺伝子変異による効果は限定的である。T790Mは耐性変異として同定されており,ゲフィチニブ,エルロチニブ,アファチニブは臨床上,効果が乏しい。オシメルチニブの効果が示されているものの,初回治療としてのエビデンスはない26)27)(2次治療を参照)。エクソン20の挿入変異の報告は少なく奏効例も限定的であることからEGFR-TKIを初回治療として使うことは推奨されない26)28)。
*Uncommon mutationがある場合は,エクソン19の欠失とL858R変異が同時にあったとしても,uncommon mutationに分類した。
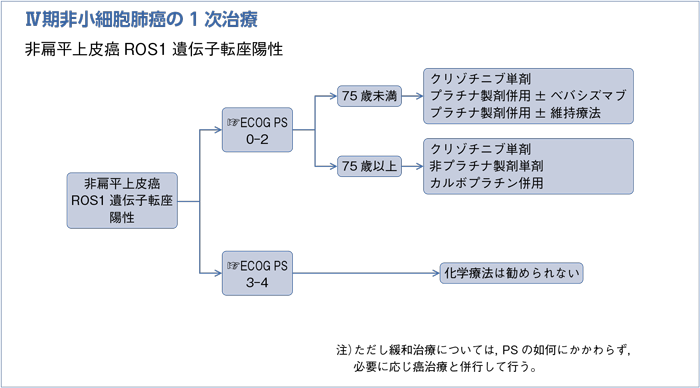
- 推 奨
- 非扁平上皮癌,EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座陰性もしくは不明に従う。
以上より,EGFR遺伝子のエクソン18-21の遺伝子変異(エクソン19欠失・L858R変異を除く)・PS 2-4に対するEGFR-TKIは現時点では行うように勧めるだけの根拠が明確ではない。以上より治療方針は非扁平上皮癌,EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座陰性もしくは不明に従うとした。
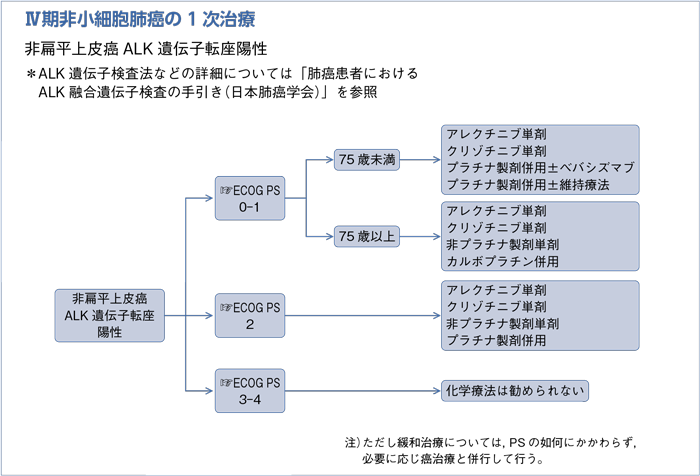
- 推 奨
a.アレクチニブ単剤を行うよう勧められる。(グレードA)
b.クリゾチニブ単剤を行うよう勧められる。(グレードB)
c.1次治療で用いられる細胞障害性抗癌剤を行うことを考慮してもよい。(グレードC1)
- a・b・c.
- 1次治療としてALK遺伝子転座陽性の進行非小細胞肺癌を対象にしたクリゾチニブとプラチナ製剤併用療法の比較第Ⅲ相試験が行われ,PFSは10.9カ月vs 7.0カ月(HR 0.45,95%CI:0.35-0.60;P<0.0001),ORRも74% vs 45%とクリゾチニブのプラチナ製剤併用療法に対するPFSの有意な延長が報告された29)。2016年のASCOではアレクチニブがクリゾチニブよりもPFSが未到達vs 10.2カ月(HR 0.34,95%CI:0.17-0.71,P<0.0001)と延長することが報告された30)。主要評価項目であるPFSの延長が日本の第Ⅲ相試験で示されたので推奨グレードAとした。あわせてクリゾチニブを推奨グレードB,1次治療で推奨される細胞障害性抗癌剤を推奨グレードC1とした。
- 推 奨
- ALK-TKIは行うよう勧めるだけの根拠が明確ではない。(グレードC2)
EGFR遺伝子変異陽性・PS不良例においてEGFR-TKIの有効性が示されたように,ALK遺伝子転座陽性・PS不良例においてもALK-TKIの有効性が期待できる可能性はあるが,PS不良例に関してはこれまでの臨床試験で数例の参加が確認されるのみで有効性・安全性に関するデータは乏しい。ALK-TKIによる有害事象も報告されており,PS不良例における安全性については慎重に検討していく必要がある。
以上より,ALK遺伝子転座陽性・PS 3-4に対するALK-TKIは現時点では行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
- 推 奨
a.クリゾチニブ単剤を行うよう勧められる。(グレードA)
b.1次治療で用いられる細胞障害性抗癌剤を行うよう勧められる。(グレードB)
- a・b.
- ROS1遺伝子転座ではクリゾチニブの効果が複数報告されている。米国を中心とした試験では50人が参加し,奏効割合は72%,PFS 19.2カ月であった31)。東アジアで実施された試験では127人が登録され,奏効割合69.3%,PFS 13.4カ月であった32)。これらはクリゾチニブのALK阻害薬に対する効果と同等以上であり,ドライバー遺伝子に対する分子標的薬の他剤の効果と併せてグレードAとした。1次治療で推奨される細胞障害性抗癌剤を推奨グレードBとした。
PS 2の患者については,米国を中心とした試験は1例のみ登録されている。アジアの試験はPS 0-1が対象であった。PS 2のROS1患者に対してクリゾチニブが有効である試験結果はないが,他の分子標的治療薬と同様にクリゾチニブが有効である可能性が高いので,推奨グレードはAとした。
*本稿執筆時点(2016年11月1日)で,ROS1遺伝子転座陽性例に対するクリゾチニブは本邦で保険償還されていない。承認後の使用に際しては添付文書の記載をよく確認すること。
- 推 奨
- クリゾチニブは行うよう勧めるだけの根拠が明確ではない。(グレードC2)
EGFR遺伝子変異陽性・PS不良例においてEGFR-TKIの有効性が示されたように,ROS1遺伝子転座陽性・PS不良例においてもクリゾチニブの有効性が期待できる可能性はあるが,PS不良例に関してはこれまでの臨床試験で数例の参加が確認されるのみで有効性・安全性に関するデータは乏しい。クリゾチニブによる有害事象も報告されており,PS不良例における安全性については慎重に検討していく必要がある。
以上よりクリゾチニブは現時点では行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
*本稿執筆時点(2016年11月1日)で,ROS1遺伝子転座陽性例に対するクリゾチニブは本邦で保険償還されていない。承認後の使用に際しては添付文書の記載をよく確認すること。
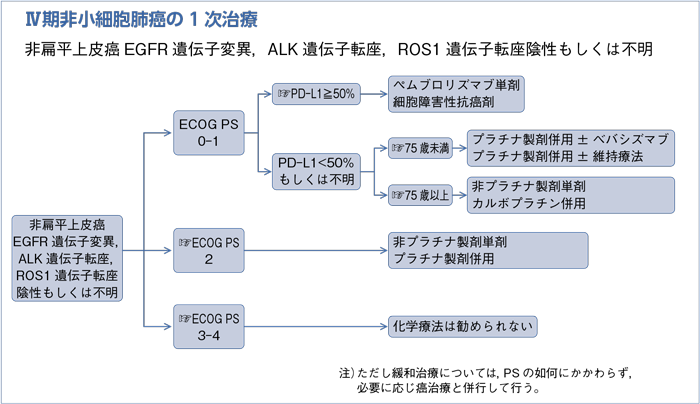
- 推 奨
a.PD-L1陽性細胞≧50%ではペムブロリズマブ単剤を行うように勧められる。(グレードA)
b.1次治療で用いられる細胞障害性抗癌剤を行うよう勧められる。(グレードB)
- a.
- EGFR変異やALK転座がなく,PD-L1陽性細胞が50%以上のPS 0または1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤200 mg/body 3週毎または細胞障害性抗癌剤を比較する第Ⅲ相試験が行われ305人がランダム化された。細胞障害性抗癌剤群の患者66人(43.7%)がペムブロリズマブ単剤へクロスオーバーした。主要評価項目はPFS,副次評価項目はOS,ORRであった。中間解析の結果がESMO2016で発表され,ペムブロリズマブvs細胞障害性抗癌剤はPFS中央値10.3 vs 6.0カ月(HR 0.50, 95%CI:0.37-0.68,P<0.001),OSは中央値が得られず(HR 0.60,95%CI:0.41-0.89,P=0.005),2年生存率は80.2 vs 72.4%,ORR 44.8 vs 27.8%であった33)。以上からPD-L1陽性細胞が50%以上が確認された患者では初回化学療法としてペムブロリズマブ単剤が勧められる。
- b.
- EGFR遺伝子変異陰性,ALK遺伝子転座陰性,ROS1遺伝子転座陰性もしくは不明でPD‒L1≧50%に対しては,ペムブロリズマブが可能な場合はグレードAとして推奨するために,従来の細胞障害性抗癌剤はグレードBとした。
*本稿執筆時点(2016年11月1日)で,化学療法未治療例に対するペムブロリズマブは本邦で保険償還されていない。承認後の使用に際しては添付文書の記載をよく確認すること。
- 推 奨
- 〈レジメン〉
a.プラチナ製剤と第3世代以降の抗癌剤併用を行うよう勧められる。(グレードA)
b.ベバシズマブはリスクを考慮し,適応と考えられる非扁平上皮癌ではプラチナ製剤併用療法に追加するよう勧められる。(グレードB)
- 〈投与期間〉
c.プラチナ製剤併用療法の投与期間は6コース以下とするよう勧められる。(グレードA)
- 〈維持療法〉
d.PS 0-1に対するシスプラチン+ペメトレキセド併用療法4コース後,病勢増悪を認めず毒性も忍容可能なものに対してペメトレキセドによるcontinuation maintenanceを行うよう勧められる。(グレードB)
e.PS 0-1に対するプラチナ製剤併用療法4コース後,病勢増悪を認めず毒性も忍容可能なものに対してペメトレキセドあるいはエルロチニブによるswitch maintenanceを考慮してもよい。(グレードC1)
〈レジメン〉
- a.
- 非/軽喫煙者の進行肺腺癌を対象にしたゲフィチニブ単剤とCBDCA+PTXの第Ⅲ相試験においてEGFR遺伝子変異陽性と陰性でゲフィチニブ単剤のORRに著明な差がみられ(72% vs 1%),PFSにおいても同様の傾向が確認された(9.5カ月vs 1.5カ月)34)35)。EGFR遺伝子変異不明例における6カ月以降のPFSはゲフィチニブ単剤がCBDCA+PTXより優れていたが,両群のPFS曲線が交差しており,この結果からゲフィチニブ単剤の優位性を判断することは困難である。また背景因子による選択のみでは約40%でEGFR遺伝子変異陰性であったことも留意する必要がある。よってEGFR遺伝子変異陰性,不明例に対するEGFR‒TKI単剤は推奨されない。ALK遺伝子転座陰性例,ROS1陰性例に対するクリゾチニブ単剤の有効性は確認されておらず,推奨されない。
プラチナ製剤併用の薬剤を第2世代と第3世代抗癌剤で比較したメタアナリシスにおいて,後者がORRで12%,1年生存率で6%優ると報告した2)。本邦でも複数の第Ⅲ相試験が行われている。4種類の第3世代抗癌剤とプラチナ製剤併用の第Ⅲ相試験の結果を報告しており,いずれの効果も同等であった36)。S-1の有効性を評価した2つの試験で,CBDCA+S-1はCBDCA+PTXに対して,CDDP+S-1はCDDP+DTXに対する非劣性が示された37)38)。その他,ヒト血清アルブミンとPTXを結合させたナノ粒子製剤であるnab-PTXとCBDCAの併用療法はCBDCA+PTXとの比較第Ⅲ相試験において,有意にORRの上昇を認めた(33.0% vs 25.0%)39)。各レジメンに固有の毒性プロファイルが報告されており,これらも踏まえて選択するべきと考えられる。
CDDP+PEMとCDDP+GEMの第Ⅲ相試験が行われ,全体では同等の効果であったが組織型による差が認められた。非扁平上皮癌においてはCDDP+PEM群でOS延長(11.8カ月vs 10.4カ月,HR 0.81,P=0.005)を認めたが,扁平上皮癌では逆にCDDP+PEM群でPFS(4.4カ月vs 5.5カ月,HR 1.36,P=0.002),OS(9.4カ月vs 10.8カ月,HR 1.23,P=0.05)ともに劣っていた47)。サブセット解析ではあるが,有効性ならびに毒性の観点から非扁平上皮癌に対するCDDP+PEMをグレードAとした。PEMが非扁平上皮癌に対して有効であり,CBDCAで患者が自覚される毒性がCDDPよりも軽度であることからCBDCA+PEMは実地臨床でも頻用されている。CBDCA+PEMは生存期間を主要評価項目とした比較試験がない。CBDCA+GEM,CBDCA+DTXやCBDCA+PTX+ベバシズマブとの比較試験は生存期間や主要評価項目であった有害事象などで優越性を示されていない48)~50)。しかしながらCBDCA+PTX+ベバシズマブと比較しても生存曲線に大きな差はなく49),ベバシズマブを併用した試験ではCBDCA+PTX+ベバシズマブよりPFSが上回る傾向にあり51),日本での安全性も確認されており52),患者のQOLなどの観点からも,CBDCA+PEMを行うことは許容されると考えレジメンに追記した。 - b.
- メタアナリシスでは,プラチナ併用療法にベバシズマブを追加することでORRの上昇,PFSの延長が示されており,OSについても延長が認められたとする報告がある40)41)。一方で,ベバシズマブの併用でGrade 3以上の毒性(蛋白尿,高血圧,出血性イベント,好中球減少,発熱性好中球減少,治療関連死)の有意な増加が報告されている40)~42)。
出血リスクに関しては,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており,ベバシズマブの投与に際してはその適応を十分に検討する必要がある42)。
CBDCA+PTXにベバシズマブを追加することの有効性を評価した第Ⅲ相試験では,ベバシズマブ併用群でORRの上昇,PFS(6.2カ月vs 4.5カ月,HR 0.66,P<0.001)ならびにOS(12.3カ月vs 10.3カ月,HR 0.79,P=0.003)の有意な延長を認めた43)。一方,CDDP+GEMにベバシズマブを追加した比較試験においては,PFSは有意に延長したがOSでは有意な延長を認めなかった44)。
本邦ではCBDCA+PTXにベバシズマブを追加するランダム化第Ⅱ相試験(JO19907試験)が行われ,併用群においてORRの上昇(60.7% vs 31.0%,P=0.0013),PFSの延長(6.9カ月vs 5.9カ月,HR 0.61,P=0.0090)を認め,新たな毒性は認めなかったがOSについては有意な延長を認めなかった(22.8カ月vs 23.4カ月,P=0.9526)45)。中国において同じレジメンを比較したランダム化第Ⅲ相試験(BEYOND試験)では,ベバシズマブを一次治療以後も継続することが可能なデザインであったが,主要評価項目であるPFSと,副次的評価項目であるOSも延長が認められた46)。CBDCA+PTX+ベバシズマブのレジメンは2つの第Ⅲ相試験で生存期間の延長が認められたことから,CBDCA+PTXにはベバシズマブを追加することが勧められる。
ベバシズマブの投与についてはその薬剤の特性からプラチナ製剤併用療法の終了後,病勢増悪もしくは毒性中止まで単剤投与を継続する方法が一般的である40)~45)。
〈投与期間〉
- c.
- 第3世代抗癌剤とプラチナ製剤との併用について,3コースもしくは4コースを6コースと比較し,いずれにおいても1年生存率やOSは同等で,毒性は前者が軽いと報告された53)54)。6サイクルまたはそれ以下のサイクルを比較した試験の個票データを利用したメタアナリシスでも,6サイクル行ってもOSが上回ることはなかった55)。一方,非扁平上皮癌に対するCDDP+PEMの優越性が示されたCDDP+GEMとの第Ⅲ相試験において,CDDP+PEM群の投与中央値は5コースであった47)。
〈維持療法〉
- d・e.
- プラチナ製剤併用療法後のPEM,エルロチニブを用いたswitch maintenanceの第Ⅲ相試験でPFS・OSの有意な延長が示された56)57)。しかしながら,両試験ともプラセボ群に対する2次療法以降でのクロスオーバーが少ないこと,すなわち,プラセボ群において2次治療以降に有効とされているPEM,エルロチニブが投与されていないことが問題とされている。
以上より,PEM・エルロチニブによるswitch maintenanceは選択肢の1つと考えられ,推奨グレードはC1とした。
CDDP+PEM併用療法後のPEMを用いたcontinuation maintenanceの第Ⅲ相試験で,PFSの延長(4.1カ月vs 2.8カ月,HR 0.62,P<0.0001),OSの延長(13.9カ月vs 11.0カ月,HR 0.78,P=0.0195)が示された58)。QOLの低下は認めず,維持療法群において毒性の増強はみられたものの許容範囲内であった。以上より,PEMのcontinuation maintenanceの推奨グレードはBとした。
ベバシズマブの併用に関しては,CDDP+PEM+ベバシズマブ併用療法後にPEM+ベバシズマブ群とベバシズマブ単独群の第Ⅲ相試験が行われ,前者でPFSの有意な延長(7.4カ月vs 3.7カ月,HR 0.48,P<0.0001)は認めたが,OSの有意な延長は認めなかった59)。
- 推 奨
a.暦年齢のみで化学療法の対象外とするべきではない。(グレードA)
- 〈レジメン〉
b.第3世代抗癌剤単剤を行うよう勧められる。(グレードA)
c.カルボプラチン併用療法を考慮してもよい。(グレードC1)
d.ベバシズマブ併用は行うよう勧めるだけの根拠が明確ではない。(グレードC2)
- a.
- 化学療法1次治療の第Ⅲ相試験と術後補助療法を対象とした検討では,65歳以上と以下で治療効果の差は認めず,暦年齢よりも日常生活自立度が予後に関係していた60)。また80歳以上でもPS良好のものは80歳以下と比べて効果・毒性に明らかな差は認めなかったと報告されている61)。
〈レジメン〉
- b.
- 高齢者においては緩和治療と比較してVNRが有効であること,VNRと比較してGEMが同様の有効性を示すことが確認されている62)63)。その後本邦で行われた第Ⅲ相試験(WJTOG9904試験)においてDTXはVNRに対し有意差は認めなかったもののPFS 5.5カ月,OS 14.3カ月と良好な結果を示した64)。以上より,高齢者に対する標準治療はDTXをはじめとした第3世代抗癌剤単剤と考えられる。
- c.
- 高齢者に対するプラチナ製剤併用療法については第Ⅱ相試験や第Ⅲ相試験のサブセットから様々な報告がなされてきたが明確な結論には至っていない65)。
近年高齢者を対象とした第3世代抗癌剤単剤とプラチナ製剤併用療法を比較した第Ⅲ相試験が2編報告され,両試験とも登録された患者の多くが75歳以上であった。JCOG0803/WJOG4307L試験はweekly CDDP+DTXとDTXの比較であるが,この試験では中間解析において併用療法が単剤治療の成績を上回らないことが示され,試験中止となった66)。IFCT0501試験はCBDCA+weekly PTXとGEMもしくはVNRの比較であり,PFS,OSにおける併用療法の優越性が示された(PFS:6.0カ月vs 2.8カ月,P<0.0001,OS:10.3カ月vs 6.2カ月,P<0.001)67)。しかしながらこの成績は上記bに述べた本邦での単剤治療の成績を大きく上回っているとはいえず,併用群における治療関連死が4.4%と高いなどの問題点が指摘されている。また投与量も本邦における標準的なものとは異なっており,データの解釈には注意を要する。
以上より,PS 0-1の75歳以上に対してCBDCA併用療法は選択肢の1つと考えられ,推奨グレードはC1とした。 - d.
- 高齢者におけるプラチナ製剤併用療法+ベバシズマブについて,E4599試験におけるサブセット解析で70歳以上の高齢者では効果の上乗せは認められず,若年に比してGrade 3以上の好中球減少・出血・蛋白尿が多かったとされている68)。米国における観察研究(ARIES)では70歳未満と70歳以上で効果は同等であったが,後者でGrade 3以上の動脈血栓塞栓症が増える傾向にあり,80歳以上ではさらに高かった(70歳未満:1.2%,70歳以上:3.2%,80歳以上:4.1%)69)。一方,欧州を中心に施行された観察研究(SAiL)では,70歳未満と70歳以上で有効性は同等で毒性の増強は認めなかったと報告されている70)。
本邦においては75歳以上の高齢者におけるベバシズマブ併用療法の十分なデータはなく,有効性や安全性は確認されていない。以上より,現時点では高齢者に対するベバシズマブ併用を行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
- 推 奨
- 〈レジメン〉
a.第3世代抗癌剤単剤を行うよう勧められる。(グレードA)
b.プラチナ製剤併用療法を考慮してもよい。(グレードC1)
c.第3世代抗癌剤併用は行うよう勧めるだけの根拠が明確ではない。(グレードC2)
d.ベバシズマブは行うよう勧めるだけの根拠が明確ではない。(グレードC2)
しかし,化学療法と緩和治療を比較したメタアナリシスのサブセットにおいて,PSにかかわらず化学療法によるOSの延長が認められている〔PS 2以上の場合,化学療法によって1年生存率にして6%(8%から14%)の改善〕1)。
〈レジメン〉
- a.
- メタアナリシスにおいて第3世代抗癌剤(DTX・PTX・VNR・GEM)単剤治療は緩和治療に比して1年生存率で約7%の改善が示されているが2),この中にPS 2以上は約30%含まれていた。また,この解析でも取り上げられた3つの試験においてPS 2のサブセットの治療成績が明らかになっており,いずれもOSが延長する傾向が確認されている71)。
- b.
- PS 2患者のサブセット解析が報告されており,CBDCA+PTXはPTX単剤に対して1年生存率で有意に上回っていた(18% vs 10%,HR 0.60,P=0.016)72)。PS 2に対するCBDCA+PTXとCDDP+GEMの比較では,OSはそれぞれ6.2,6.9カ月と良好であり,毒性に関しても忍容可能と考えられた73)。CBDCA+GEMとGEM単剤の比較が行われ,有意差は認められなかったものの併用群でOS(6.7カ月vs 4.8カ月,P=0.49),PFS(4.1カ月vs 3.0カ月,P=0.36)の延長傾向が示された74)。205例と小規模で扁平上皮癌を含む患者を対象としたCBDCA+PEMとPEM単剤の第Ⅲ相試験が行われ,併用群でPFS(5.9カ月vs 3.0カ月,HR 0.46,P<0.001),OS(9.1カ月vs 5.6カ月,HR 0.57,P=0.001)の有意な延長が認められた。毒性に関しては併用群で貧血や好中球減少の頻度が高く,3.9%の治療関連死が認められた75)。
以上より,毒性が耐用可能と思われるPS 2に対してはプラチナ製剤併用療法を考慮してもよいが,PS 2に関するエビデンスは少なく,そのほとんどがCBDCA併用レジメン,もしくは通常より減量した用量が用いられていることに注意が必要であり,推奨グレードはC1とした。 - c.
- PS 2に対する第3世代抗癌剤併用のエビデンスは少ない。weekly DTXとDTX+GEMの比較第Ⅱ相試験が行われ,約35%を占めたPS 2患者において併用によるOS延長は認めず(2.9カ月vs 3.8カ月,P=0.62),毒性が増強していた76)。よって,行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
- d.
- ベバシズマブ併用の臨床試験ならびに観察研究においてその大半がPS 0-1であり,PS 2に対するベバシズマブの安全性や有効性に関してのデータは少ない40)~42)。よって,PS 2に対するベバシズマブは行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
- 推 奨
- 化学療法は行わないよう勧められる。(グレードD)
PS不良や合併症のため細胞障害性抗癌剤の適応とならない進行非小細胞肺癌に対してエルロチニブ単剤と緩和治療の第Ⅲ相試験が行われた77)。患者背景として年齢中央値77歳,PS 3が30%を占め,EGFR遺伝子変異については陰性,不明がそれぞれ52%,46%であった。この試験においてOSの延長がみられなかったことから,EGFR遺伝子変異陰性もしくは不明のPS 3-4についてEGFR-TKI単剤も推奨されない。
以上より,EGFR遺伝子変異,ALK遺伝子転座,ROS1遺伝子転座陰性もしくは不明の非扁平上皮癌でPS 3-4については化学療法は勧められない。
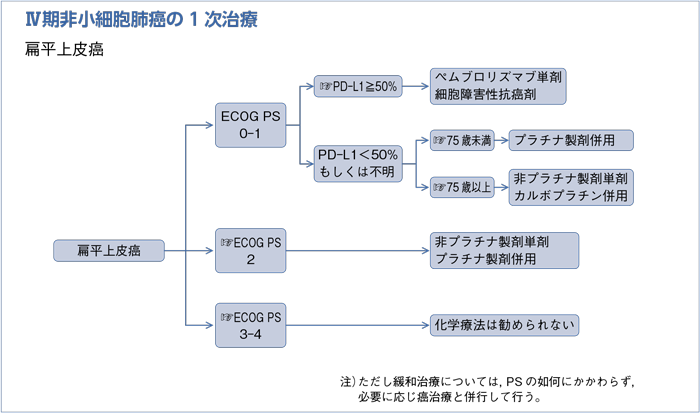
- 推 奨
a.PD-L1陽性細胞≧50%ではペムブロリズマブ単剤を行うように勧められる。(グレードA)
b.1次治療で用いられる細胞障害性抗癌剤を行うよう勧められる。(グレードB)
- a.
- EGFR変異やALK転座がなく,PD-L1陽性細胞が50%以上のPS 0または1のⅣ期非小細胞肺癌患者を対象として,ペムブロリズマブ単剤200mg/body 3週毎または細胞障害性抗癌剤を比較する第Ⅲ試験が行われ305人がランダム化された。細胞障害性抗癌剤群の患者66人(43.7%)がペムブロリズマブ単剤へクロスオーバーした。主要評価項目はPFS,副次評価項目はOS,ORRであった。中間解析の結果がESMO2016で発表され,ペムブロリズマブvs 細胞障害性抗癌剤はPFS中央値10.3 vs 6.0カ月(HR 0.50, 95%CI:0.37-0.68,P<0.001),OSは中央値が得られず(HR 0.60,95%CI:0.41-0.89,P=0.005),2年生存率は80.2 vs 72.4%,ORR 44.8 vs 27.8%であった33)。以上からPD-L1陽性細胞が50%以上が確認された患者では初回化学療法としてペムブロリズマブ単剤が勧められる。
- b.
- PS 0-1,75歳未満/PS 0-1,75歳以上の項目を参照。
*本稿執筆時点(2016年11月1日)で,化学療法未治療例に対するペムブロリズマブは本邦で保険償還されていない。承認後の使用に際しては添付文書の記載をよく確認すること。
- 推 奨
- 〈レジメン〉
a.プラチナ製剤と第3世代以降の抗癌剤併用を行うよう勧められる。(グレードA)
b.ペメトレキセドは行わないよう勧められる。(グレードD)
c.ベバシズマブは行わないよう勧められる。(グレードD)
- 〈投与期間〉
d.プラチナ製剤併用療法の投与期間は基本的に6コース以下とすることが勧められる。(グレードA)
- 〈維持療法〉
e.PS 0-1に対するプラチナ製剤併用療法4コース後,病勢増悪を認めず毒性も忍容可能なものに対してswitch maintenance,continuation maintenanceともに行うよう勧めるだけの根拠が明確ではない。(グレードC2)
〈レジメン〉
- a.
- プラチナ製剤併用の薬剤を第2世代と第3世代抗癌剤で比較したメタアナリシスにおいて,後者がORRで12%,1年生存率で6%優ると報告した2)。ネダプラチン+DTXとCDDP+DTXの比較第Ⅲ相試験が本邦で実施され,OSの有意な延長が認められた(13.6カ月vs 11.4カ月,HR 0.81,P=0.037)。毒性はプロファイルが異なり,ネダプラチン群では白血球減少・好中球減少・血小板減少が多く,CDDP群では悪心・倦怠感・低ナトリウム血症・低カリウム血症が多かった。第3世代以降の抗癌剤併用で唯一の優越性が示されたレジメンであり有望なレジメンである78)。その他に本邦で複数の第Ⅲ相試験が行われている。4種類の第3世代抗癌剤とプラチナ製剤併用の第Ⅲ相試験の結果が報告されており,いずれの効果も同等であった36)。またCBDCA+S-1のCBDCA+PTXに対する非劣性が報告され,CDDP+S-1のCDDP+DTXに対する非劣性も報告されている37)38)。ヒト血清アルブミンとPTXを結合させたナノ粒子製剤であるnab-PTXとCBDCAの併用療法は,CBDCA+PTXとの比較第Ⅲ相試験において,有意にORRの上昇を認めた(33.0% vs 25.0%)39)。各レジメンに固有の毒性プロファイルが報告されている。
- b.
- CDDP+PEMとCDDP+GEMの第Ⅲ相試験が行われ,全体では同等の効果であったが組織型による差が認められた。非扁平上皮癌においてはCDDP+PEM群でOS延長(11.8カ月vs 10.4カ月, HR 0.81, P=0.005)を認めたが,扁平上皮癌では,逆にCDDP+PEM群でPFS(4.4カ月vs 5.5カ月, HR 1.36, P=0.002),OS(9.4カ月vs 10.8カ月, HR 1.23, P=0.05)ともに劣っていた47)。組織型によるPEMの効果の違いについてはPEM単剤を用いた第Ⅲ相試験も併せて解析され,上記同様の傾向が確認されている79)。以上より,PEMは扁平上皮癌に対して行わないよう勧められる。
- c.
- ベバシズマブの第Ⅱ相試験においてGrade 3以上の肺胞出血が9.1%に認められ,出血リスクに関する検討が行われた。現在のところ,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており42),ベバシズマブは扁平上皮癌に対して行わないよう勧められる。
〈投与期間〉
- d.
- 第3世代抗癌剤とプラチナ製剤との併用について,3コースもしくは4コースと6コースが比較され,いずれにおいても1年生存率やOSは同等で,毒性は前者が軽いと報告された53)54)。一方,非扁平上皮癌に対するCDDP+PEMの優越性が示されたCDDP+GEMとの第Ⅲ相試験において,CDDP+PEM群の投与中央値は5コースであった47)。
〈維持療法〉
- 推 奨
a.暦年齢のみで化学療法の対象外とするべきではない。(グレードA)
- 〈レジメン〉
b.第3世代抗癌剤単剤を行うよう勧められる。(グレードA)
c.カルボプラチン併用療法を考慮してもよい。(グレードC1)
d.ペメトレキセドは行わないよう勧められる。(グレードD)
e.ベバシズマブは行わないよう勧められる。(グレードD)
- a.
- 化学療法1次治療の第Ⅲ相試験と術後補助療法を対象とした検討では,65歳以上と以下で治療効果の差は認めず,暦年齢よりも日常生活自立度が予後に関係していた60)。また80歳以上でもPS良好のものは80歳以下と比べて効果・毒性に明らかな差は認められなかったと報告されている61)。
〈レジメン〉
- b.
- 高齢者においては緩和治療と比較してVNRが有効であること,VNRと比較してGEMが同様の有効性を示すことが確認されている62)63)。その後本邦で行われた第Ⅲ相試験においてDTXはVNRに対し有意差は認めなかったもののPFS 5.5カ月,OS 14.3カ月と良好な結果を示した64)。以上より,高齢者に対する標準治療はDTXをはじめとした第3世代抗癌剤単剤と考えられる。
- c.
- 高齢者に対するプラチナ製剤併用療法については第Ⅱ相試験や第Ⅲ相試験のサブセットから様々な報告がなされてきたが明確な結論には至っていない65)。
近年高齢者を対象とした第3世代抗癌剤単剤とプラチナ製剤併用療法を比較した第Ⅲ相試験が2編報告され,両試験とも登録された患者の多くが75歳以上であった。weekly CDDP+DTXとDTXの比較では,中間解析において併用療法が単剤治療の成績を上回らないことが示され,試験中止となった66)。CBDCA+weekly PTXとGEMもしくはVNRの比較では,PFS,OSにおける併用療法の優越性が示された(PFS:6.0カ月vs 2.8カ月,P<0.0001,OS:10.3カ月vs 6.2カ月,P<0.001)67)。しかしながらこの成績は上記bに述べた本邦での単剤治療の成績を大きく上回っているとはいえず,併用群における治療関連死が4.4%と高いなどの問題点が指摘されている。また投与量も本邦における標準的なものとは異なっており,データの解釈には注意を要する。
以上より,PS 0-1,75歳以上に対してCBDCA併用療法は選択肢の1つと考えられ,推奨グレードはC1とした。 - d.
- CDDP+PEMとCDDP+GEMの第Ⅲ相試験が行われ,全体では同等の効果であったが組織型による差が認められた。非扁平上皮癌においてはCDDP+PEM群でOS延長(11.8カ月vs 10.4カ月, HR 0.81, P=0.005)を認めたが,扁平上皮癌では,逆にCDDP+PEM群でPFS(4.4カ月vs 5.5カ月, HR 1.36, P=0.002),OS(9.4カ月vs 10.8カ月, HR 1.23, P=0.05)ともに劣っていた47)。組織型によるPEMの効果の違いについてはPEM単剤を用いた第Ⅲ相試験も併せて解析され,上記同様の傾向が確認されている79)。以上より,PEMは扁平上皮癌に対して行わないよう勧められる。
- e.
- ベバシズマブの第Ⅱ相試験においてGrade 3以上の肺胞出血が9.1%に認められ,出血リスクに関する検討が行われた。現在のところ,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており42),ベバシズマブは扁平上皮癌に対して行わないよう勧められる。
- 推 奨
- 〈レジメン〉
a.第3世代抗癌剤単剤を行うよう勧められる。(グレードA)
b.プラチナ製剤併用療法を考慮してもよい。(グレードC1)
c.第3世代抗癌剤併用は行うよう勧めるだけの根拠が明確ではない。(グレードC2)
d.ペメトレキセドは行わないよう勧められる。(グレードD)
e.ベバシズマブは行わないよう勧められる。(グレードD)
〈レジメン〉
- a.
- メタアナリシスにおいて第3世代抗癌剤(DTX・PTX・VNR・GEM)単剤治療は緩和治療に比して1年生存率で約7%の改善が示されているが2),この中にPS 2以上は約30%含まれていた。また,この解析でも取り上げられた3つの試験においてPS 2のサブセットの治療成績が明らかになっており,いずれもOSが延長する傾向が確認されている71)。
- b.
- PS 2患者のサブセット解析が報告されており,CBDCA+PTXはPTX単剤に対して1年生存率で有意に上回っていた(18% vs 10%,HR 0.60,P=0.016)72)。PS 2に対するCBDCA+PTXとCDDP+GEMの比較が行われ,OSはそれぞれ6.2,6.9カ月と良好であり,毒性に関しても忍容可能と考えられた73)。CBDCA+GEMとGEM単剤の比較が行われ,有意差は認めなかったものの併用群でOS(6.7カ月vs 4.8カ月,P=0.49),PFS(4.1カ月vs 3.0カ月,P=0.36)の延長傾向が示された74)。CBDCA+PEMとPEM単剤の第Ⅲ相試験が行われ,併用群でPFS(5.9カ月vs 3.0カ月,HR 0.46,P<0.001),OS(9.1カ月vs 5.6カ月,HR 0.57,P=0.001)の有意な延長を認めた。毒性に関しては併用群で貧血や好中球減少の頻度が高く,3.9%の治療関連死が認められた75)。
以上より,毒性が耐用可能と思われるPS 2に対してはプラチナ製剤併用療法を考慮してもよい。しかしながらPS 2に関するエビデンスは少なく,そのほとんどがCBDCA併用レジメン,もしくは通常より減量した用量が用いられていることに注意が必要であり,推奨グレードはC1とした。 - c.
- PS 2に対する第3世代抗癌剤併用のエビデンスは少ない。weekly DTXとDTX+GEMの比較第Ⅱ相試験が行われ,約35%を占めたPS 2患者において併用によるOS延長は認めず(2.9カ月vs 3.8カ月,P=0.62),毒性が増強していた76)。よって,行うよう勧めるだけの根拠が明確ではなく,推奨グレードはC2とした。
- d.
- CDDP+PEMとCDDP+GEMの第Ⅲ相試験が行われ,全体では同等の効果であったが組織型による差が認められた。非扁平上皮癌においてはCDDP+PEM群でOS延長(11.8カ月vs 10.4カ月,HR 0.81,P=0.005)を認めたが,扁平上皮癌では,逆にCDDP+PEM群でPFS(4.4カ月vs 5.5カ月,HR 1.36,P=0.002),OS(9.4カ月vs 10.8カ月,HR 1.23,P=0.05)ともに劣っていた47)。組織型によるPEMの効果の違いについてはPEM単剤を用いた第Ⅲ相試験も併せて解析され,上記同様の傾向が確認されている79)。以上より,PEMは扁平上皮癌に対して行わないよう勧められる。
- e.
- ベバシズマブの第Ⅱ相試験においてGrade 3以上の肺胞出血が9.1%に認められ,出血リスクに関する検討が行われた。現在のところ,扁平上皮癌や空洞を有する症例,大血管への浸潤や隣接を認めるもの,その他,喀血・コントロール不能な高血圧,重篤な大血管病変や消化管における活動性出血の既往があるものなどが高リスク群と考えられており42),ベバシズマブは扁平上皮癌に対して行わないよう勧められる。
- 推 奨
- 化学療法は行わないよう勧められる。(グレードD)
PS不良や合併症のため細胞障害性抗癌剤の適応とならない進行非小細胞肺癌に対して,エルロチニブ単剤と緩和治療の第Ⅲ相試験が行われた77)。患者背景として扁平上皮癌が40%,PS 3が30%を占めており,この試験においてOSの延長はみられなかった。
以上より扁平上皮癌,PS 3-4については化学療法(細胞障害性抗癌剤・EGFR-TKI)は勧められない。
- 1)Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev. 2010; 12(5): CD007309. (I)
- 2)Baggstrom MQ, Stinchcombe TE, Fried DB, et al. Third-generation chemotherapy agents in the treatment of advanced non-small cell lung cancer: a meta-analysis. J Thorac Oncol. 2007; 2(9): 845-53. (I)
- 3)Fujiwara Y, Hotta K, Di Maio M, et al. Time trend in treatment-related deaths of patients with advanced non-small-cell lung cancer enrolled into phase III trials of systemic treatment. Ann Oncol. 2011; 22(2): 376-82. (I)
- 4)Anderson H, Hopwood P, Sstephens RJ, et al. Gemcitabine plus best supportive care(BSC)vs BSC in inoperable non-small cell lung cancer--a randomized trial with quality of life as the primary outcome. UK NSCLC Gemcitabine Group. Non-Small Cell Lung Cancer. Br J Cancer. 2000; 83(4): 447-53. (II)
- 5)Sederholm C, Hillerdal G, Lamberg K, et al. Phase III trial of gemcitabine plus carboplatin versus single-agent gemcitabine in the treatment of locally advanced or metastatic non-small-cell lung cancer: the Swedish Lung Cancer Study Group. J Clin Oncol. 2005; 23(33): 8380-8. (II)
- 6)Oizumi S, Kobayashi K, Inoue A, et al. Quality of life with gefitinib in patients with EGFR-mutated non-small cell lung cancer: quality of life analysis of North East Japan Study Group 002 Trial. Oncologist. 2012; 17(6): 863-70. (II)
- 7)Beau-Faller M, Prim N, Ruppert AM, et al. Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol. 2014; 25(1): 126-31. (IV)
- 8)Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8. (II)
- 9)Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012; 13(3): 239-46. (II)
- 10)Zhou C, Wu YL, Chen G, et al. Final overall survival results from a randomised, phase III study of erlotinib versus chemotherapy as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer(OPTIMAL, CTONG-0802). Ann Oncol. 2015; 26(9): 1877-83. (II)
- 11)Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med. 2010; 362(25): 2380-8. (II)
- 12)Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations(LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol. 2014; 15(2): 213-22. (II)
- 13)Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma(LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol. 2015; 16(2): 141-51. (II)
- 14)Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naïve non-small cell lung cancer with sensitive EGFR gene mutations(NEJ002). Ann Oncol. 2013; 24(1): 54-9. (II)
- 15)Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med. 2009; 361(10): 958-67. (III)
- 16)Seto T, Kato T, Nishio M, et al. Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations(JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol. 2014; 15(11): 1236-44. (II)
- 17)Park K, Tan EH, O’Byrne K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer(LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol. 2016; 17(5): 577-89. (II)
- 18)Maemondo M, Minegishi Y, Inoue A, et al. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations: NEJ 003 study. J Thorac Oncol. 2012; 7(9): 1417-22. (III)
- 19)Goto K, Nishio M, Yamamoto N, et al. A prospective, phase II, open-label study(JO22903)of first-line erlotinib in Japanese patients with epidermal growth factor receptor(EGFR)mutation-positive advanced non-small-cell lung cancer(NSCLC). Lung Cancer. 2013; 82(1): 109-14. (III)
- 20)Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol. 2013; 31(27): 3327-34. (II)
- 21)Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer(OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol. 2011; 12(8): 735-42. (II)
- 22)Kudoh S, Kato H, Nishiwaki Y, et al. Interstitial lung disease in Japanese patients with lung cancer: a cohort and nested case-control study. Am J Respir Crit Care Med. 2008; 177(12): 1348-57. (IV)
- 23)Inoue A, Kobayashi K, Usui K, et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol. 2009; 27(9): 1394-400. (III)
- 24)Ando M, Okamoto I, Yamamoto N, et al. Predictive factors for interstitial lung disease, antitumor response, and survival in non-small-cell lung cancer patients treated with gefitinib. J Clin Oncol. 2006; 24(16): 2549-56. (IV)
- 25)Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on“uncommon”epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res. 2011; 17(11): 3812-21. (IV)
- 26)Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol. 2015; 16(7): 830-8. (III)
- 27)Jänne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med. 2015; 372(18): 1689-99. (III)
- 28)Yasuda H, Kobayashi S, Costa DB. EGFR exon 20 insertion mutations in non-small-cell lung cancer: preclinical data and clinical implications. Lancet Oncol. 2012; 13(1): e23-31. (V)
- 29)Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med. 2014; 371(23): 2167-77. (II)
- 30)Nokihara H, Hida T, Kondo M, et al. Alectinib(ALC)versus crizotinib(CRZ)in ALK-inhibitor naive ALK-positive non-small cell lung cancer(ALK+NSCLC): Primary results from the J-ALEX study. J Clin Oncol. 2016; 34(suppl; abstr 9008). (II)
- 31)Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med. 2014; 371(21): 1963-71. (III)
- 32)Goto K, Yang JC-H, Kim D-W, et al. Phase II study of crizotinib in east Asian patients(pts)with ROS1-positive advanced non-small cell lung cancer(NSCLC). ASCO Meeting Abstracts 34: 9022, 2016. (III)
- 33)Reck M, Rodríguez-Abreu D, Robinson AG, et al. KEYNOTE-024: Pembrolizumab(pembro) vs platinum-based chemotherapy(chemo)as first-line therapy for advanced NSCLC with a PD-L1 tumor proportion score(TPS)≥50%. Ann Oncol. 2016; 27. (II)
- 34)Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009; 361(10): 947-57. (II)
- 35)Fukuoka M, Wu YL, Thongprasert S, et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia(IPASS). J Clin Oncol. 2011; 29(21): 2866-74. (II)
- 36)Ohe Y, Ohashi Y, Kubota K, et al. Randomized phase III study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan. Ann Oncol. 2007; 18(2): 317-23. (II)
- 37)Kubota K, Sakai H, Katakami N, et al. A randomized phase III trial of oral S-1 plus cisplatin versus docetaxel plus cisplatin in Japanese patients with advanced non-small-cell lung cancer: TCOG0701 CATS trial. Ann Oncol. 2015; 26(7): 1401-8. (II)
- 38)Okamoto I, Yoshioka H, Morita S, et al. Phase III trial comparing oral S-1 plus carboplatin with paclitaxel plus carboplatin in chemotherapy-naïve patients with advanced non-small-cell lung cancer: results of a west Japan oncology group study. J Clin Oncol. 2010; 28(36): 5240-6. (II)
- 39)Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase III trial. J Clin Oncol. 2012; 30(17): 2055-62. (II)
- 40)Lima AB, Macedo LT, Sasse AD. Addition of bevacizumab to chemotherapy in advanced non-small cell lung cancer: a systematic review and meta-analysis. PLoS One. 2011; 6(8): e22681. (I)
- 41)Soria JC, Mauguen A, Reck M, et al. Systematic review and meta-analysis of randomised, phase II/III trials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-small-cell lung cancer. Ann Oncol. 2013; 24(1): 20-30. (I)
- 42)Sandler AB, Schiller JH, Gray R, et al. Retrospective evaluation of the clinical and radiographic risk factors associated with severe pulmonary hemorrhage in first-line advanced, unresectable non-small-cell lung cancer treated with Carboplatin and Paclitaxel plus bevacizumab. J Clin Oncol. 2009; 27(9): 1405-12. (IV)
- 43)Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006; 355(24): 2542-50. (II)
- 44)Reck M, von Pawel J, Zatloukal P, et al. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase III trial(AVAiL). Ann Oncol. 2010; 21(9): 1804-9. (II)
- 45)Niho S, Kunitoh H, Nokihara H, et al; JO19907 Study Group. Randomized phase II study of first-line carboplatin-paclitaxel with or without bevacizumab in Japanese patients with advanced non-squamous non-small-cell lung cancer. Lung Cancer. 2012; 76(3): 362-7. (II)
- 46)Zhou C, Wu YL, Chen G, et al. BEYOND: A Randomized, Double-Blind, Placebo-Controlled, Multicenter, Phase III Study of First-Line Carboplatin/Paclitaxel Plus Bevacizumab or Placebo in Chinese Patients With Advanced or Recurrent Nonsquamous Non-Small-Cell Lung Cancer. J Clin Oncol. 2015; 33(19): 1-9. (II)
- 47)Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol. 2008; 26(21): 3543-51. (II)
- 48)Gronberg BH, Bremnes RM, Flotten O, et al. Phase III study by the Norwegian lung cancer study group: pemetrexed plus carboplatin compared with gemcitabine plus carboplatin as first-line chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol. 2009; 27(19): 3217-24. (II)
- 49)Zinner RG, Obasaju CK, Spigel DR, et al. PRONOUNCE: randomized, open-label, phase III study of first-line pemetrexed+carboplatin followed by maintenance pemetrexed versus paclitaxel+carboplatin+bevacizumab followed by maintenance bevacizumab in patients ith advanced nonsquamous non-small-cell lung cancer. J Thorac Oncol. 2015; 10(1): 134-42. (II)
- 50)Rodrigues-Pereira J, Kim JH, Magallanes M, et al. A randomized phase 3 trial comparing pemetrexed/carboplatin and docetaxel/carboplatin as first-line treatment for advanced, nonsquamous non-small cell lung cancer. J Thorac Oncol. 2011; 6(11): 1907-14. (II)
- 51)Patel JD, Socinski MA, Garon EB, et al. PointBreak: a randomized phase III study of pemetrexed plus carboplatin and bevacizumab followed by maintenance pemetrexed and bevacizumab versus paclitaxel plus carboplatin and bevacizumab followed by maintenance bevacizumab in patients with stage IIIB or IV nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(34): 4349-57. (II)
- 52)Okamoto I, Aoe K, Kato T, et al. Pemetrexed and carboplatin followed by pemetrexed maintenance therapy in chemo-naïve patients with advanced nonsquamous non-small-cell lung cancer. Invest New Drugs. 2013; 31(5): 1275-82. (III)
- 53)von Plessen C, Bergman B, Andressen O, et al. Palliative chemotherapy beyond three courses conveys no survival or consistent quality-of-life benefits in advanced non-small-cell lung cancer. Br J Cancer. 2006; 95(8): 966-73. (II)
- 54)Park JO, Kim SW, Ahn JS, et al. Phase III trial of two versus four additional cycles in patients who are nonprogressive after two cycles of platinum-based chemotherapy in non small-cell lung cancer. J Clin Oncol. 2007; 25(33): 5233-9. (II)
- 55)Rossi A, Chiodini P, Sun JM, et al. Six versus fewer planned cycles of first-line platinum-based chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data. Lancet Oncol. 2014; 15(11): 1254-62. (I)
- 56)Ciuleanu T, Brodowicz T, Zielinski C, et al. Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer: a randomised, double-blind, phase 3 study. Lancet. 2009; 374(9699): 1432-40. (II)
- 57)Cappuzzo F, Ciuleanu T, Stelmakh L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol. 2010; 11(6): 521-9. (II)
- 58)Paz-Ares LG, de Marinis F, Dediu M, et al. PARAMOUNT: Final overall survival results of the phase III study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous non-small-cell lung cancer. J Clin Oncol. 2013; 31(23): 2895-902. (II)
- 59)Barlesi F, Scherpereel A, Gorbunova V, et al. Maintenance bevacizumab-pemetrexed after first-line cisplatin-pemetrexed-bevacizumab for advanced nonsquamous nonsmall-cell lung cancer: updated survival analysis of the AVAPERL(MO22089)randomized phase III trial. Ann Oncol. 2014; 25(5): 1044-52. (II)
- 60)Maione P, Perrone F, Gallo C, et al. Pretreatment quality of life and functional status assessment significantly predict survival of elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the multicenter Italian lung cancer in the elderly study. J Clin Oncol. 2005; 23(28): 6865-72. (IV)
- 61)Hesketh PJ, Lilenbaum RC, Chansky K, et al. Chemotherapy in patients>or=80 with advanced non-small cell lung cancer: combined results from SWOG 0027 and LUN 6. J Thorac Oncol. 2007; 2(6): 494-8. (IV)
- 62)The Elderly Lung Cancer Vinorelbine Italian Study Group. Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. J Natl Cancer Inst. 1999; 91(1): 66-72. (II)
- 63)Gridelli C, Perrone F, Gallo C, et al. Chemotherapy for elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study(MILES)phase III randomized trial. J Natl Cancer Inst. 2003; 95(5): 362-72. (II)
- 64)Kudoh S, Takeda K, Nakagawa K, et al. Phase III study of docetaxel compared with vinorelbine in elderly patients with advanced non-small-cell lung cancer: results of the West Japan Thoracic Oncology Group Trial(WJTOG 9904). J Clin Oncol. 2006; 24(22): 3657-63. (II)
- 65)Belani CP, Fossella F. Elderly subgroup analysis of a randomized phase III study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for first-line treatment of advanced nonsmall cell lung carcinoma(TAX 326). Cancer. 2005; 104(12): 2766-74. (IV)
- 66)Abe T, Takeda K, Ohe Y, et al. Randomized phase III trial comparing weekly docetaxel plus cisplatin versus docetaxel monotherapy every 3 weeks in elderly patients with advanced non-small-cell lung cancer: the intergroup trial JCOG0803/WJOG4307L. J Clin Oncol. 2015; 33(6): 575-81. (II)
- 67)Quoix E, Zalcman G, Oster JP, et al. Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet. 2011; 378(9796): 1079-88. (II)
- 68)Ramalingam SS, Dahlberg SE, Langer CJ, et al. Outcomes for elderly, advanced-stage non small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel: analysis of Eastern Cooperative Oncology Group Trial 4599. J Clin Oncol. 2008; 26(1): 60-5. (IV)
- 69)Wozniak AJ, Kosty MP, Jahanzeb M, et al. Clinical outcomes in elderly patients with advanced non-small cell lung cancer: results from ARIES, a bevacizumab observational cohort study. Clin Oncol(R Coll Radiol). 2015; 27(4): 187-96.(IV)
- 70)Laskin J, Crinò L, Felip E, et al. Safety and efficacy of first-line bevacizumab plus chemotherapy in elderly patients with advanced or recurrent nonsquamous non-small cell lung cancer: safety of avastin in lung trial(MO19390). J Thorac Oncol. 2012; 7(1): 203-11. (IV)
- 71)Gridelli C, Ardizzoni A, Chevalier TL, et al. Treatment of advanced non-small-cell lung cancer patients with ECOG performance status 2: results of an European Experts Panel. Ann Oncol. 2004; 15(3): 419-26. (IV)
- 72)Lilenbaum RC, Herndon JE 2nd, List MA, et al. Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B(study 9730). J Clin Oncol. 2005; 23(1): 190-6. (IV)
- 73)Langer C, Li S, Schiller J, et al. Randomized phase II trial of paclitaxel plus carboplatin or gemcitabine plus cisplatin in Eastern Cooperative Oncology Group performance status 2 non-small-cell lung cancer patients: ECOG 1599. J Clin Oncol. 2007; 25(4): 418-23. (II)
- 74)Kosmidis PA, Dimopoulos MA, Syrigos K, et al. Gemcitabine versus gemcitabine-carboplatin for patients with advanced non-small cell lung cancer and a performance status of 2: a prospective randomized phase II study of the Hellenic Cooperative Oncology Group. J Thorac Oncol. 2007; 2(2): 135-40. (II)
- 75)Zukin M, Barrios CH, Pereira JR, et al. Randomized phase III trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol. 2013; 31(23): 2849-53. (II)
- 76)Hainsworth JD, Spigel DR, Farley C, et al. Weekly docetaxel versus docetaxel/gemcitabine in the treatment of elderly or poor performance status patients with advanced nonsmall cell lung cancer: a randomized phase 3 trial of the Minnie Pearl Cancer Research Network. Cancer. 2007; 110(9): 2027-34. (II)
- 77)Lee SM, Khan I, Upadhyay S, et al. First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy(TOPICAL): a double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2012; 13(11): 1161-70. (II)
- 78)Shukuya T, Yamanaka T, Seto T, et al. Nedaplatin plus docetaxel versus cisplatin plus docetaxel for advanced or relapsed squamous cell carcinoma of the lung(WJOG5208L): a randomised, open-label, phase 3 trial. Lancet Oncol. 2015; 16(16): 1630-8. (II)
- 79)Scagliotti G, Hanna N, Fossella F, et al. The differential efficacy of pemetrexed according to NSCLC histology: a review of two Phase III studies. Oncologist. 2009; 14(3): 253-63. (IV)
レジメン:Ⅳ期非小細胞肺癌の1次治療
プラチナ製剤と第3世代以後の抗癌剤のレジメン
CDDPレジメン
| CDDP | 75 mg/m2, day 1 | q3w |
| PEM | 500 mg/m2, day 1 | |
4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
| ※PEMの投与に際しては下記ビタミンの補充を行う
①葉酸:投与の7日以上前から葉酸として1日1回0.5 mgを連日経口投与する。なお,本剤の投与を中止または終了する場合には,本剤最終投与日から22日目まで可能なかぎり葉酸を投与する。 ②ビタミンB12:初回投与の少なくとも7日前に,ビタミンB12として1回1 mgを筋肉内投与する。その後,本剤投与期間中および投与中止後22日目まで9週ごと(3コースごと)に1回投与する。 |
||
| CDDP | 80 mg/m2, day 1 | q3w |
| DTX | 60 mg/m2, day 1 | |
| CDDP | 80 mg/m2, day 1 | q3w |
| GEM | 1000 mg/m2, day 1, 8 | |
| CDDP | 80 mg/m2, day 1 | q3w |
| VNR | 25 mg/m2, day 1, 8 | |
| CDDP | 80 mg/m2, day 1 | q4w |
| CPT-11 | 60 mg/m2, day 1, 8, 15 | |
| CDDP | 60 mg/m2, day 8 | q4-5w |
| S-1 | 40 mg/m2, 1日2回, day 1-21 | |
CBDCAレジメン
| CBDCA | (AUC=6), day 1 | q3w |
| PTX | 200 mg/m2, day 1 | |
PTX投与30分前までにデキサメサゾン,H1,H2 blockerの前投薬を行う |
||
| CBDCA | (AUC=5), day 1 | q3w |
| GEM | 1000 mg/m2, day 1, 8 | |
| CBDCA | (AUC=5), day 1 | q3w |
| S-1 | 40 mg/m2, 1日2回, day 1-14 | |
| CBDCA | (AUC=6), day 1 | q3w |
| nab-PTX | 100 mg/m2, day 1, 8, 15 | |
| CBDCA | (AUC=5-6), day 1 | q3w |
| PEM | 500 mg/m2, day 1 | |
4コース終了後,増悪を認めなければPEM単剤の維持療法を考慮する |
||
| ネダプラチン | 100 mg/m2, day 1 | q3w |
| DTX | 60 mg/m2, day 1 | |
- 増悪しなければ上記を6コース以内で繰り返す。
- 維持療法を行う場合はプラチナ製剤併用を4コースで終了し,病勢増悪を認めず,毒性が忍容可能な場合に(プラチナ製剤を含まない)単剤化学療法に移行する。
ベバシズマブ併用レジメン
| CBDCA | (AUC=6), day 1 | q3w |
| PTX | 200 mg/m2, day 1 | |
| ベバシズマブ | 15 mg/kg, day 1 | |
| PTX投与30分前までにデキサメサゾン,H1,H2 blockerの前投薬を行う | ||
- 増悪しなければ上記を6コース以内で繰り返す。
- ベバシズマブについてはプラチナ製剤併用療法の終了後,病勢増悪もしくは毒性中止まで単剤投与を継続する。
単剤療法レジメン
| DTX | 60 mg/m2, day 1 | q3w |
| GEM | 1000 mg/m2, day 1, 8, 15 | q4w |
| VNR | 25 mg/m2, day 1, 8 | q3w |
| ペムブロリズマブ | 投与方法は添付文書に従う |
内服療法レジメン
| ゲフィチニブ | 250 mg/日 | 1錠 | 1日1回 |
| エルロチニブ | 150 mg/日 | 1錠 | 1日1回 |
| アファチニブ | 40 mg/日 | 1錠 | 1日1回 |
| クリゾチニブ | 250 mg | 2錠(1回1錠) | 1日2回 |
| アレクチニブ | 150 mg | 4錠(1回2錠) | 1日2回 |