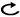4
Ⅱ.非小細胞肺癌
4-1.Ⅲ期非小細胞肺癌:切除不能例
文献検索と採択

本文中に用いた略語および用語の解説
| CBDCA | カルボプラチン | |
|---|---|---|
| CDDP | シスプラチン | |
| CPT-11 | 塩酸イリノテカン | |
| DTX | ドセタキセル | |
| EGFR-TKI | 上皮成長因子受容体チロシンキナーゼ阻害剤 | |
| ETP | エトポシド | |
| MMC | マイトマイシンC | |
| PAC | パクリタキセル | |
| VBL | ビンブラスチン | |
| VDS | ビンデシン | |
| VNR | ビノレルビン | |
| プラチナ製剤 | CDDPとCBDCAの総称 | |
| 第3世代抗癌剤 | CPT-11,DTX,GEM,PAC,VNRの総称 | |
| 3D-CRT | 3-dimentional conformal radiation therapy | 3次元原体照射 |
| ENI | elective nodal irradiation | 予防的リンパ節照射 |
| IF | involved field | 病巣部(病巣関連)照射野:主として肉眼的腫瘍体積(画像上明らかな腫瘍病巣部)に限局した照射野を意味する |
| OS | overall survival | 全生存期間 |
| PS | performance status | 一般状態 |
| V20 | 20 Gy以上照射される肺体積の全肺体積に対する割合 | |
樹形図
- 推 奨
a.化学療法と根治的胸部放射線治療の併用療法が可能な局所進行非小細胞肺癌患者にはプラチナを含む化学放射線療法を行うよう勧められる。(グレードA)
b.全身状態が良好(PS 0-1)な患者に,化学放射線療法を行うよう勧められる。(グレードA)
c.高齢者でも全身状態が良好であれば,化学放射線療法は選択肢の1つとして勧められる。(グレードB)
d.化学療法と放射線療法の併用時期は同時併用を行うよう勧められる。(グレードA)
e.プラチナ製剤を含む化学療法との同時併用療法を行うよう勧められる。(グレードA)
f.化学放射線同時併用後に薬剤を変更し地固め化学療法を行うよう勧めるだけの根拠が明確でない。(グレードC2)
g.化学放射線療法後の維持療法としてEGFR-TKIの投与を行わないよう勧められる。(グレードD)
h.化学療法併用時の通常分割照射法(1日1回1.8~2 Gy週5回法)では,60 Gyを最低合計線量とするよう勧められる。(グレードA)
i.74 Gyの高線量照射は行わないよう勧められる。(グレードD)
j.放射線治療は休止期間をおかずに継続して行うよう勧められる。(グレードB)
〈化学放射線療法〉
- a.
- 切除不能局所進行非小細胞肺癌に対する放射線単独療法と化学放射線療法の臨床比較試験をまとめたメタアナリシスの結果,CDDPを含む化学療法と放射線療法の併用群の生存率が放射線単独群の生存率に比して有意に良好であった1)~3)。
現在では,局所進行非小細胞肺癌の標準治療は化学放射線療法であるとして広く認知されており推奨レベルはグレードAとした。
〈対象〉
- b.
- 放射線単独療法と化学放射線療法を比較した複数の試験ではPSが良好な症例を対象にしている。化学療法により生存期間延長効果が得られる対象もPS 0-1である1)~3)。このため化学放射線療法をPS 0-1に対して勧めるエビデンスは十分にあると判断し,グレードAとした。しかし,化学放射線療法の有害事象発生頻度は,放射線単独療法のそれより高いため,十分な配慮が必要である。
- c.
- 70歳以上の高齢者では,放射線治療に化学療法を併用することの利益を示した報告は少ない。RTOG,ECOG,SWOG共同のランダム化比較試験のサブセット解析分析では,70歳以上の高齢者では化学療法併用による生存の向上は認められなかったと報告している4)。
一方,CALGB9130,NCCTG試験では,年齢による生存率に有意差は認められず,年齢は予後因子とはならないと結論している5)6)。また,本邦における71歳以上の高齢者を対象としたJCOG0301のランダム化比較試験の結果でも,化学放射線療法群(低用量CBDCA 30 mg/m2/日,週5回,計20日間投与+同時胸部放射線照射60 Gy)は放射線単独療法群(胸部放射線照射60 Gy)に比べて,主要評価項目である全生存期間を有意に延長することが示された(生存期間中央値22.4カ月vs. 16.9カ月)7)。ただし,高齢者に対する放射線単独療法と化学放射線療法を比較した試験では,有害事象発生頻度が高かったため,試験が中止されたものもある。
したがって,高齢者における化学放射線療法は,適応症例の選択および照射野設定や線量計算などの品質管理を適切に行うことを条件に治療選択肢の1つになり得るとして推奨グレードはBとした。
〈タイミング〉
- d.
- 化学療法と放射線療法の併用時期は同時のほうが併用効果は高い8)9)。同時併用では急性の有害事象の頻度が高く注意が必要であるが,慢性の有害事象は逐次併用と同等であることが示されている。
同時併用の場合には,急性障害の軽減のために放射線治療を分離照射法としても不利益は少ないようである。最近の同時併用と逐次併用の臨床比較試験をまとめたメタアナリシスの結果,同時併用群の生存率が逐次併用群の生存率に比して有意に良好であった10)。現在では,局所進行非小細胞肺癌の標準治療は同時化学放射線療法であるとして広く認知されており,推奨レベルはグレードAとした。しかし,適応症例の選択には十分な配慮が必要である。
〈レジメン〉
- e.
- 放射線治療と同時併用するCDDPを含む化学療法レジメンで,逐次療法より優れていると報告された薬剤はVDS,MMCおよびVBLなどで,いわゆる一世代前の薬剤のみ8)~10)である。しかし,プラチナ製剤と第3世代の薬剤との併用療法も従来のCDDPとの2剤または3剤併用療法と同等の治療成績を示しており,プラチナ製剤を含む化学療法との同時併用療法を推奨グレードAとした。
現在までに本邦においてMVP療法に対するCBDCA+CPT-11併用療法,CBDCA+PAC併用(CP)療法,CDDP+DTX併用療法(CD療法)が比較検討され,OSではMVP療法に対するCP療法の非劣性やCD療法の優越性は証明されなかった。しかし,CP療法の生存曲線は密に重なっており,有害事象が軽微であることからCP併用療法が標準治療の1つと結論された11)。CD療法は主要評価項目である2年生存率でMVP療法に対する優越性は証明された(CD療法60.3%,MVP療法48.1%)が,生存期間(OS)での優越性は証明できなかった12)。
したがって,放射線治療に同時併用する第3世代抗癌剤を含む化学療法のレジメンの1つとしてCP療法あるいはCD療法が勧められる。
〈その他〉
- f.
- CDDP/ETPと胸部放射線同時併用療法後にDTXによる地固め化学療法の意義を検証する第Ⅲ相比較試験が行われた。DTXによる地固め化学療法による生存期間延長効果は得られず,有害事象および治療関連死亡が増加した13)。化学放射線同時併用療法後の地固め化学療法を行うよう勧めるだけの根拠は明確でなく,推奨レベルをグレードC2とした。
- g.
- CDDP/ETPと胸部放射線同時併用療法後のDTXによる地固め化学療法後,ゲフィチニブによる維持療法の意義を検証する第Ⅲ相試験が行われた。その結果,ゲフィチニブ群の予後はプラセボ群より有意に不良であった14)。したがって,化学放射線同時併用後のEGFR-TKIによる維持療法は行わないよう勧められ,推奨レベルのグレードをDとした。
〈化学療法併用時放射線治療〉
- h.
- 化学療法に放射線療法を併用する場合の放射線の推奨照射線量は,化学療法と放射線を併用するタイミングを検討する試験,化学放射線同時併用療法における化学療法の比較や地固め療法を比較した試験に用いられた放射線療法の分割照射法・投与線量がすべて1回1.8~2 Gyで週5回,計59.4~66 Gyであったことを元としている。RTOG9410でCDDP+VBL同時併用放射線療法,遂時放射線照射,CDDP+ETPと同時過分割照射(計69.6 Gy)を比較した試験でも,過分割照射の有用性は証明されていない9)。また,本邦で行われた化学放射線療法に関する比較第Ⅲ相試験は1回2 Gy週5回,計28~30回,56~60 Gyである8)11)12)。化学療法に放射線照射を併用する場合においても,放射線単独療法と同じ最低推奨照射線量は安全性の観点から同時に照射が可能であり,60 Gy/30回/6週を推奨線量として妥当であるためグレードAとした。
- i.
- 局所進行非小細胞肺癌に対する最適な照射野は明らかになっておらず,長い間,慣例的に用いられてきた照射野は,予防的リンパ領域を含む照射野である。現在の標準的照射線量である60 Gyでは局所制御が不十分であるが,従来の予防的リンパ節領域を含む照射体積では毒性の点から総線量を増やすのは困難であった。近年のCT治療計画による3D-CRTの普及により,予防的リンパ節照射(elective nodal irradiation;ENI)を省くinvolved field(IF)を用いた高線量照射が試みられるようになった。Yuanらの1回2 Gyの通常分割照射によるIF照射(総線量68~74 Gy)とENI(総線量60~64 Gy)による比較試験の結果によると,5年局所制御率はそれぞれ51%,36%と有意にIF照射群が良好で,肺臓炎の発症割合はENI群で有意に高く,両者の2年生存率はそれぞれ39.4%,25.6%で,2年生存率においてのみIF照射群のほうが有意に予後良好であったと報告されている15)。
その後,標準線量60 Gyと高線量74 Gyの生存延長効果を比較した第Ⅲ相試験(RTOG 0617)の結果が報告された16)。高線量74 Gyによる同時化学放射線療法は,標準線量60 Gyの場合よりも局所再発リスクと死亡リスクをそれぞれ37%と56%有意に上昇させた。したがって,現時点では化学放射線療法においてENIを省くIFを用いた74 Gyの高線量照射は行わないよう勧められるため,推奨レベルはグレードDとした。 - j.
- 治療に抵抗性の腫瘍細胞の治療期間中にみられる再増殖を防ぐためには,放射線治療期間中に休止期間をおかないことが望ましいとされている。3つの同時化学放射線療法の臨床試験をまとめた分析では,放射線治療の中断は生存率を低下させる可能性を示されている17)。化学療法併用時の放射線治療でも,休止期間をおかずに治療を継続して行うよう勧められるため,推奨レベルはグレードBとした。
- 1)Pritchard RS, Anthony SP. Chemotherapy plus radiotherapy compared with radiotherapy alone in the treatment of locally advanced, unresectable, non-small-cell lung cancer. A meta-analysis. Ann Intern Med. 1996; 125(9): 723-9. (I)
- 2)Non-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ. 1995; 311(7010): 899-909. (I)
- 3)Marino P, Preatoni A, Cantoni A. Randomized trials of radiotherapy alone versus combined chemotherapy and radiotherapy in stages IIIa and IIIb nonsmall cell lung cancer. A meta-analysis. Cancer. 1995; 76(4): 593-601. (I)
- 4)Sause W, Kolesar P, Taylor S IV, et al. Final results of phase III trial in regionally advanced unresectable non-small cell lung cancer: Radiation Therapy Oncology Group, Eastern Cooperative Oncology Group, and Southwest Oncology Group. Chest. 2000; 117(2): 358-64. (IV)
- 5)Rocha Lima, Herndon JE 2nd, Kosty M, et al. Therapy choices among older patients with lung carcinoma: an evaluation of two trials of the Cancer and Leukemia Group B. Cancer. 2002; 94(1): 181-7. (IV)
- 6)Schild SE, Stella PJ, Geyer SM, et al; North Central Cancer Treatment Group. The outcome of combined-modality therapy for stage III non-small-cell lung cancer in the elderly. J Clin Oncol. 2003; 21(17): 3201-6. (IV)
- 7)Atagi S, Kawahara M, Yokoyama A, et al. Thoracic radiotherapy with or without daily low-dose carboplatin in elderly patients with non-small-cell lung cancer: a randomised, controlled, phase 3 trial by the Japan Clinical Oncology Group(JCOG0301). Lancet Oncol. 2012; 13(7): 671-8. (II)
- 8)Furuse K, Fukuoka M, Kawahara M, et al. Phase III study of concurrent versus sequential thoracic radiotherapy in combination with mitomycin, vindesine, and cisplatin in unresectable stage III non-small-cell lung cancer. J Clin Oncol. 1999; 17(9): 2692-9. (II)
- 9)Curran WJ Jr, Paulus R, Langer CJ, et al. Sequential vs. concurrent chemoradiation for stage III non-small cell lung cancer: randomized phase III trial RTOG 9410. J Natl Cancer Inst. 2011; 103(19): 1452-60. (II)
- 10)Aupérin A, Le Péchoux C, Rolland E, et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small-cell lung cancer. J Clin Oncol. 2010; 28(13): 2181-90. (I)
- 11)Yamamoto N, Nakagawa K, Nishimura Y, et al. Phase III study comparing second- and third-generation regimens with concurrent thoracic radiotherapy in patients with unresectable stage III non-small-cell lung cancer: West Japan Thoracic Oncology Group WJTOG0105. J Clin Oncol. 2010; 28(23): 3739-45. (II)
- 12)Segawa Y, Kiura K, Takigawa N, et al. Phase III trial comparing docetaxel and cisplatin combination chemotherapy with mitomycin, vindesine, and cisplatin combination chemotherapy with concurrent thoracic radiotherapy in locally advanced non-small-cell lung cancer: OLCSG 0007. J Clin Oncol. 2010; 28(20): 3299-306. (II)
- 13)Hanna N, Neubauer M, Yiannoutsos C, et al. Phase III study of cisplatin, etoposide, and concurrent chest radiation with or without consolidation docetaxel in patients with inoperable stage III non-small-cell lung cancer: the Hoosier Oncology Group and U. S. Oncology. J Clin Oncol. 2008; 26(35): 5755-60. (II)
- 14)Kelly K, Chansky K, Gaspar LE, et al. Phase III trial of maintenance gefitinib or placebo after concurrent chemoradiotherapy and docetaxel consolidation in inoperable stage III non-small-cell lung cancer: SWOG S0023. J Clin Oncol. 2008; 26(15): 2450-6. (II)
- 15)Yuan S, Sun X, Li M, et al. A randomized study of involved-field irradiation versus elective nodal irradiation in combination with concurrent chemotherapy for inoperable stage III nonsmall cell lung cancer. Am J Clin Oncol. 2007; 30(3): 239-44. (II)
- 16)Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer(RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol. 2015; 16(2): 187-99. (II)
- 17)Machtay M, Hsu C, Komaki R, et al. Effect of overall treatment time on outcomes after concurrent chemoradiation for locally advanced non-small-cell lung carcinoma: analysis of the Radiation Therapy Oncology Group(RTOG)experience. Int J Radiat Oncol Biol Phys. 2005; 63(3): 667-71. (IV)
- 推 奨
a.化学放射線療法の適応とならないⅢ期非小細胞肺癌には,無症状であっても根治的放射線単独療法の適応があり,行うよう勧められる。(グレードB)
b.放射線治療単独で治療する場合,Ⅲ期非小細胞肺癌には通常線量分割で少なくとも60 Gy/30回/6週を行うよう勧められる。(グレードA)
c.放射線治療は休止期間をおかずに継続して行うよう勧められる。(グレードB)
d.照射期間を短縮する加速(過分割)照射は,標準治療として行うよう勧めるだけの根拠は明確でない。(グレードC2)
- a.
- Reinfussらは,無症状のⅢ期非小細胞肺癌240人を対象に,A群:通常照射(50 Gy/25回/5週),B群:小分割照射(40 Gy/10回/5週,3週間の休止期間を含む),C群:症状が出るまで無治療で,症状が出たら姑息照射を行う3群のランダム化比較試験を行い,2年生存率は,A群:18%,B群:6%,C群:0%と通常照射群の生存率が有意に良好であった1)。根治照射を行った75歳以上のⅠ~Ⅲ期非小細胞肺癌患者97人の治療成績をレトロスペクティブに解析したHayakawaらの報告では2),75~79歳の5年生存率は13%,80歳以上の5年生存率は4%であり,これらはいずれも74歳未満の患者の生存率と比較して有意差がなかった。Ⅲ期非小細胞肺癌に対する放射線単独治療の生存率は良好とはいえないが,無治療で症状が出てから照射するのは,さらに不良となるので,化学放射線療法の適応とはならないⅢ期非小細胞肺癌に対しては,速やかに根治的放射線単独療法を行うよう勧められる。
- b.
- Ⅲ期非小細胞肺癌を対象に,40 Gy,50 Gy,60 Gyをランダム化比較したRTOG73-01では3),生存率曲線には有意差がないものの,3年生存率が,60 Gyで15%,50 Gyで10%,40 Gyで6%であった。照射野内再発率は,40 Gy,50 Gy,60 Gyと線量が増加するにつれて再発率が下がり,線量依存性は有意であった。Singerらは,放射線単独で線量分割をランダム化比較した英国の4つの臨床試験と,米国のRTOG73-01を比較し4),放射線単独治療では,線量が正常組織反応および局所制御率と相関することを明らかにした。以上,少なくとも60 Gy以下では治療成績が合計線量に依存することが示されている。通常照射法60 Gyと約70 Gyに線量を増加させる過分割照射を比較した3つのランダム化比較試験のメタアナリシスでは5),過分割照射により死亡のオッズ比が0.69(0.51-0.95)と有意に下がった。ただし,このメタアナリシスにも含まれている臨床試験であるが,通常照射法(60 Gy/30回/6週)と過分割照射(69.6 Gy/1.2 Gy bid/6週)を比較したSauseらの大規模ランダム化比較試験では6),両群に生存率の有意差はみられていない。
線量が70 Gyを超える領域に関して,CoxらはT1-3N2M0の予後の良い〔Karnofsky Performance Status(KPS)70-100,体重減少<5%〕Ⅲ期非小細胞肺癌を対象に,60 Gyから79.2 Gyまでの過分割照射のランダム化比較試験(RTOG83-11)を行った7)。各群の生存に有意差はみられなかったが,生存期間中央値において69.6 Gy群が最も良好で,70 Gy以上の各群はそれを下回った。Maguireらは8),73.6~80 Gy/4.5~5週の加速過分割照射によって急性障害,晩期障害の程度が高くなると報告している。
これらのデータは2次元治療に基づいたものであり,標準的に使われている60 Gyの理論的根拠となっている。近年,3次元的治療計画に基づいた線量増加が試みられるようになってきた。RTOGは3次元原体照射(3D-CRT)を用いた化学療法を同時併用しない第Ⅰ/Ⅱ相線量増加試験(RTOG9311)を行った。本試験では,放射線肺臓炎の予測因子である肺のV20(20 Gy以上照射される正常肺の体積)によって層別化を行い,V20<25%では83.8 Gy/39 Frまで,V20が25%から36%の場合は77.4 Gy/36 Frまで安全に線量増加が可能であると報告した9)。これらは予防的所属リンパ節照射(elective nodal irradiation;ENI)を省くInvolved field(IF)を用いた線量増加試験であることに注意が必要であり,照射野と線量については推奨するエビデンスが未だ十分ではない。 - c.
- 治療に抵抗性の腫瘍細胞の治療期間中にみられる再増殖を防ぐためには,放射線治療期間中に休止期間をおかないことが望ましいとされている。Coxらは,3つのランダム化比較試験(RTOG8311,8321,8403)に参加した切除不能非小細胞肺癌1,244人を対象に,照射期間の延長が治療成績に与える影響を分析した10)。通常照射法(60 Gy)での治療期間の延長は2.7%にみられたのみであったが,過分割照射64.8~74.4 Gy照射群の13.0%,79.2 Gy照射群の20.8%に5日以上の治療期間延長がみられた。過分割照射群では,治療期間延長のない症例では5年生存率10%であったのに対し,治療期間の延長がみられた症例では3%と有意に不良であった。したがって,治療期間の延長は治療成績を下げることから,休止期間をおかずに放射線治療を継続して行うように勧められるため,推奨グレードをBとした。
- d.
- Continuous hyperfractionated accelerated radiotherapy(CHART)試験では11) CHART(1.5 Gy/回,1日3回,合計54 Gyを12日間連続照射)と通常照射(60 Gy/30回/6週)をランダム化比較した。CHARTの2年生存率は29%,通常照射では20%であり有意差がみられ,CHARTによって死亡のハザード比(HR)が22%,局所再発のHRが21%有意に減少した。組織型によるサブセット解析によって,CHARTは扁平上皮癌にのみ生存率,局所制御率,無病生存率,および無遠隔転移生存率のすべてにおいて有意に成績を向上させた。しかしながら,それ以外の組織型に対するCHARTの有効性は示されなかった。
Ballらは12),60 Gy/30回/6週と60 Gy/30回/3週をランダム化比較した。3週群では,1回2 Gyを1日2回照射した。その結果,両群の生存率に有意差なく,一方3週群で食道炎が高率にみられ,かつ長期間持続した。60 Gy/30回/3週の線量分割は推奨できない。Bonnerらは13),A群:60 Gy/30回/6週,B群:60 Gy/40回/6週(2週間休止)をランダム化比較した。照射期間の変わらない休止期間を有する過分割照射(B群)は,通常照射法(A群)と生存率に差がなかった。
CHARTによる照射期間短縮は生存率を向上させる。しかしながら,CHART以外の加速過分割照射による照射期間の短縮ではⅢ期非小細胞肺癌の治療成績の改善は得られない。本邦において土日も含めて1日3回照射するCHARTが実施可能とは考えにくいので,加速照射法による照射期間の短縮に関しては推奨グレードC2とした。
- 1)Reinfuss M, Glinski B, Kowalska T, et al. Radiotherapy for stage III, inoperable, asymptomatic small cell lung cancer. Final results of a prospective randomized study(240 patients). Cancer Radiother. 1999; 3(6): 475-9. (II)
- 2)Hayakawa K, Mitsuhashi N, Katano S, et al. High-dose radiation therapy for elderly patients with inoperable or unresectable non-small cell lung cancer. Lung Cancer. 2001; 32(1): 81-8. (Ⅴ)
- 3)Perez CA, Pajak TF, Rubin P, et al. Long-term observations of the patterns of failure in patients with unresectable non-oat cell carcinoma of the lung treated with definitive radiotherapy. Report by the Radiation Therapy Oncology Group. Cancer. 1987; 59(11): 1874-81. (II)
- 4)Singer JM, Price P, Dale RG. Radiobiological prediction of normal tissue toxicities and tumour response in the radiotherapy of advanced non-small-cell lung cancer. Br J Cancer. 1998; 78(12): 1629-33. (IV)
- 5)Stuschke M, Thames HD. Hyperfractionated radiotherapy of human tumors: overview of the randomized clinical trials. Int J Radiat Oncol Biol Phys. 1997; 37(2): 259-67. (I)
- 6)Sause W, Kolesar P, Taylor S IV, et al. Final results of phase III trial in regionally advanced unresectable non-small cell lung cancer: Radiation Therapy Oncology Group, Eastern Cooperative Oncology Group, and Southwest Oncology Group. Chest. 2000; 117(2): 358-64. (II)
- 7)Cox JD, Azarnia N, Byhardt RW, et al. A randomized phase I/II trial of hyperfractionated radiation therapy with total doses of 60.0 Gy to 79.2 Gy: possible survival benefit with greater than or equal to 69.6 Gy in favorable patients with Radiation Therapy Oncology Group stage III non-small-cell lung carcinoma: report of Radiation Therapy Oncology Group 83-11. J Clin Oncol. 1990; 8(9): 1543-55. (II)
- 8)Maguire PD, Marks LB, Sibley GS, et al. 73.6 Gy and beyond: hyperfractionated, accelerated radiotherapy for non-small-cell lung cancer. J Clin Oncol. 2001; 19(3): 705-11. (IV)
- 9)Bradley J, Graham MV, Winter K, et al. Toxicity and outcome results of RTOG 9311: a phase I-II dose-escalation study using three-dimensional conformal radiotherapy in patients with inoperable non-small-cell lung carcinoma. Int J Radiat Oncol Biol Phys. 2005; 61(2): 318-28. (IV)
- 10)Cox JD, Pajak TF, Asbell S, et al. Interruptions of high-dose radiation therapy decrease long-term survival of favorable patients with unresectable non-small cell carcinoma of the lung: analysis of 1244 cases from 3 Radiation Therapy Oncology Group(RTOG)trials. Int J Radiat Oncol Biol Phys. 1993; 27(3): 493-8. (III)
- 11)Saunders M, Dische S, Barrett A, et al. Continuous, hyperfractionated, accelerated radiotherapy(CHART)versus conventional radiotherapy in non-small cell lung cancer: mature data from the randomised multicentre trial. CHART Steering committee. Radiother Oncol. 1999; 52(2): 137-48. (II)
- 12)Ball D, Bishop J, Smith J, et al. A randomised phase III study of accelerated or standard fraction radiotherapy with or without concurrent carboplatin in inoperable non-small cell lung cancer: final report of an Australian multi-centre trial. Radiother Oncol. 1999; 52(2): 129-36. (II)
- 13)Bonner JA, McGinnis WL, Stella PJ, et al. The possible advantage of hyperfractionated thoracic radiotherapy in the treatment of locally advanced nonsmall cell lung carcinoma: results of a North Central Cancer Treatment Group Phase III Study. Cancer. 1998; 82(6): 1037-48. (II)
レジメン:切除不能Ⅲ期非小細胞肺癌の同時併用
| CP療法 | 胸部放射線治療 | 60 Gy/30回(6週),day 1~ | ||||
|---|---|---|---|---|---|---|
| 化学療法 | CBDCA | (AUC=2),day 1,8,15,22,29,36 | ||||
| PAC | 40 mg/m2,day 1,8,15,22,29,36 | |||||
| ⇨ | CBDCA | (AUC=5),day 1 2コース | ||||
| PAC | 200 mg/m2,day 1 2コース | |||||
| CD療法 | 胸部放射線治療 | 60 Gy/30回(6週),day 1~ | ||||
| 化学療法 | CDDP | 40 mg/m2,day 1,8,29,36 | ⇨ | 地固め療法は行わない | ||
| DTX | 40 mg/m2,day 1,8,29,36 | |||||
| 高齢者 CBDCA療法 |
胸部放射線治療 | 60 Gy/30回(6週),day 1~ | ||||
| 化学療法 | CBDCA | 30 mg/m2, | ||||
合計20回の投与を40 Gyまでの照射日に一致して照射前60分以内に投与 |
||||||
4-2.放射線治療基本的事項
文献検索と採択

本文中に用いた略語および用語の解説
| DVH | dose-volume histogram | 線量体積ヒストグラム |
|---|---|---|
| MLD | mean lung dose | 平均肺線量 |
| V20 | 20 Gy以上照射される肺体積の全肺体積に対する割合 | |
| V30 | 30 Gy以上照射される肺体積の全肺体積に対する割合 | |
- 推 奨
a.肺癌に対する胸部放射線治療には直線加速器による6~10 MV X線を用いるよう勧められる。(グレードA)
b.放射線治療計画には,CTシミュレーションによる3次元治療計画を行うよう勧められる。(グレードA)
c.肺癌の放射線治療では,できるかぎり実測値に近い計算アルゴリズムを用いた不均質肺補正を行い,3次元的な線量分布を常に検討することを行うよう勧められる。(グレードB)
- a.
- 肺癌の胸部放射線治療では直線加速器による高エネルギーX線が用いられるが,エネルギーが低いと照射範囲内の線量不均一性が高度となり,逆にエネルギーが高すぎても標的辺縁ではビルドアップ効果により線量の低下を招く1)~4)。このようにX線の物理的特性から至適エネルギーとして6~10 MV X線の使用が推奨され,推奨レベルはグレードAとした。ただし,定位放射線照射の場合には4~6 MV X線が望ましい。
- b.
- 3次元治療計画により,ターゲットの線量を低下させることなく正常肺と心臓の平均線量を有意に減少できることが示されている5)~7)。生存率の向上や,晩期障害の軽減などの臨床成績での有用性は示されておらず,エビデンスレベルは低いが,CTシミュレーションによる3次元治療計画の有用性は自明であるので,推奨レベルはグレードAとした。
放射線治療単独例に対し,肺のDVHと放射線肺臓炎の関係について検討され,Grade 2(RTOGの基準)以上の放射線肺臓炎の発症リスクを低下させるには,V20が40%を超えないようにすることが重要であると報告されている8)。また,化学療法併用の際には,V20が25%を超えないように治療計画することを推奨している9)。さらに,全肺のV20だけではなくV30やMLDなどのパラメーターと放射線肺臓炎の発生との相関についても報告されている10)~12)。放射線食道炎の発症と食道のDVH解析についても検討されているが,現時点では臨床的に有意義なパラメーターは特定されていない13)。 - c.
- ファントムを用いた線量測定実験で,肺内孤立性腫瘍を10 MV X線で照射した場合,肺補正なしでは,線量は10~20%の過線量となる。一方,肺補正を行うと線量計算アルゴリズムによって8~18%の線量不足となる14)。臨床の肺癌症例での検討では,肺補正を行わないと5~28%の過線量となると報告されている14)~16)。また,肺野型腫瘍に対してはエネルギーの低いX線を用いたほうが良好な線量分布を得られると報告されている17)。正しい線量分布を得るには不均質肺補正を行う必要があるのは明らかだが,現在のところ肺補正の最適な計算アルゴリズムが示されておらず,過去に行われた肺補正なしの臨床成績との比較が困難となるなどの問題点もあるため,肺補正の使用に関する推奨はグレードBとした。
- 推 奨
- 放射線療法では,照射野設定,線量計算などの品質管理を適切に行うよう勧められる。(グレードA)
これらのエビデンスは多施設ランダム化比較試験をもとにした後ろ向き分析あるいは分析疫学的研究であるが,放射線療法の品質管理の必要性はランダム化比較試験で検証する性質のものではなく,その重要性は明白と考えられるので推奨グレードはAとした。
- 1)Phlips P, Rocmans P, Vanderhoeft P, et al. Postoperative radiotherapy after pneumonectomy: impact of modern treatment facilities. Int J Radiat Oncol Biol Phys. 1993; 27(3): 525-9. (V)
- 2)DesRosiers PM, Moskvin VP, DesRosiers CM, et al. Lung cancer radiation therapy: Monte Carlo investigation of“under dose”by high energy photons. Technol Cancer Res Treat. 2004; 3(3): 289-94. (V)
- 3)Osei EK, Darko J, Mosseri A, el al. EGSNRC Monte Carlo study of the effect of photon energy and field margin in phantoms simulating small lung lesions. Med Phys. 2003; 30(10): 2706-14. (V)
- 4)Wang L, Yorke E, Desobry G, et al. Dosimetric advantage of using 6 MV over 15 MV photons in conformal therapy of lung cancer: Monte Carlo studies in patient geometries. J Appl Clin Med Phys. 2002; 3(1): 51-9. (V)
- 5)Ragazzi G, Cattaneo GM, Fiorino C, et al. Use of dose-volume histograms and biophysical models to compare 2D and 3D irradiation techniques for non-small cell lung cancer. Br J Radiol. 1999; 72(855): 279-88. (V)
- 6)Schraube P, von Kampen M, Oetzel D, et al. The impact of 3-D radiotherapy planning after a pneumonectomy compared to a conventional treatment set-up. Radiother Oncol. 1995; 37(1): 65-70. (V)
- 7)DiBiase SJ, Werner-Wasik M, Croce R, et al. Standard off-cord lung oblique fields do not include the entire mediastinum: a computed tomography simulator study. Am J Clin Oncol. 2000; 23(3): 249-52. (V)
- 8)Graham MV, Purdy JA, Emami B, et al. Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for non-small cell lung cancer(NSCLC). Int J Radiat Oncol Biol Phys. 1999; 45(2): 323-9. (IV)
- 9)Tsujino K, Hirota S, Endo M, et al. Predictive value of dose-volume histogram parameters for predicting radiation pneumonitis after concurrent chemoradiation for lung cancer. Int J Radiat Oncol Biol Phys. 2003; 55(1): 110-5. (IV)
- 10)Hernando ML, Marks LB, Bentel GC, et al. Radiation-induced pulmonary toxicity: a dose-volume histogram analysis in 201 patients with lung cancer. Int J Radiat Oncol Biol Phys. 2001; 51(3): 650-9. (IV)
- 11)Fay M, Tan A, Fisher R, et al. Dose-volume histogram analysis as predictor of radiation pneumonitis in primary lung cancer patients treated with radiotherapy. Int J Radiat Oncol Biol Phys. 2005; 61(5): 1355-63. (IV)
- 12)Ramella S, Trodella L, Mineo TC, et al. Adding ipsilateral V20 and V30 to conventional dosimetric constraints predicts radiation pneumonitis in stage IIIA-B NSCLC treated with combined-modality therapy. Int J Radiat Oncol Biol Phys. 2010; 76(1): 110-5. (IV)
- 13)Rose J, Rodrigues G, Yaremko B, et al. Systematic review of dose-volume parameters in the prediction of esophagitis in thoracic radiotherapy. Radiother Oncol. 2009; 91(3): 282-7. (IV)
- 14)Yorke E, Harisiadis L, Wessels B, et al. Dosimetric considerations in radiation therapy of coin lesions of the lung. Int J Radiat Oncol Biol Phys. 1996; 34(2): 481-7. (V)
- 15)Orton CG, Chungbin S, Klein EE, et al. Study of lung density corrections in a clinical trial(RTOG 88-08). Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 1998; 41(4): 787-94. (V)
- 16)van’t Riet A, Stam HC, Mak AC, et al. Implications of lung corrections for dose specification in radiotherapy. Int J Radiat Oncol Biol Phys. 1985; 11(3): 621-5. (V)
- 17)Klein EE, Morrison A, Purdy JA, et al. A volumetric study of measurements and calculations of lung density corrections for 6 and 18 MV photons. Int J Radiat Oncol Biol Phys. 1997; 37(5): 1163-70. (V)
- 18)White JE, Chen T, McCracken J, et al. The influence of radiation therapy quality control on survival, response and sites of relapse in oat cell carcinoma of the lung: preliminary report of a Southwest Oncology Group study. Cancer. 1982; 50(6): 1084-90. (IV)
- 19)Schaake-Koning C, Kirkpatrick A, Kröger R, et al. The need for immediate monitoring of treatment parameters and uniform assessment of patient data in clinical trials. A quality control study of the EORTC Radiotherapy and Lung Cancer Cooperative Groups. Eur J Cancer. 1991; 27(5): 615-9. (IV)
- 20)Wallner PE, Lustig RA, Pajak TF, et al. Impact of initial quality control review on study outcome in lung and head/neck cancer studies--review of the Radiation Therapy Oncology Group experience. Int J Radiat Oncol Biol Phys. 1989; 17(4): 893-900. (IV)
- 21)Groom N, Wilson E, Lyn E, et al. Is pre-trial quality assurance necessary? Experiences of the CONVERT Phase III randomized trial for good performance status patients with limited-stage small-cell lung cancer. Br J Radiol. 2014; 87(1037): 20130653. (IV)
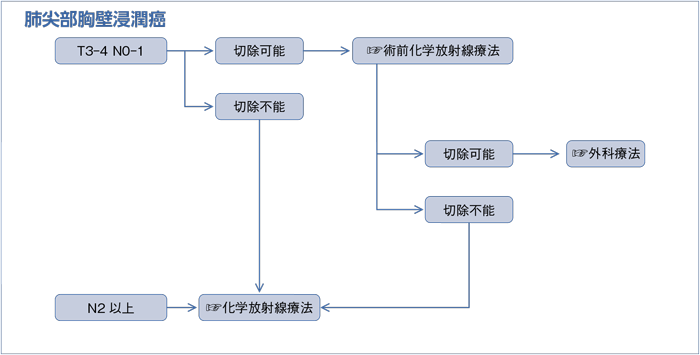
4-3.肺尖部胸壁浸潤癌
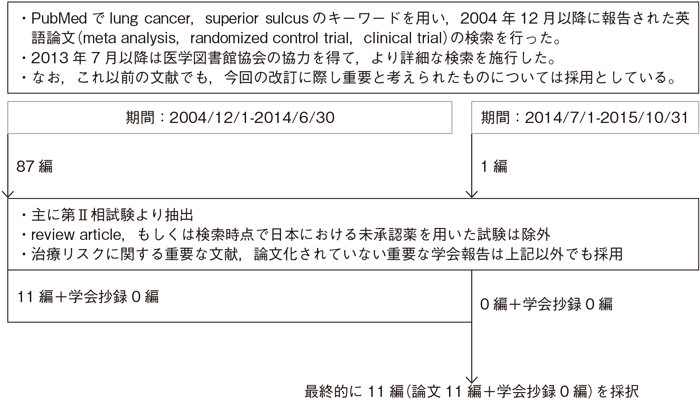
文献検索と採択
本文中に用いた略語および用語の解説
| CDDP | シスプラチン | |
|---|---|---|
| CPT-11 | 塩酸イリノテカン | |
| DTX | ドセタキセル | |
| ETP | エトポシド | |
| GEM | ゲムシタビン | |
| MVP療法 | マイトマイシン,ビンデシン,シスプラチン併用療法 | |
| PAC | パクリタキセル | |
| VNR | ビノレルビン | |
| 第3世代抗癌剤 | CPT-11,DTX,GEM,PAC,VNRの総称 | |
| CRT | Chemoradiotherapy | 化学放射線療法 |
| OS | Overall survival | 全生存期間 |
| RR | Response rate | 奏効率 |
| SST | Superior sulcus tumor | 肺尖部胸壁浸潤癌 |
樹形図
- 推 奨
- 切除可能な臨床病期T3-4N0-1症例に対しては術前化学放射線療法を施行後,外科治療を行うよう勧められる。(グレードB)
一方,SSTでは術後CRTに関してもランダム化比較試験やメタアナリシスは報告されていない。唯一,GomezらはSSTに対する手術治療+術後CRTの第Ⅱ相試験を行い,完全切除割合は72%で全例の5年OSが50%であったと報告した11)。しかしながら,本試験では,エントリー時の手術の可否基準が不明確であることに加え,登録期間が1994年から2007年までと長く,症例数も少なかった。したがって本研究の質に問題がある点は否めないことから,SSTに対する手術治療+術後CRTの有効性は推奨するだけの根拠に乏しいと考え得る。
- 1)Martinod E, D’Audiffret A, Thomas P, et al. Management of superior sulcus tumors: experience with 139 cases treated by surgical resection. Ann Thorac Surg. 2002; 73(5): 1534-9. (V)
- 2)Rusch VW, Parekh KR, Leon L, et al. Factors determining outcome after surgical resection of T3 and T4 lung cancers of the superior sulcus. J Thorac Cardiovasc Surg. 2000; 119(6): 1147-53. (V)
- 3)Alifano M, D’Aiuto M, Magdeleinat P, et al. Surgical treatment of superior sulcus tumors: results and prognostic factors. Chest. 2003; 124(3): 996-1003. (V)
- 4)Gandhi S, Walsh GL, Komaki R, et al. A multidisciplinary surgical approach to superior sulcus tumors with vertebral invasion. Ann Thorac Surg. 1999; 68(5): 1778-84. (V)
- 5)Komaki R, Roth JA, Walsh GL, et al. Outcome predictors for 143 patients with superior sulcus tumors treated by multidisciplinary approach at the University of Texas M. D. Anderson Cancer Center. Int J Radiat Oncol Biol Phys. 2000; 48(2): 347-54. (V)
- 6)Paulson DL. Carcinomas in the superior pulmonary sulcus. J Thorac Cardiovasc Surg. 1975; 70(6): 1095-104. (V)
- 7)Hagan MP, Choi NC, Mathisen DJ, et al. Superior sulcus lung tumors: impact of local control on survival. J Thorac Cardiovasc Surg. 1999; 117(6): 1086-94. (V)
- 8)Pfannschmidt J, Kugler C, Muley T, et al. Non-small-cell superior sulcus tumor: results of en bloc resection in fifty-six patients. Thorac Cardiovasc Surg. 2003; 51(6): 332-7. (V)
- 9)Rusch VW, Giroux DJ, Kraut MJ, et al. Induction chemoradiation and surgical resection for superior sulcus non-small-cell lung carcinomas: long-term results of Southwest Oncology Group Trial 9416(Intergroup Trial 0160). J Clin Oncol. 2007; 25(3): 313-8. (IV)
- 10)Kunitoh H, Kato H, Tsuboi M, et al. Phase II trial of preoperative chemoradiotherapy followed by surgical resection in patients with superior sulcus non-small-cell lung cancers: report of Japan Clinical Oncology Group trial 9806. J Clin Oncol. 2008; 26(4): 644-9. (IV)
- 11)Gomez DR, Cox JD, Roth JA, et al. A prospective phase 2 study of surgery followed by chemotherapy and radiation for superior sulcus tumors. Cancer. 2012; 118(2): 444-51. (IV)