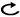2
Ⅱ.非小細胞肺癌
周術期治療(化学療法・放射線治療)
樹形図
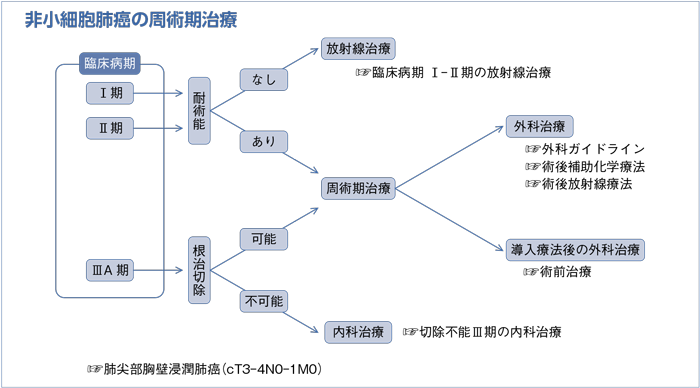
文献検索と採択
(術前治療・術後補助化学療法)
2-1.非小細胞肺癌の術前治療
2-1.非小細胞肺癌の術前治療(化学療法・放射線療法)
- 推 奨
a.臨床病期Ⅰ-ⅢA期に対して,術前プラチナ併用化学療法を考慮してもよい。(グレードC1)
b.肺葉切除可能な臨床病期ⅢA期(N2)に対して,術前化学放射線療法を考慮してもよい。(グレードC1)
c.切除不能例に対する導入療法後の外科治療は勧めるだけの根拠が明確でない。(グレードC2)
エビデンス
- a.
- 術前化学療法については,臨床病期Ⅰ-ⅢA期を対象としたメタアナリシスによって外科治療単独と比べて生存期間が延長することが示されている1)。
レジメンについては,これまで行われた多くの試験でプラチナ併用が採用されている。小規模なランダム化第Ⅱ相試験ではあるが,本邦において臨床病期Ⅰ-Ⅱ期に対するドセタキセル単剤とシスプラチン+ドセタキセル併用療法の比較が行われ2),こうした早期を対象にしても併用療法の有効性が確認されている。
化学療法の時期について,術前化学療法と術後補助化学療法を比較したメタアナリシスでは同等の有効性が示されている3)。しかしながらエビデンスの質・量とも術後補助化学療法が優っており,治療対象や行うべきレジメンが明確であることから,実地臨床においては(特に早期症例では)まず外科治療を行い,術後病理病期にしたがって補助化学療法の適応を検討することが多い。
以上より,術前化学療法のグレードはC1とした。 - b.
- INT0139試験は切除可能・pN2例に対し,化学放射線療法と導入化学放射線療法後の外科切除を比較した第Ⅲ相試験であるが,外科切除による生存期間延長は示されなかった4)。しかしながら,サブ解析では肺葉切除されたものにおいて外科切除追加の有用性が示唆されている。本邦でも同様の対象について,術前化学療法と術前化学放射線療法を比較する第Ⅲ相試験が行われた5)。症例集積が進まず有効性については十分な評価ができなかったものの,術前化学放射線療法の忍容性は良好であった。
以上より,肺葉切除可能な臨床病期ⅢA期(N2)に対する術前化学放射線療法はグレードC1とした。 - c.
- 切除不能・臨床病期Ⅲ期に対しては,通常,化学放射線療法が検討される。Down stagingを目的とした導入療法後の外科切除については,いくつかの検討があるが,その意義は明らかでない。
Meerbeeckらは,切除不能例に対し導入化学療法後にランダム化を行い,逐次放射線療法と外科切除の比較を行ったが,後者において生存期間延長は示されなかった6)。Thomasらは臨床病期Ⅲ期を対象に,術前化学療法と術前化学放射線療法の第Ⅲ相試験を行った。登録症例の約65%が切除不能なⅢB期で占められていたが,後者による生存期間延長は示されなかった7)。
以上より,切除不能・臨床病期Ⅲ期に対する導入療法後の外科切除を推奨するだけの科学的根拠は十分でないため,グレードC2とした。
引用文献
- 1)NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data. Lancet. 2014; 383(9928): 1561-71. (I)
- 2)Kunitoh H, Kato H, Tsuboi M, et al. A randomised phase II trial of preoperative chemotherapy of cisplatin-docetaxel or docetaxel alone for clinical stage IB/II non-small-cell lung cancer results of a Japan Clinical Oncology Group trial(JCOG 0204). Br J Cancer. 2008; 99(6): 852-7. (III)
- 3)Lim E, Harris G, Patel A, et al. Preoperative versus postoperative chemotherapy in patients with resectable non-small cell lung cancer: systematic review and indirect comparison meta-analysis of randomized trials. J Thorac Oncol. 2009; 4(11): 1380-8. (I)
- 4)Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet. 2009; 374(9687): 379-86. (II)
- 5)Katakami N, Tada H, Mitsudomi T, et al. A phase 3 study of induction treatment with concurrent chemoradiotherapy versus chemotherapy before surgery in patients with pathologically confirmed N2 stage IIIA nonsmall cell lung cancer(WJTOG9903). Cancer. 2012; 118(24): 6126-35. (II)
- 6)van Meerbeeck JP, Kramer GW, Van Schil PE, et al. Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst. 2007; 99(6): 442-50. (II)
- 7)Thomas M, Rübe C, Hoffknecht P, et al. Effect of preoperative chemoradiation in addition to preoperative chemotherapy: a randomised trial in stage III non-small-cell lung cancer. Lancet Oncol. 2008; 9(7): 636-48. (II)
2-2.非小細胞肺癌の術後補助化学療法
樹形図
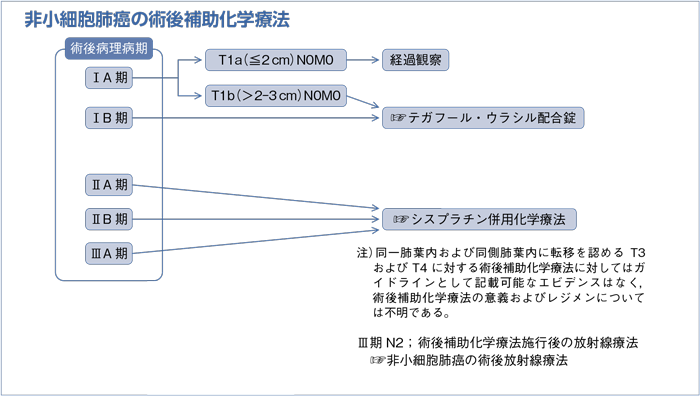
2-2-1.非小細胞肺癌の術後補助化学療法(術後病理病期Ⅰ期)
- 推 奨
- 術後病理病期ⅠA期のT1bN0M0およびⅠB期,完全切除例に対して,
a.腺癌症例では,テガフール・ウラシル配合剤療法を行うよう勧められる。(グレードB)
b.非腺癌症例では,テガフール・ウラシル配合剤療法を行うよう考慮してもよい。(グレードC1)
エビデンス
西日本肺癌グループでは,Ⅰ-Ⅲ期を対象に,CDDP+VDS+テガフール・ウラシル配合剤(UFT)とUFT,手術単独の3群についての比較試験が行われ,5年生存率でUFT群は64%と手術単独群の49%と比し,有意に良好であった1)。その後,Japan Lung Cancer Research Group(JLCRG)でⅠ期肺腺癌に対するUFTの効果を検討する第Ⅲ相試験が行われ,全体では3%(85%→88%),ⅠB期(T>3 cm)においては11%(74%→85%)の上乗せ効果が認められた2)。あと4つの臨床試験を加えて行われたメタアナリシス(2,003症例;腺癌84%)の結果,全体で5%(77%→82%)の5年生存率の改善を認め,UFTの有効性が確認された。組織型別にみると,腺癌においてHR 0.69(95%CI:0.56-0.85)に対し,扁平上皮癌においてはHR 0.82(95%CI:0.57-1.19)であった3)。TNM分類の改訂(第7版)により,T1はT1a(腫瘍径2 cm以下),T1b(腫瘍径>2 cmで,かつ3 cm以下)の2つのグループに分類されることになり,新しい分類に基づくサブグループ解析がなされたが,T1bにおいて6%(82%→88%)の5年生存率の改善,HR 0.62(95%CI:0.42-0.90)と良好な結果を示した4)。
よって,腫瘍径2 cmを超える術後病理病期Ⅰ期の完全切除例に対してはUFT療法が考慮される。ただし上述のように,特に腺癌を中心としてUFTの有効性が証明されているのに対し,非腺癌は検討症例数が少数であることなどからそのエビデンスは十分といえない。よって,腺癌症例に対する推奨グレードはB,非腺癌症例に対する推奨グレードはC1とした。
よって,腫瘍径2 cmを超える術後病理病期Ⅰ期の完全切除例に対してはUFT療法が考慮される。ただし上述のように,特に腺癌を中心としてUFTの有効性が証明されているのに対し,非腺癌は検討症例数が少数であることなどからそのエビデンスは十分といえない。よって,腺癌症例に対する推奨グレードはB,非腺癌症例に対する推奨グレードはC1とした。
2-2-2.非小細胞肺癌の術後補助化学療法(術後病理病期Ⅱ-ⅢA期)
- 推 奨
- 術後病理病期Ⅱ-ⅢA期,完全切除例に対して,シスプラチンの投与が可能であれば術後にシスプラチン併用化学療法を行うよう勧められる。(グレードB)
エビデンス
1995年にNon-small Cell Lung Cancer Collaborative Groupより手術単独群と術後補助化学療法群のランダム化比較試験のメタアナリシスが報告され,CDDP併用療法の術後補助化学療法で相対死亡危険率を13%減少し,有意差は認めないが5年生存率を5%改善するとの結果であった5)。このメタアナリシスの結果をもとにInternational Adjuvant Lung Cancer Trial Collaborative Group(IALT),JBR.10およびAdjuvant Navelbine International Trial Association(ANITA)trialなどの比較試験が行われ,いずれもCDDP併用療法を術後補助化学療法として行うことで無病生存率および5年生存率の向上が得られた6)~8)。長期フォローアップの結果においても術後補助化学療法の有用性が再確認されたが9)10),術後5年を超えるとその差が縮まることも示された9)。これらの比較試験に,Adjuvant Lung Cancer Project Italy(ALPI)11),Big Lung Trial(BLT)12)を加えた,5つの比較試験について,4,584症例の個々のデータに基づくメタアナリシスが行われた(Lung Adjuvant Cisplatin Evaluation;LACE)。その結果,術後生存に対するハザード比0.89(95%CI:0.82-0.96)と,術後補助化学療法による有意な延命効果が示された。病期別のハザード比では,ⅠA期で1.40(0.95-2.06),ⅠB期で0.93(0.78-1.10),Ⅱ期で0.83(0.73-0.95),Ⅲ期で0.83(0.72-0.94)という結果であった13)。サブグループ解析として,CDDP+VNRに限ったメタアナリシスもなされ,ハザード比0.80(0.70-0.91),手術単独に対するCDDP+VNRの生存率向上は,Ⅱ期で43%が54%,Ⅲ期で25%が40%で,生存率向上効果が顕著であった14)。これまでの34の臨床試験,8,447症例を集めたメタアナリシスでも同様の結果が示され,エビデンスレベルとしてはⅠである15)。
しかし,これらのエビデンスがすべて国外のデータ(一部の試験には本邦の施設も参加)であることなど,本邦の肺癌治療への外挿性を総合的に判断した結果,推奨グレードをBとした。担当医は患者・患者家族に対してこのエビデンスを十分に説明したうえでシスプラチン併用化学療法を行うかどうかを決定することが望ましい。
しかし,これらのエビデンスがすべて国外のデータ(一部の試験には本邦の施設も参加)であることなど,本邦の肺癌治療への外挿性を総合的に判断した結果,推奨グレードをBとした。担当医は患者・患者家族に対してこのエビデンスを十分に説明したうえでシスプラチン併用化学療法を行うかどうかを決定することが望ましい。
引用文献
- 1)Wada H, Hitomi S, Teramatsu T, et al. Adjuvant chemotherapy after complete resection in non-small-cell lung cancer. West Japan Study Group for Lung Cancer Surgery. J Clin Oncol. 1996; 14(4): 1048-54. (II)
- 2)Kato H, Ichinose Y, Ohta M, et al. A randomized trial of adjuvant chemotherapy with uracil-tegafur for adenocarcinoma of the lung. N Engl J Med. 2004; 350(17): 1713-21. (II)
- 3)Hamada C, Tanaka F, Ohta M, et al. Meta-analysis of postoperative adjuvant chemotherapy with tegafur-uracil in non-small-cell lung cancer. J Clin Oncol. 2005; 23(22): 4999-5006. (I)
- 4)Hamada C, Tsuboi M, Ohta M, et al. Effect of postoperative adjuvant chemotherapy with tegafur-uracil on survival in patients with stage IA non-small cell lung cancer: an exploratory analysis from a meta-analysis of six randomized controlled trials. J Thorac Oncol. 2009; 4(12): 1511-6. (I)
- 5)Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ. 1995; 311(7010): 899-909. (I)
- 6)Arriagada R, Bergman B, Dunant A, et al. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med. 2004; 350(4): 351-60. (II)
- 7)Winton T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer. N Engl J Med. 2005; 352(25): 2589-97. (II)
- 8)Douillard JY, Rosell R, De Lena, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer(Adjuvant Navelbine International Trialist Association[ANITA]): a randomised controlled trial. Lancet Oncol. 2006; 7(9): 719-27. (II)
- 9)Arriagada R, Dunant A, Pignon JP, et al. Long-term results of the international adjuvant lung cancer trial evaluating adjuvant Cisplatin-based chemotherapy in resected lung cancer. J Clin Oncol. 2010; 28(1): 35-42. (II)
- 10)Butts CA, Ding K, Seymour L, et al. Randomized phase III trial of vinorelbine plus cisplatin compared with observation in completely resected stage IB and II non-small-cell lung cancer: updated survival analysis of JBR-10. J Clin Oncol. 2010; 28(1): 29-34. (II)
- 11)Scagliotti GV, Fossati R, Torri V, et al; Adjuvant Lung Project Italy/European Organisation for Research Treatment of Cancer-Lung Cancer Cooperative Group Investigators. Randomized study of adjuvant chemotherapy for completely resected stage I, II, or IIIA non-small-cell Lung cancer. J Natl Cancer Inst. 2003; 95(19): 1453-61. (II)
- 12)Waller D, Stephens RJ, Milroy GR, et al. Chemotherapy for patients with non-small cell lung cancer: the surgical setting of the Big Lung Trial. Eur J Cardiothorac Surg. 2004; 26(1): 173-82. (II)
- 13)Pignon JP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008; 26(21): 3552-9. (I)
- 14)Douillard JY, Tribodet H, Aubert D, et al. Adjuvant cisplatin and vinorelbine for completely resected non-small cell lung cancer: subgroup analysis of the Lung Adjuvant Cisplatin Evaluation. J Thorac Oncol. 2010; 5(2): 220-8. (I)
- 15)Arriagada R, Auperin A, Burdett S, et al; NSCLC Meta-analyses Collaborative Group. Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer: two meta-analyses of individual patient data. Lancet. 2010; 375(9722): 1267-77. (I)
レジメン:非小細胞肺癌の術後補助化学療法
術後テガフール・ウラシル配合剤療法
| テガフール・ウラシル配合剤 | 250 mg/m2 per day | 1~2年間内服 |
|---|
術後シスプラチン併用療法(本邦での投与量)
| CDDP | 80 mg/m2 on day 1 | 3週毎,4サイクル |
|---|---|---|
| VNR | 25 mg/m2 on day 1,8 |
2-3.非小細胞肺癌の術後放射線療法
文献検索と採択
〔術後放射線治療(術後照射)〕

2-3.非小細胞肺癌の術後放射線療法(術後照射)
- 推 奨
a.縦隔リンパ節転移のないⅠ-Ⅱ期の非小細胞肺癌に対しては,術後放射線療法は標準治療として行わないよう勧められる。(グレードD)
b.縦隔リンパ節転移を有するⅢA期(N2)非小細胞肺癌に対しては,術後放射線療法を行うことを考慮してもよい。(グレードC1)
エビデンス
- a.
- PORT Meta-analysis Trialists Groupによるメタアナリシスの結果,術後放射線療法によりむしろ予後は悪化し(HR 1.18)1),2年生存率を58%から53%に5%引き下げる結果であった。サブセット解析では予後の悪化はⅠ-Ⅱ期,N0-1において明確であった2)。
- b.
- 一方,Ⅲ期N2においては術後放射線療法の予後増悪効果は明確ではなかった1)2)。また,サブセット解析ではあるが,ANITA TrialにおいてはⅢ期N2症例に限れば,術後化学療法施行後に放射線療法を追加することによる予後改善の可能性が示唆された3)。
Ⅲ期N2症例に対する術後化学療法と術後化学放射線療法とのランダム化比較試験の結果,術後化学放射線療法群の無増悪生存率は有意に良好(5年30.3% vs 18.8%)であった。全生存率も良好な傾向を示し(5年37.9% vs 27.5%),複数個のN2リンパ節転移を認めた症例での予後の改善は明確であった4)。
各臨床試験で使用された放射線治療装置(コバルトvsリニアック)により層別化したうえでのメタアナリシスの結果,リニアックを用いる術後放射線療法では,有意に局所再発リスクが減少(術後放射線療法群のHR 0.31)し,予後も改善することが報告された(術後放射線療法群のHR 0.76)5)。
引用文献
- 1)Burdett S, Stewart L; PORT Meta-analysis Group. Postoperative radiotherapy in non-small-cell lung cancer: update of an individual patient data meta-analysis. Lung Cancer. 2005; 47(1): 81-3. (I)
- 2)PORT Meta-analysis Trialists Group. Postoperative radiotherapy for non-small cell lung cancer. Cochrane Database Syst Rev. 2005; 18(2): CD002142. (I)
- 3)Douillard JY, Rosell R, De Lena M, et al. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer treated with adjuvant chemotherapy: the adjuvant Navelbine International Trialist Association(ANITA)Randomized Trial. Int J Radiat Oncol Biol Phys. 2008; 72(3): 695-701. (III)
- 4)Shen WY, Ji J, Zuo YS, et al. Comparison of efficacy for postoperative chemotherapy and concurrent radiochemotherapy in patients with IIIA-pN2 non-small cell lung cancer: an early closed randomized controlled trial. Radiother Oncol. 2014; 110(1): 120-5. (II)
- 5)Billiet C, Decaluwé H, Peeters S, et al. Modern post-operative radiotherapy for stage III non-small cell lung cancer may improve local control and survival: a meta-analysis. Radiother Oncol. 2014; 110(1): 3-8. (IV)